脑型肝豆状核变性脑皮层及皮层下核团体积的磁共振研究
康泰山,杨天和*,林建忠,蔡聪波,张家兴
肝豆状核变性是一种常染色体隐性遗传的铜代谢障碍疾病,体内蓄积的铜离子沉积在肝、脑、肾、角膜等处而引起器官功能损害,其中以中枢神经系统损害为主的称为脑型肝豆状核变性[1],目前尚欠缺对该疾病脑灰质病变的系统性定量研究。因此本研究选择基于体素的形态学测量方法对30例脑型肝豆状核变性患者与30名健康志愿者进行比较研究,以期了解脑型肝豆状核变性患者的脑皮层及深部灰质核团的损害特点。
1 材料与方法
1.1 研究对象
搜集2009年10月至2014年3月30例首次确诊且未经临床治疗的脑型肝豆状核变性患者,所有病例均经我院神经内科检查确诊和收治。其中,男24例,女6例,年龄18~28岁,平均(23.6±2.9)岁,均为右利手。临床诊断标准为:(1)进行性震颤、肌僵直、构语障碍等锥体外系症状、体征;(2)角膜K-F环阳性;(3)血清铜蓝蛋白<200 mg/L;(4)尿铜>100 μg/24 h。所有入组患者除了神经系统症状外,均伴有以上临床表现,其中5例患者有轻度肝功能异常。肝豆状核变性的诊断以2001年莱比锡城第8届国际威尔森氏病会议制定的评分系统为依据[2]。另招募30名年龄[(23.3±2.7)岁]、性别(男24名、女6名)及教育背景程度匹配的健康志愿者组成对照组。所有患者和对照组志愿者均无家族性精神疾病,无脑外伤史,无高血压、心肺疾病及内分泌系统疾病。本研究经厦门大学附属中山医院医学伦理委员会批准并经所有研究对象签署知情同意书。
1.2 MRI扫描参数及图像分析
MRI检查采用Siemens 3.0 T Verio超导扫描仪和8通道头颅线圈。主要扫描参数:常规横断面T2WI TSE(TR 5800 ms,TE 96 ms),FOV 220 mm×220 mm,矩阵320×320,层厚5 mm,层间隔0.5 mm,共28层;3D T1WI矢状位扫描参数为:TR 1900 ms,TE 2.7 ms,TI 900 ms,FA为9°,FOV 250 mm×250 mm,矩阵256×256,层厚1 mm (总共176层)。在扫描期间,固定受试者头部,要求保持安静状态,平卧于扫描仪内。
采用脑功能处理软件(functional MRI software library,FSL;Version 5.06)对3D T1WI图像进行处理。
脑皮层基于体素的形态学测量(voxel_based morphometry,VBM)分析:(1)使用FSL-FIRST工具,线性配准MNI模板,并进行场校正,去除脑外结构;(2)分割脑灰、白质,非线性配准、创建模板并融合成4D图像;(3)设计矩阵:双样本t检验,检验次数60!/(30!×30!)次;(4)采用基于体素随机置换检验并基于自由阈值的cluster水平进行校正;(5)获取显著差异像数(经TFCE校正,P<0.05),以MNI模板的各个脑叶为模板,分别获取左、右半球各个脑叶显著差异体积及该模板各个脑叶总体积(图1,2)。
脑深部灰质核团的分析:使用FSL-FIRST对核团容积表面网格参数化,形成一个点分布参照模型,可变形曲面自动参数化使其与数据顶点的对应。处理过程包括:场校正,线性配准MNI模板上,分割脑干、丘脑、伏隔核、尾状核、壳核、苍白球及杏仁核,形成表面网格化三维图进行顶点分析(图3),步骤:(1)融合各个结构网格化三维图形成4D网格化图;(2)设计矩阵(双样本t检验);(3)进行基于表面的顶点分析并输出结果(到达参照模型顶点以红色表示,未到达顶点以蓝色表示,蓝色深浅反映其萎缩程度),进行FDR校正,以P<0.05,获得结果;获取各个核团的体积。
1.3 统计分析
采用SPSS (版本17.0)进行统计分析,数据结果以x±s表示,以P<0.05为差异有统计学意义。双侧各脑叶皮质萎缩率计算公式为:患者皮质萎缩率=(对照组脑叶皮质体积均值-患者相应脑叶皮质体积)/对照组脑叶皮质体积均值×100%,获取左、右半球脑叶皮质显著萎缩体积计算萎缩率、对比左、右半球皮质损害差异。获取对照组脑干及各核团体积均值,然后以对照组体积均值为分母,分别计算双侧基底节各核团及脑干萎缩率,计算公式为:患者各核团及脑干萎缩率=(对照组结构体积均值-患者相应结构体积)/对照组结构体积均值×100%。所得数据进行方差分析,两两比较萎缩率差异。
2 结果
2.1 脑干及脑深部核团信号改变
磁共振常规平扫直接观察发现,有25例患者苍白球、21例患者壳核、18例患者尾状核、18例患者丘脑、10例患者伏隔核、15例患者脑干均呈T1WI低信号和T2WI高信号,且无明显软化灶。3例患者豆状核(壳核、苍白球)呈T1WI高信号和T2WI低信号。2例患者豆状核呈T1WI等信号和T2WI低信号。
2.2 VBM结果
VBM显示双侧额、顶、枕、颞和岛叶皮质均扩散性萎缩(图2)。分别获取左、右半球各脑叶体积并计算大脑各个脑叶皮质和小脑皮质的萎缩率,结果如表1。各个脑叶出现不同程度的皮质萎缩,其中以岛叶损害最为明显;两侧对应脑叶皮质萎缩具有显著性差异。
2.3 FSL-FIRST分析结果
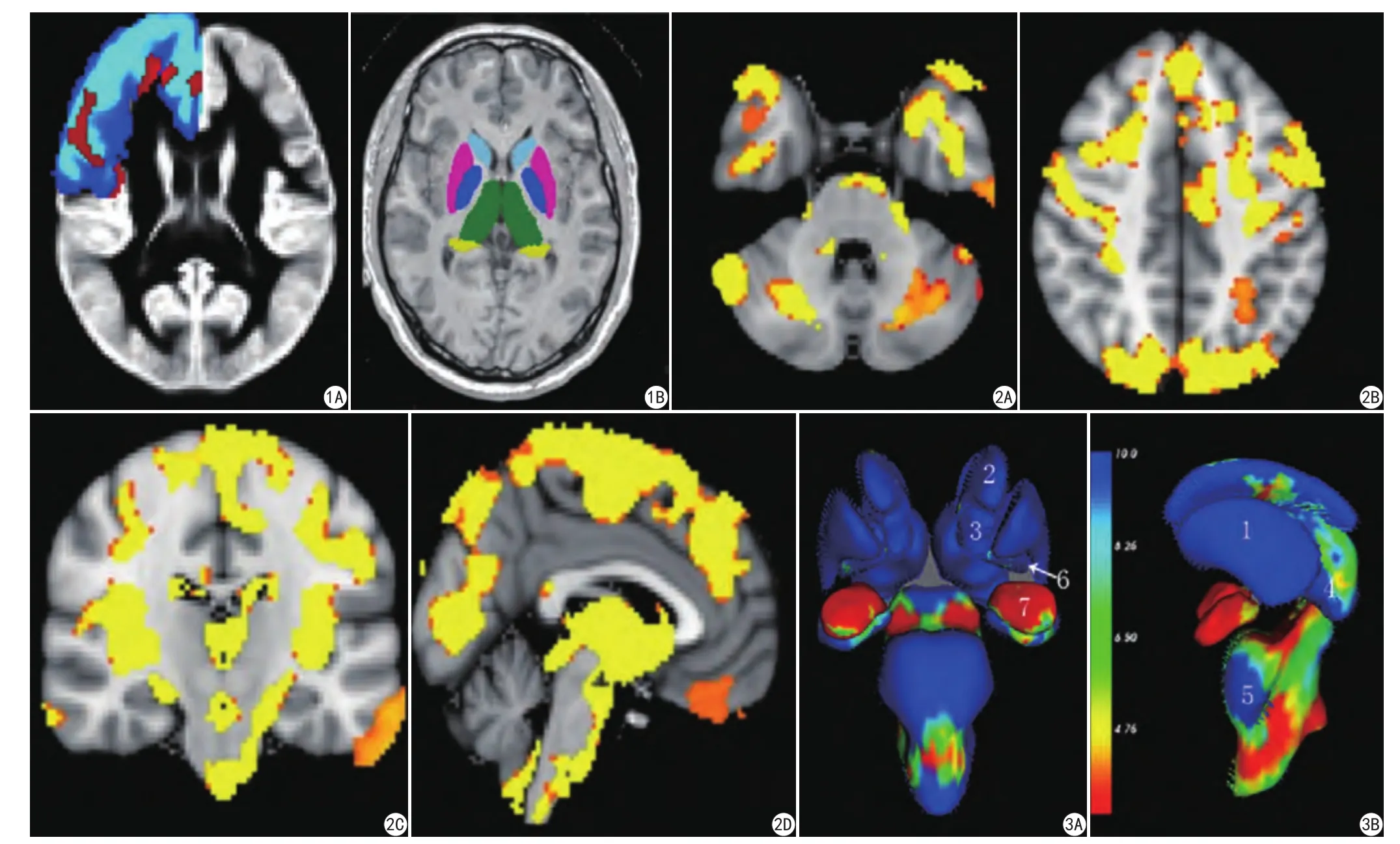
图1 A:脑皮层灰质体积VBM分析示意图。灰色为本组模板,蓝色为MNI额叶模板,红色为FSL-VBM统计分析后显著差异像素,依次获取各个脑叶显著差异像素和该脑叶模板像素。B:基底节核团分割示意图。淡蓝色:尾状核;浅红色:壳核;蓝色:苍白球;绿色:丘脑;黄色:海马尾部 图2 脑灰质体积的VBM分析。A、B:轴状面显示;C:冠状面显示;D:矢状面显示。大脑、小脑和脑干灰质体积广泛性减小(黄色代表显著减少区域) 图3 脑干和脑深部核团的顶点分析。A:冠状位显示;B:矢状位显示。红色表示到达顶点,灰质体积无显著性变化;蓝色表示未到达顶点,灰质体积显著减小。1:壳核;2:尾状核;3:伏隔核;4:丘脑;5:脑干;6:苍白球;7:杏仁核Fig. 1 A: The schematic diagram of cortical gray matter volume analysis using VBM. Gray indicates the template of the group, blue indicates the MNI frontal leaf template, and red indicates the signi ficant difference pixel after the statistical analysis of FSLVBM. The signi ficant difference pixels of each brain leaf and the brain leaf template pixels were sequentially obtained. B: The schematic diagrams of basal ganglion nuclei. light blue: caudate nucleus; light red: putamen; blue: globus pallidus; green: thalamus; yellow:tail of hippocampus. Fig. 2 VBM analysis of gray matter of brains. A, B: Axial plane. C: Coronal plane. D: Sagittal plane. The volumes of cerebral cortices, cerebellum, and brain stem were signi ficantly decreased (yellow indicates the decreased regions). Fig. 3 Vertex analyses of brain stem and deep gray matters. A: Coronal plane. B: Sagittal plane. Red indicates reaching the apex and a normal volume. Blue means no reaching the apex and indicates a decreased volume. 1: Shell nucleus. 2: Caudate nucleus. 3: Nucleus accumbens. 4: Thalamus. 5: Brain stem. 6: Globus pallidus. 7: Amygdala.

表1 肝豆状核患者各大脑叶及小脑的平均皮质体积、萎缩率及双侧皮质萎缩率对比差异(x±s)Tab. 1 Voxels and atrophy of cortical gray matter and cerebellum in the patients with hepatolenticular nucleus (x±s)
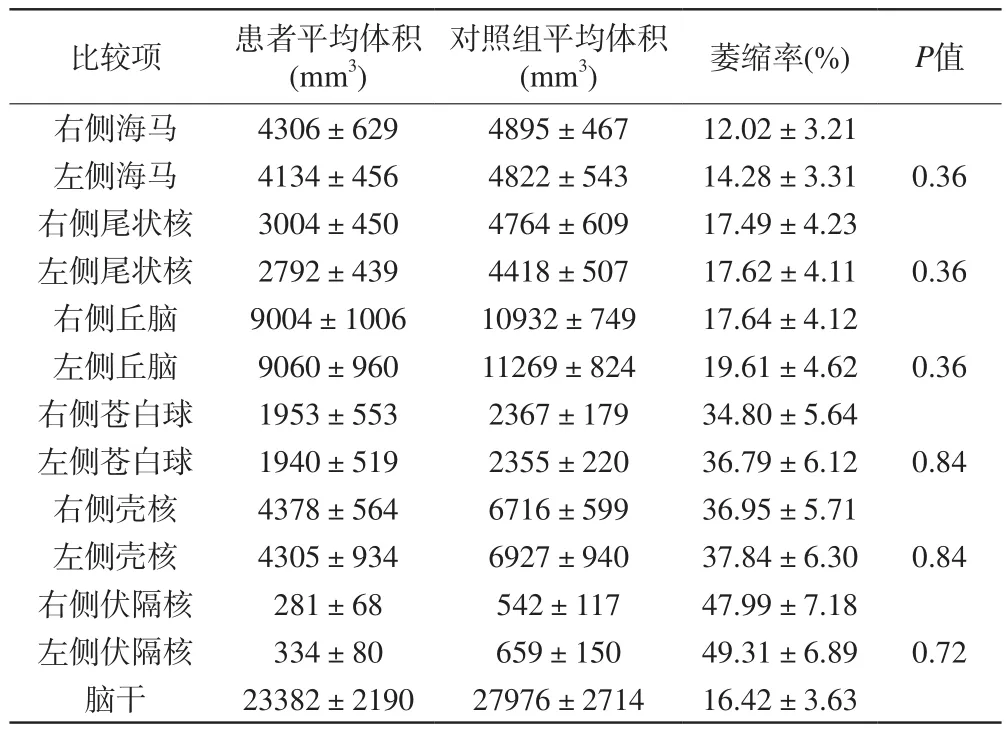
表2 脑干和左、右大脑深部核团体积、萎缩率比较及双侧核团萎缩率对比差异(x±s)Tab. 2 Comparisons of atrophy rate in the brainstem and bilateral hemispheres (x±s)
FSL-FIRST顶点分析显示(图3),除杏仁核外,壳核、苍白球、尾状核、伏隔核及脑干均有显著萎缩;各个结构体积均值统计结果:除杏仁核外,基底节核团体积均值减少均有显著差异,P<0.05(左侧伏隔核及右侧苍白球,方差不齐,采用非参数检验,其余采用独立样本t检验);各个结构萎缩率方差齐性检验P=0.25,P>0.05,方差齐同,进行方差分析两两比较结果见表2,基底节核团(除杏仁核外)双侧对应结构萎缩率差异无统计学意义(P>0.05);双侧伏隔核萎缩最明显,其次为壳核及苍白球,再来就是丘脑、尾状核反脑干。
3 讨论
3.1 脑神经细胞损伤
铜蓝蛋白合成障碍是脑型肝豆状核变性最基本的遗传缺陷。铜离子进入血液,选择性沉积在脑、肾、角膜等肝外组织,一旦神经系统和神经胶质代偿能力耗尽,就出现临床症状。其细胞毒性机制可能与过多结合蛋白质和核酸、生物膜的脂质氧化及产生过多的氧自由基有关。大部分文献对肝豆状核变性引起脑结构改变仅强调过量铜沉积[3],往往忽略该病还有以下特点:(1)铜蓝蛋白合成障碍所致铜蓝蛋白不足,而铜蓝蛋白作为铜的供体参与细胞色素C及其他铜蛋白合成,具有亚铁氧化酶作用,可将亚铁氧化为高铁状态,同时参与细胞铁代谢;另外,在血浆铜蓝蛋白作用下,神经细胞内Mn2+可氧化成Mn3+,再经铁传递蛋白转运至脑毛细血管脉络丛;铜蓝蛋白不足时,可造成神经细胞内铁、锰沉积,最终导致神经元凋亡和神经退行性变[4-6]。(2)过量的铜在肝沉积造成肝损害,导致血氨升高,进而干扰了脑的三羧酸循环导致大脑能量供应不足、血脑屏障通透性增加引发脑水肿、脑内神经递质的改变。血氨还可以刺激脑细胞对L-精氨酸的摄取,使一氧化氮产生增加,从而改变大脑的灌注。(3)过量的铜在肾沉积造成肾脏处理氨及其他有毒代谢产物的能力下降,必将又进一步加重脑损伤[7-11]。
3.2 脑型肝豆状核变性患者大脑皮层的变化
本研究发现:(1)与对照组比较,脑型肝豆状核变性患者深部核团以伏隔核损害最为明显,其次为壳核(壳核、苍白球),再者是丘脑、尾状核;这些核团双侧萎缩率对比无显著差异。我们的结果与既往研究不同[12],可能由于既往的研究主要肉眼观察,伏隔核易误认为尾状核头部。伏隔核的95%神经元是中型多棘γ-氨基丁酸(GABA)能投射神经元,肝功能障碍时,肝脏对GABA的清除能力下降,血氨升高亦导致脑内GABA含量显著增加,过量GABA导致该结构损伤[13];(2)双侧杏仁核无明显萎缩,这可能与基因缺陷的器官选择性及亲和性损害有关;(3)脑干显著萎缩,但这是否与铜、铁及锰沉积或肝功能损害引起代谢性脑损害有关尚不明确。可以肯定的是经脑干上、下走行的神经纤维髓鞘存在损害。既往大多数研究认为大脑深部核团损害主要是铜沉积引起的神经元显著减少或轴突变性,但最近一些研究证实其损害是源于不同比例铜、铁、锰的沉积[10,14],特别是铁及锰顺磁性物质沉积所致。此对解释基底节核团复杂的MRI信号改变提供有力的基础。
本研究发现脑型肝豆状核变性患者大脑皮层的变化为:(1)双侧额、顶、枕、颞、岛叶都存在不同程度皮质萎缩,此与Piga等[15]运用PET研究发现的弥漫性或局限性皮质低血流灌注及Lee等[16]利用磁敏感加权成像发现的弥漫皮层矿化改变结果相似,说明该病大脑皮质损害特点具有弥漫性。(2)小脑的萎缩。近年来有学者做相关报道,主要是铜对皮层神经细胞的毒性作用及重金属在小脑核团的沉积促使小脑萎缩[17]。张春芸等[18]研究小脑、丘脑、中央前后回及额中回的灰质萎缩,提出肝豆状核变性患者锥体外系症状与小脑- 丘脑- 皮层回路参与的运动功能改变有关。(3)各脑叶中以岛叶损害最明显。Sureka等[19]发现血氨升高最易损害岛叶,因此岛叶皮层萎缩最明显原因可能血氨升高及金属(铜、铁及锰)沉积共同作用的结果。(4)额叶及岛叶以左侧损害明显,颞、枕及顶叶以右侧损害明显,左右两侧脑叶损害具有显著差异。支持我们结果的证据有肝豆状核变性患者脑的皮层诱发电位也表现为左右差异[20]。人脑的多种功能表现为一侧优势。最近的研究表明,与结扎右侧大脑中动脉比较,结扎左侧大脑中动脉后大鼠的感觉运动能力损害的更严重[21]。动物实验显示钴的浓度在肝豆状核变性模型大鼠小脑、纹状体和下丘脑中含量较其它脑区显著增加[22],而钴的聚集会损害神经细胞,这可能与本研究观察到的小脑萎缩有关。
3.3 本研究存在一定的局限性
未能将患者的临床症状数据和本研究数据做相关性分析,本研究仅分析脑灰质的改变,对于脑白质的改变需增加扫描序列有待进一步的分析。在今后的研究中将增加收集样本量,完善相关临床信息采集,加强随访力度,让研究更加全面、深入。
3.4 结论
对于具有复杂临床表现的各型肝豆状核变性,其受累脑叶的萎缩程度及定量检测方面尚存在不足,故有必要在此基础上加深研究。脑型肝豆状核变性引起大脑皮质呈非对称性弥漫损害和大部分基底节核团对称性损害。MRI结合临床神经系统症状、实验室检查和SPECT有助于该病的分型。另外,MRI还可在随访、疗效观察和早期检测铜的持续毒性影响方面起诊断作用。新的MRI扫描技术或许可以在脑的多种金属代谢障碍方面扮演更重要角色,值得进一步研究。临床上,脑型和非脑型在影像方面的表现差异有待进一步揭示。
利益冲突:无。

