松赤枯病病原的快速分子检测
袁 川,吴 南,刘应高,许秀兰,赵景阳,李万艳
(1.广安市林业技术推广站,四川 广安 638000;2.四川省林业有害生物防治协会,四川 成都 610081;3.四川农业大学林学院, 四川 成都 611130)
由枯斑拟盘多毛孢(PestalotiapsisfunereaDesm.)引起的松赤枯病是松树幼龄林上常见的病害,分布广、危害严重。该病在四川自1974年开始发生危害,到1980年流行以来,已成为主要针叶林木病害,居林木病害首位[1~4]。目前对松赤枯病的检测主要是在病害表现出一定的症状之后,通过症状观察,用组织分离的方法,以“形态结构特征为主、生理生化、细胞化学和生态特征为辅”的分类原则进行鉴定[5],但这种方法耗时耗材,并且病害表现出症状后就已经给林木造成危害,不利于病害的早期诊断与防控。
利用病原菌在rDNA的ITS区段既具保守性,又在科、属、种水平上均有序列多态性,对ITS区进行PCR扩增、测序及序列分析后再设计特异引物来诊断和检测植物病原菌,尤其是植物病原真菌的分子检测已越来越被广泛应用[6~8]。依据真菌种内ITS区保守序列设计引物可实现对该种真菌在患病植物体内的特异性扩增。
本研究为提高松赤枯病的检测效率,通过针对枯斑拟盘多毛孢设计特异性引物与待测松树基因组DNA进行PCR扩增反应,在松赤枯病症状出现前检测出病原物的有无,为该病害的早期防治提供依据,以达到提前预防该病害的目的。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试菌株由四川农业大学林学院森林保护实验室提供,阳性对照为枯斑拟盘多毛孢菌株;阴性对照为星形拟盘多毛孢、散沫拟盘多毛孢、针叶散斑壳、松针散斑壳、尖孢镰刀菌株。
表1供试菌株一览表
1.1.2 样本采集与处理
于2015年9月至2016年8月,对四川泸定二郎山林场和成都蒲江县石象湖马尾松林中随机选择4—5个样地中的高山松(Pinus.densataMast)、华山松(P.armandiiFranch.)、云南松(P.yunnanensisFranch)、马尾松(P.massoniana)的1年生针叶共计进行9次采样。采得样本按叶尖、叶中和叶基分成3段,经75%的酒精表面消毒处理后,保存于-70 ℃的冰箱备用。
1.1.3 试验试剂
植物基因组DNA提取试剂盒(DP305)、DNA分子量标准DL2000、PCR反应试剂(北京天根生化科技有限公司),琼脂糖(北京赛百胜基因技术有限公司)。
1.2 试验仪器
5804R冷冻离心机(德国Eppendorf公司),iCycler-PCR扩增仪、Sub-Cell水平电泳仪、Gel DocTM XR凝胶成像系统(美国BIO-RAD公司),电热恒温水浴锅(天津民利科学器材厂)。
1.3 试验方法
1.3.1 松针基因组DNA和菌丝DNA的提取
利用天根植物组DNA提取试剂盒提取松针与菌丝基因组DNA,操作步骤见说明书。DNA提取物经1.5%琼脂糖凝胶电泳检测完整性后,于紫外分光度计检测浓度,并用buff TE稀释至终浓度为1 μg·μL-1,-20℃保存待用。
1.3.2 引物设计与合成
从Genbank库中查找下载枯斑拟盘多毛孢的DNA ITS区序列及同属其他菌种同源基因,用Clustal进行多序列比对,DNA Star根据差异位点进行引物设计。设计出AF,GQ-1,GQ-2,GQ-3四对引物。委托北京六合华大基因科技股份有限公司进行引物AF,GQ-1,GQ-2,GQ-3与在已发表的相关文献中选取的3对引物(ITS4-ITS5[10],LROR-LR5[11],LR3R-LR3[11])的合成。

表2枯斑拟盘多毛孢菌的7对PCR引物序列
1.3.3 rDNA-ITS扩增及产物测序
以所提松针基因组DNA作为模板,使用1.3.2所设计合成的引物对进行PCR扩增。反应体系50 μL:5μL松针基因组DNA原液,25 μLPremix,上下游引物各2 μL(10 μmol·L-1),用ddH2O补足50 μL。反应在iCycler-PCR仪上进行,程序为:95 ℃预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,进行35个循环;72 ℃延伸7 min,10 ℃保存[9]。取5 μL PCR产物在1.5%琼脂糖凝胶100 V下电泳20 min,260 nm紫外灯下观察并照相。将条带清晰的PCR产物送往北京六合华大基因科技股份有限公司纯化测序。参考Genbank库中枯斑拟盘多毛孢序列并与测序结果进行blastn比对,以确定扩增产物是否为枯斑拟盘多毛孢。
1.3.4 特异性检测
以枯斑拟盘多毛孢菌株为阳性对照,星形拟盘多毛孢、散沫拟盘多毛孢、针叶散斑壳、松针散斑壳、尖孢镰刀菌株为阴性对照,ddH2O为空白对照,采用1.3.2所述引物对,按照1.3.3的反应体系进行特异性检测。
2 结果与分析
2.1 引物筛选与扩增结果验证验证
据Genbank库中枯斑拟盘多毛孢的ITS区序列,采用DNAStar工具共设计引物8对,使用BLAST软件验证引物特异性,筛选出4对(AF,GQ-1,GQ-2,GQ-3),在已发表的相关文献中选取引物3对(ITS4-ITS5[10],LROR-LR5[11],LR3R-LR3[11]),分别对实验室保存的枯斑拟盘多毛孢的菌丝DNA进行PCR反应,反应结果见图1。

图1 7对引物扩增枯斑拟盘多毛孢菌丝DNA的电泳图谱M:DL2000 Marker;1:AF;2:GQ-1;3:GQ-2;4:GQ-3;5:ITS4-ITS5;6:LROR-LR5;7:LR3R-LR3
从图1可以看出,引物AF条带明亮、且无杂带,满足特异扩增的要求。
使用引物AF对枯斑拟盘多毛孢和实验室存有的已报道过的其它树栖真菌菌丝DNA同时进行PCR反应,反应结果见图2。

图2 AF引物扩增几种树栖真菌菌丝DNA的电泳图谱M:DL2000 Marker;1:枯斑拟盘多毛孢;2:CK(空白);3:星形拟盘多毛孢;4:散沫拟盘多毛孢;5:针叶树散斑壳;6:松针散斑壳;7:尖孢镰刀菌
从图2可以看出,阳性样品枯斑拟盘多毛孢条带明亮、且无杂带,阴性样品及空白对照条带较暗或无条带,表明引物AF对枯斑拟盘多毛孢具有较强的特异性。
2.2 PCR反应及电泳结果
试验共采样9次,每次的样品DNA分别进行PCR反应及电泳检测后,华山松、高山松针叶的电泳图无条带,结果表明,华山松、高山松针叶上全年均没有检测到松赤枯病病原菌。在2016年3月前采集的马尾松、云南松针叶样品的电泳图无条带,结果表明,在2016年3月前采集的马尾松、云南松针叶上均没有检测到松赤枯病病原菌。
将2016年3月在蒲江石象湖采集的马尾松针叶DNA,按叶尖、叶中、叶基分别发生PCR反应,反应结果见图3。

图3 马尾松赤枯病1号样地2016年3月检测结果图M:DL2000 Marker;1-3:松针尖部;4-6:松针中部;7-9:松针基部
结果表明,2016年3月在蒲江石象湖采集的马尾松松针尖部,首先检测到侵染针叶的枯斑拟盘多毛孢,而针叶中部、基部均没有检测到枯斑拟盘多毛孢。
将2016年3月在泸定二郎山采集的云南松针叶DNA,按叶尖、叶中、叶基分别进行PCR反应,反应结果见图4。
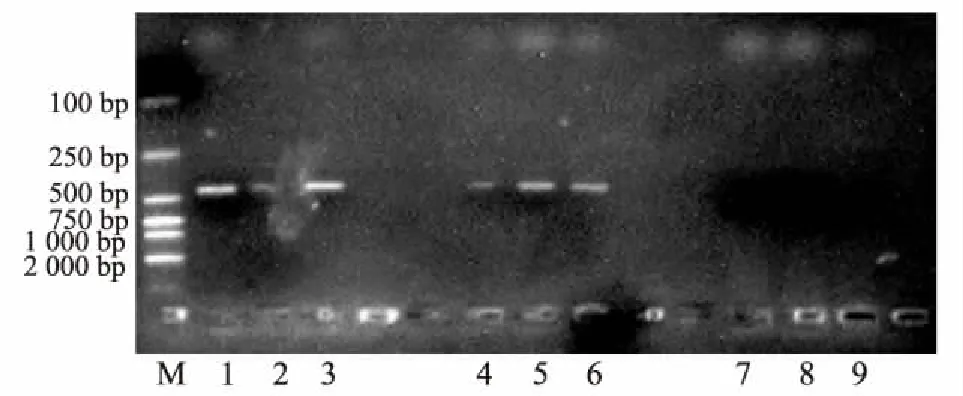
图4 云南松赤枯病2016年3月检测结果图M:DL2000 Marker;1-3:松针尖部;4-6:松针中部;7-9:松针基部
结果表明,2016年3月在泸定二郎山采集的云南松松针尖部、中部,首先检测到侵染针叶的枯斑拟盘但电泳图谱中针叶中部条带较暗,无法测序,而针叶基部没有检测到枯斑拟盘多毛孢。
将2016年5月在泸定二郎山采集的云南松针叶DNA,按叶尖、叶中、叶基分别进行PCR反应,反应结果见图5。
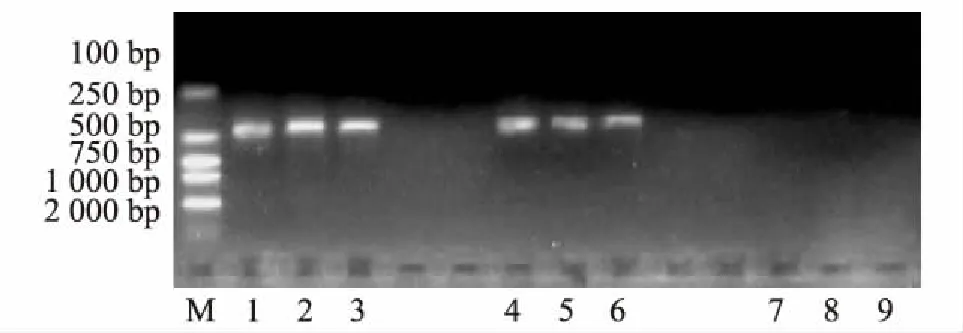
图5 云南松赤枯病2016年5月检测效果图M:DL2000 Marker;1-3:松针尖部;4-6:松针中部;7-9:松针基部
结果表明,2016年5月在泸定二郎山采集的侵染云南松的枯斑拟盘多毛孢在其针叶尖部、中部均被检测出来,电泳条带明显比3月时更明亮,针叶基部仍没有检测到枯斑拟盘多毛孢。
将2016年6月在泸定二郎山采集的云南松针叶DNA,按叶尖、叶中、叶基分别进行PCR反应,反应结果见图6。

图6 云南松赤枯病2016年6月检测结果图M:DL2000 Marker;1-3:松针尖部;4-6:松针中部;7-9:松针基部
结果表明,2016年6月在泸定二郎山采集的云南松的枯斑拟盘多毛孢在其针叶尖部、中部、基部均被检测出来,电泳条带除针叶基部略暗外,针叶尖部、中部都比较明亮。
2.3 测序及序列比对
条带明亮的PCR产物由北京六合华大基因科技股份有限公司测序,测序样品共15个,共得到8条理想的序列,在Genbank中与已注册的枯斑拟盘多毛孢序列AF405299.1、GQ412730.1经BLAST比对后[12],相似度均高达97%~99%,并得到了枯斑拟盘多毛孢的ITS1和ITS2区序列,可以确定枯斑拟盘多毛孢侵染了马尾松、云南松针叶。
3 结论与讨论
3.1 结论
试验表明,根据Genbank库已有的枯斑拟盘多毛孢序列,通过其ITS区序列设计特异性引物,对松针基因组DNA进行PCR扩增的方法来检测处于潜伏期的枯斑拟盘多毛孢是可行的。使用这种方法可以提前两个月检测出松赤枯病病原,为病害防治争取了时间,同时也可以为病原真菌大规模的分类鉴定及分子检测工作提供参考。
3.2 讨论
从2016年3月开始检测到枯斑拟盘多毛孢,这是因为此时正是枯斑拟盘多毛孢以分生孢子和菌丝体在松树病叶中越冬完毕,在春季到来气候适宜时开始大量生长传播[13,14],当新生针叶处于速生期,此时叶表皮细胞未全部角质化,抗逆能力差,病害便相继发生[15]。随着时间的推移,该菌在针叶上的量也增加,此时从松针中提取到的枯斑拟盘多毛孢DNA相比之前也大量增加,故检测结果也逐渐明显。
实验最先在松针尖部检测到枯斑拟盘多毛孢,可以初步判定该菌先从针叶尖部侵染松针,这是因为松针尖部相对中部、基部而言,自然孔口更大,同时也相对柔嫩容易受伤,而枯斑拟盘多毛孢侵染松针的时候,是从自然孔口或伤口侵入[16],所以松针尖部相对更易被病菌侵染。
植物病原真菌的检测鉴定大多采用传统方法,即分离培养、显微镜观察形态及简单的生理性状测定等,但由于这种以形态结构为基础的鉴定方法往往会受到人为因素和环境条件干扰,许多子实体类型经常难以获得,给鉴定工作带来困难,而且耗时长、不适合快速鉴定的要求。而常见的利用ITS序列来检测植物真菌病害主要是先分离得到纯培养的病原菌菌株,进而得到其菌丝DNA,再利用通过引物ITS1和ITS4进行PCR反应,扩增出病原菌的ITS区序列,针对ITS序列设计特异性引物来对植物真菌病害进行分子检测[17~19]。本研究立足于前人的研究成果,直接从植物组织中提取植物组织基因组DNA,通过在Genbank库中查询已报道过的病原菌序列,通过分析该序列并设计特异性引物,然后对整个植物组织基因组DNA进行PCR反应,扩增出植物组织中可能含有的病原菌的ITS序列,达到检测病害的目的。相对而言,这种方法更省时、高效,节约了病害检测的时间和成本,有利于大规模的推广应用。

