少根紫萍对湿地污染水体的修复研究
乐思秀,王 静,李国林,李 师,王 鑫,白九元,赵 云
(四川大学生命科学学院生物资源与环境教育部重点实验室,四川 成都 610065)
湿地系指自然或人工、长久或暂时性的沼泽地、泥炭地或水域地带,静止或流动的淡水、半咸水、咸水体,包括低潮时水深不超过6 m的水域[1]。湿地系统与森林、海洋并称为全球三大生态系统,作为一个特殊的生态系统,对生物圈的稳定有着不可或缺的作用。
随着社会工业化进程的加快,湿地环境污染问题也越发严重,其中以水体富营养化最显著。水体富营养化不仅影响水生生物的生长,同时也会对人类健康造成危害,其产生的最大原因是人类活动中产生的大量含氮、磷的污水未经处理直接排放到自然水体中,导致水体功能恶化,水生系统遭到破坏,进而促使水体中藻类的爆发性增长,造成“水华”现象。据相关报道,世界上25%~70%的水体产生水华现象后都会产生次生有毒代谢物—藻毒素,而微囊藻毒素(Microcystin,MCs)则是水体富营养化后出现频率最高、释放量最多、危害最大的藻毒素[2]。微囊藻毒素可以通过食物链进入动物体内,导致动物肝脏细胞抗氧化系统紊乱,引发肝癌而致死[3]。如何简单有效地处理这些污水、抑制藻类生长、改善水体环境已成为近几年来的研究热点。研究者们尝试了许多方法来解决水体的富营养化问题[4~6],主要修复方法有物理、化学、生物修复,物理化学修复很容易造成二次污染,且成本较高,因此利用水生生态系统中原有的水生植物对这些污水进行修复是现在普遍应用的方法[7]。
浮萍科植物生长在静止或缓慢流动的淡水中,约有37个种,5个属(Spirodela,Landoltia,Lemna,Wolffiella和Wolffia)[8],广泛分布在世界各地。浮萍进行无性生殖,因此生长速度快,生物量能在短时间(2 d~7 d)内增长1倍,且生长周期可达9~12个月,因此能快速降低污水中氮、磷等营养物质和其他污染物[9]。同时浮萍的适应能力强,附带价值高,相关研究表明,许多浮萍物种的淀粉含量在3%~75%之间[10],全株可作为鱼类和家禽家畜的饲料。浮萍还是一种新型能源植物,因为其高蛋白、高淀粉等特点被广泛用于酒精发酵[11]、燃料乙醇[12,13]等。因此在利用浮萍净化污染水体时,既可减少水中过剩的营养元素,还可在一定程度上抑制藻类生物的生长,防止其大量繁殖造成水华现象,从而抑制有毒物质的释放。同时浮萍采收方式简单,经过加工,可实现资源与物质的循环利用,是一种具有广阔前景的植物。
本实验以少根紫萍(ZHOO51)和铜绿微囊藻(FACHB930)为材料,通过室内模拟富营养化水体,将不同浓度梯度少根紫萍和铜绿微囊藻单独或共培养,研究少根紫萍对水体修复情况等,找出最适共培养浓度,为少根紫萍用于湿地污染水体修复研究提供一点实验基础。
1 材料和方法
1.1 实验材料
铜绿微囊藻(Microcystisaeruginosa,FACHB-930),购买于中国科学院武汉水生生物研究所淡水藻种库,用BG11培养液培养扩增。少根紫萍(Spirodelapunctata,ZH0051),取自中国科学院成都生物研究所,用Hoagland培养液进行扩大培养繁殖,以备后续实验使用。
1.2 实验设计
本实验于四川大学生命科学学院B区9楼组培室进行,组培室平均温度为24℃。实验采用室内模拟富营养化水体的方式,选用17.5 cm×12.5 cm×5.5 cm的不透光的塑料盒为实验器具,每个塑料盒中加入800 mL的1/5 Hoagland培养液。
将铜绿微囊藻在BG11培养液中培养至藻浓度为107个·mL-1,而后以此为母液,按照0 mL·L-1、20 mL·L-1、40 mL·L-1、80 mL·L-1、160 mL·L-1(实际铜绿微囊藻接种浓度为0、2×108、4×108、8×108、1.6×109个·mL-1)5个浓度梯度,向塑料盒中接种铜绿微囊藻。挑选长势良好的少根紫萍,用自来水冲洗多次后再用蒸馏水清洗,去除少根紫萍表面的污垢杂质。而后按照以下5个浓度梯度:0 mg·m-2、100 mg·m-2、200 mg·m-2、400 mg·m-2、800 mg·m-2,采用双因素5×5正交试验,将上述铜绿微囊藻和少根紫萍接种于Hoagland培养液中。每隔3 d测定培养液中TN、TP的含量。培养15 d后,测定培养液和少根紫萍体内铜绿微囊藻毒素(MCS)含量。实验期间蒸发的水分用蒸馏水补充,每个处理设置3个生物学重复。
1.3 实验方法
1.3.1 少根紫萍生长状况的测定 植物鲜重测定:除去其表面水分后,按照Bergmann的方法[11]进行测量。植物干重测定:称取容器体积约3/4的少根紫萍,脱水放置于50℃的烘箱烘干至恒重后测定少根紫萍的干重。叶绿素含量的测定:利用丙酮乙醇混合液法[14]。
1.3.2 TN、TP含量的测定 TN含量测定采用碱性过硫酸钾消解紫外分光光度法测(GB11894-89)[15]。 TP含量测定采用钼酸铵分光光度法测定含量(GB11893-89)[16]。
1.3.3 藻毒素含量测定 藻毒素含量测定采用双抗体夹心法[17]所需试剂及操作步骤参考上海酶联生物公司微囊藻毒素酶联免疫分析试剂盒测定。
1.4 分析方法
所有数据均使用Microsoft Excel 2010软件进行数据处理,并用Graphpad Prism 7.0进行作图,采用IBM SPSS Statistics 19.0软件进行单因素、双因素方差分析和LSD多重比较分析。用不同的小写字母a、b和c等表示在同一少根紫萍浓度下,不同铜绿微囊藻浓度处理间的显著差异性(p<0.05)。
2 实验结果
2.1 铜绿微囊藻对少根紫萍生长的影响
不同浓度的铜绿微囊藻对少根紫萍的生长影响不同,如图1 a~d所示,随着铜绿微囊藻浓度的增加,少根紫萍的鲜重、干重、增长率及总叶绿素均呈现先增加后减少的趋势。在铜绿微囊藻浓度为20 mL·L-1时,少根紫萍鲜重、干重、增长率及总叶绿素含量均显著高于其他处理组。铜绿微囊藻浓度为40 mL·L-1与80 mL·L-1时,少根紫萍的鲜重、干重(浓度400 mg·m-2组除外)与空白对照相比无显著性差异,而在铜绿微囊藻浓度为160 mL·L-1时,所有浓度少根紫萍的鲜重、干重及增长率均显著低于对照组。随着少根紫萍浓度的增加,鲜重和干重逐渐增加,但增长率和总叶绿素则呈现先增加后下降。在铜绿微囊藻浓度为20 mL·L-1时、少根紫萍浓度为400 mg·m-2时,少根紫萍的干重(2.03 mg)、总叶绿素(0.624 mg)最高均是组内最高,表明低浓度铜绿微囊藻在一定程度促进了少根紫萍的生长。
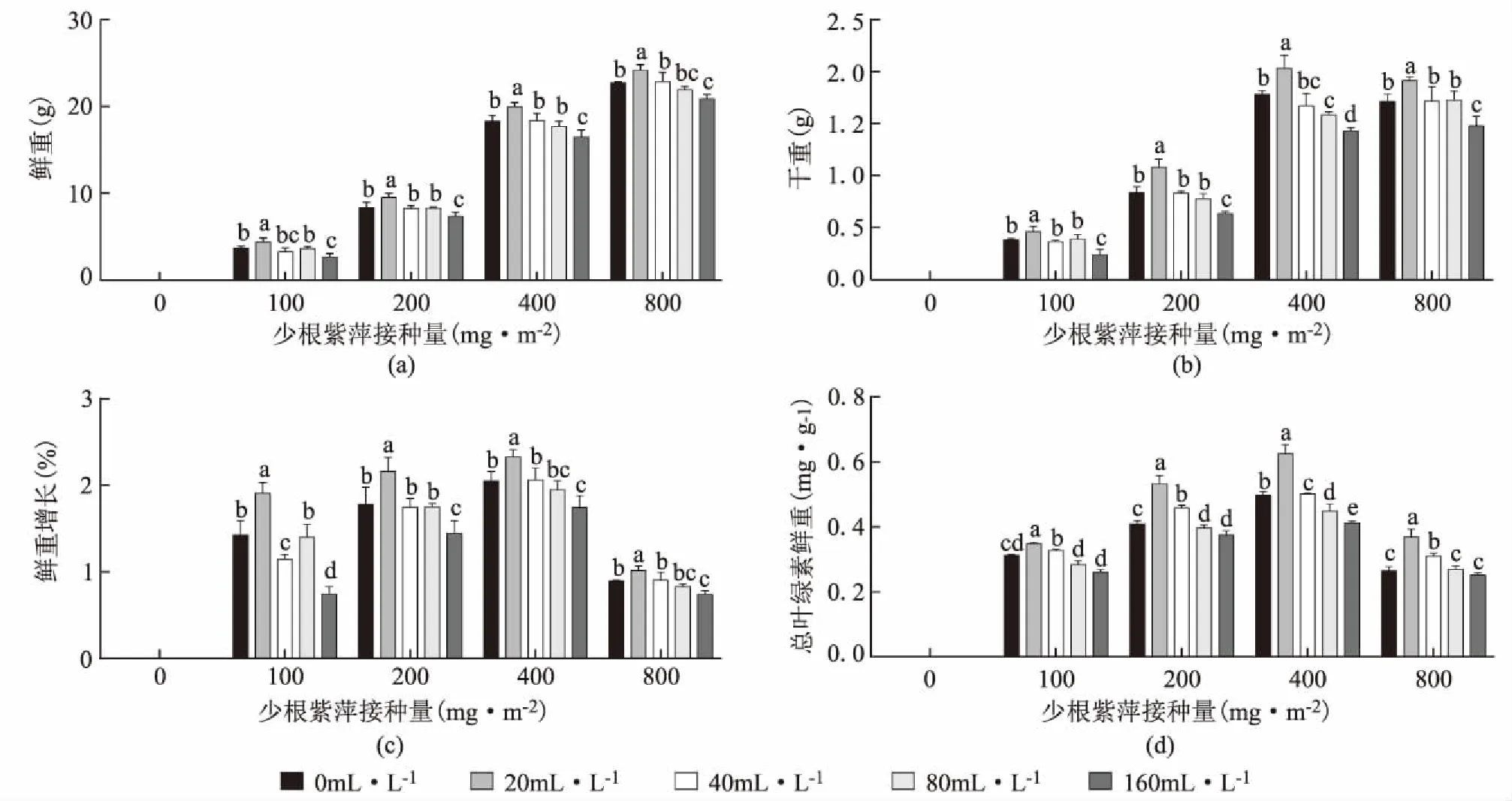
图1 铜绿微囊藻对少根紫萍生长的影响Fig.1 Effects of Microcystis aeruginosa on the growth of Spirodela punctataa:鲜重;b:干重;c:鲜重增长率;d:总叶绿素含量;不同颜色柱为不同铜绿微囊藻浓度;不同字母表示同组数据间存在显著差异性,p<0.05
2.2 培养液中TN含量的变化
图2为少根紫萍和铜绿微囊藻共培养后培养液中TN含量随时间的变化趋势图。当铜绿微囊藻单独培养时,随着培养天数的增加,TN含量随着接种浓度的增加而逐渐降低,且培养液中TN含量下降速度较为缓慢,当培养6 d后达到相对稳定的状态,到15 d后下降到36.24 mg·L-1~46.69 mg·L-1。接种少根紫萍后,随着培养天数的增加,所有少根紫萍接种浓度培养液中的TN含量逐渐减少。少根紫萍浓度为100 mg·m-2和200 mg·m-2时,培养9 d后少根紫萍对TN进入缓慢吸收状态,到15 d后下降到29.60 mg·L-1~36.54 mg·L-1和29.34 mg·L-1~38.17 mg·L-1;少根紫萍浓度为400 mg·m-2和800 mg·m-2时,TN含量培养12 d后进入缓慢吸收状态,到15 d后下降到23.88 mg·L-1~31.57 mg·L-1和17.85 mg·L-1~26.73 mg·L-1。其中铜绿微囊藻浓度为20 mL·L-1时,各少根紫萍处理组吸收效果均为最好。
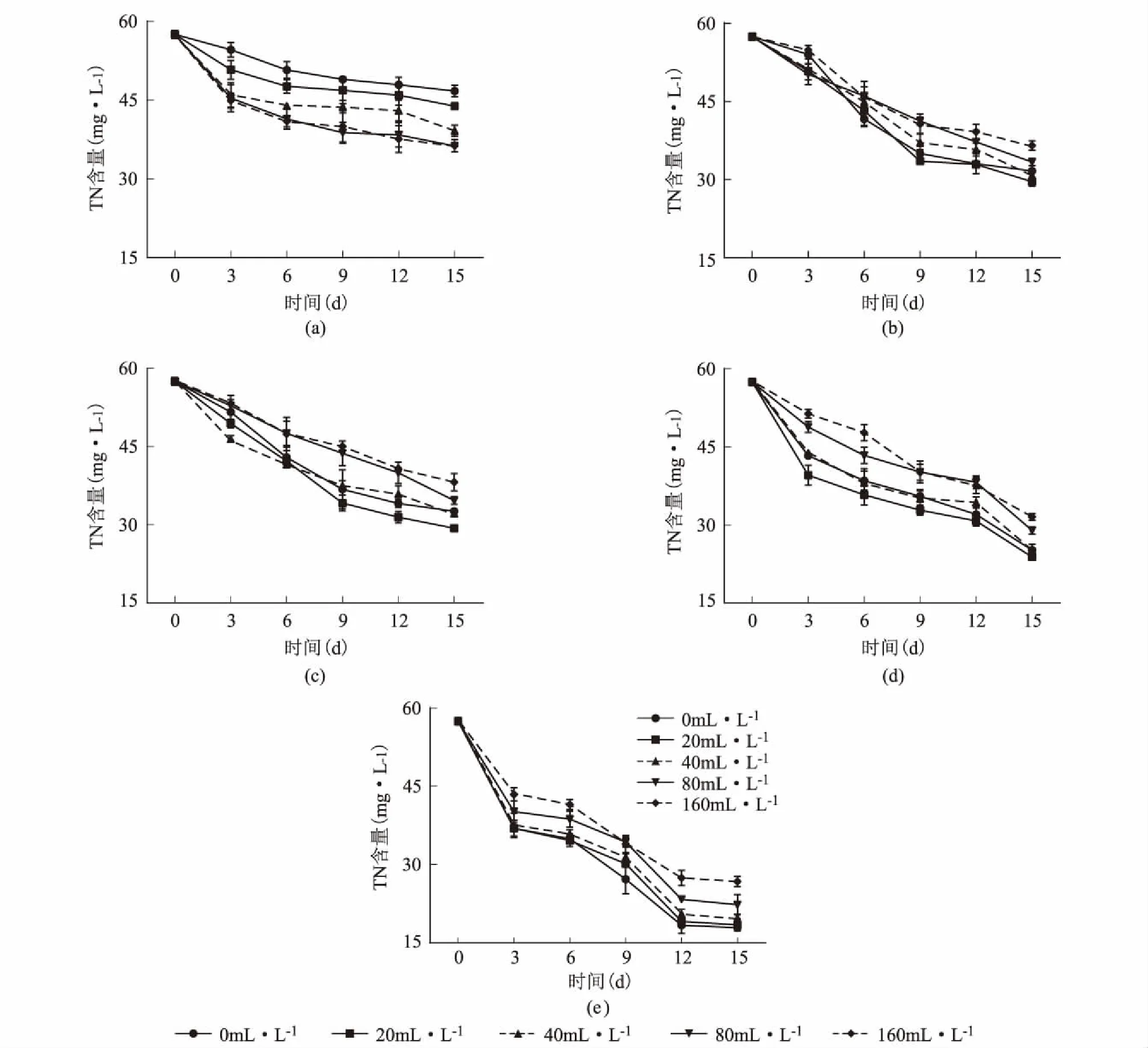
图2 培养液中TN含量的变化趋势(不同折线表示不同铜绿微囊藻浓度)Fig.2 The TN content (mg·L-1) in the culture medium少根紫萍接种量:a:0 mg·m-2;b:100 mg·m-2;c:200 mg·m-2;d:400 mg·m-2;e:800 mg·m-2
2.3 培养液中TP含量的变化
图3为少根紫萍和铜绿微囊藻共培养后培养液中TP含量随时间的变化趋势图。如图3所示,当铜绿微囊藻单独培养时,TP含量下降速度虽然较为缓慢,但随着培养天数的增加,TP含量随着铜绿微囊藻接种浓度的增加而逐渐降低,当培养6 d后达到相对稳定状态,进入缓慢吸收阶段,到15 d后下降到14.40 mg·L-1~23.68 mg·L-1。接种少根紫萍后,随着培养天数的增加,所有少根紫萍接种浓度培养液中的TP含量逐渐减少;少根紫萍浓度为100 mg·m-2和200 mg·m-2时,TN含量培养6 d后进入缓慢吸收状态,15 d后下降到6.38 mg·L-1~10.48 mg·L-1和5.54 mg·L-1~9.66 mg·L-1;少根紫萍浓度为400 mg·m-2和800 mg·m-2时,存在两个阶段,0~3 d时,是快速吸收阶段,吸收了63.36%~75.44%和80.39%~90.92%;培养3 d后进入缓慢吸收状态, 15 d后下降到4.57 mg·L-1~7.06 mg·L-1和0.65 mg·L-1~2.15 mg·L-1。当少根紫萍浓度为800 mg·m-2时,对TP的吸收效果最好。
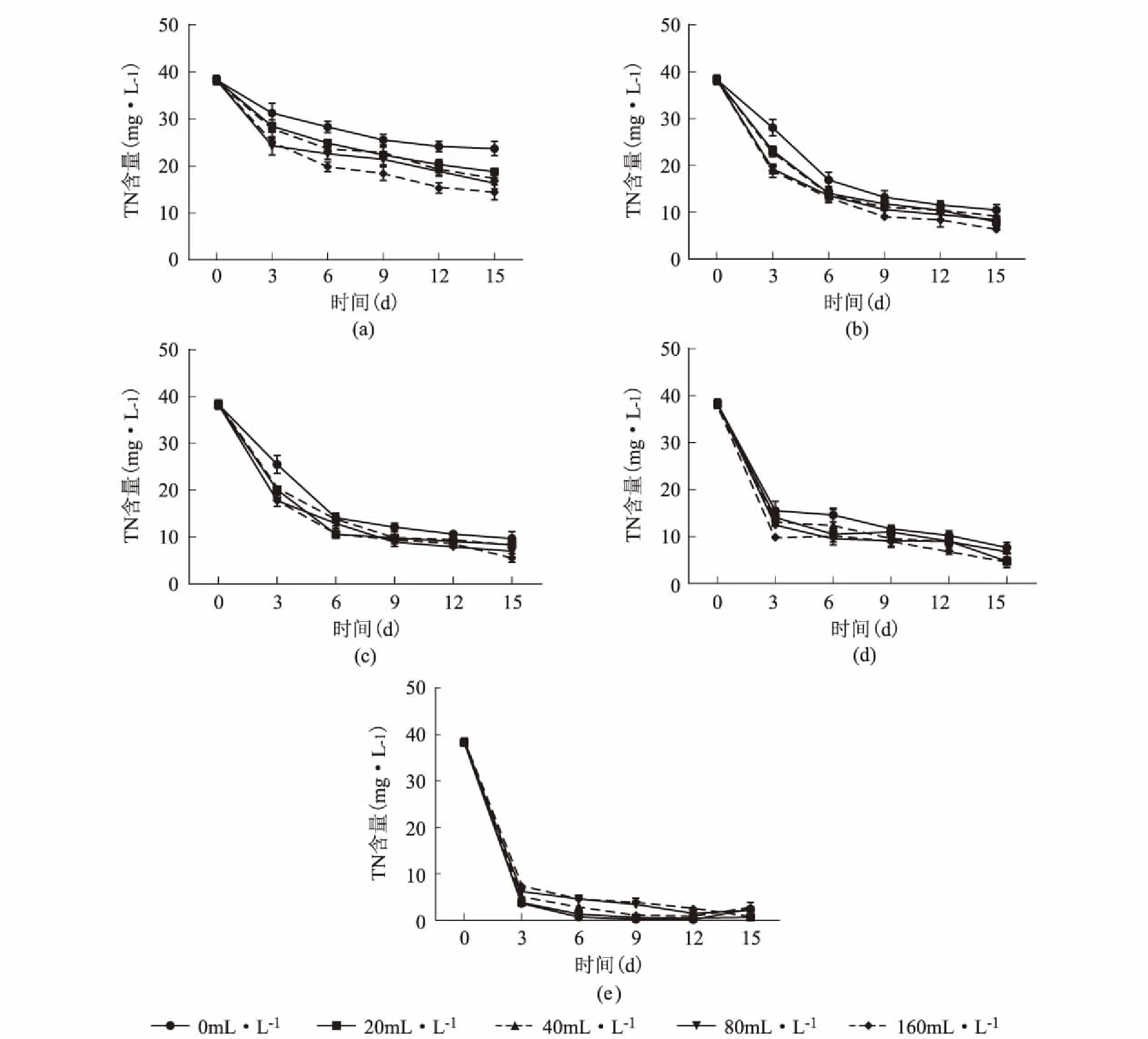
图3 培养液中TP含量的变化趋势(不同折线表示不同铜绿微囊藻浓度)Fig.3 The TP content (mg·L-1) in the culture medium少根紫萍接种量:a:0 mg·m-2;b:100 mg·m-2;c:200 mg·m-2;d:400 mg·m-2;e:800 mg·m-2
2.4 培养液中TN、TP去除率的变化
图4为铜绿微囊藻和少根紫萍共培养15 d后培养液中TN、TP去除率。如图4所示,未接种少根紫萍时,仅靠铜绿微囊藻吸收营养物质,TN、TP去除率随着铜绿微囊藻浓度的增加逐渐升高。而接种少根紫萍后,TN去除率呈现先上升后下降的趋势,0~20 mL·L-1上升,20 mL·L-1~160 mL·L-1下降,在20 mL·L-1到达最大值,分别为48.50%、48.94%、58.45%、67.95%。TP去除率呈现先上升后下降再上升的趋势,0~20 mL·L-1上升,20 mL·L-1~80 mL·L-1下降,80 mL·L-1~180 mL·L-1上升。在20 mL·L-1和160 mL·L-1到达高峰,分别为79.23%、81.88%、87.56%、98.31%和83.33%、85.53%、88.01%、93.21%。随着少根紫萍浓度的加大,TN、TP去除率也逐渐增加,在浓度为800 mg·m-2时,TN、TP的去除率达到最大。
2.5 培养液及少根紫萍中微囊藻毒素含量的变化
图5为铜绿微囊藻与少根紫萍共培养15 d后培养液及少根紫萍体内微囊藻毒素(MCs)含量的变化图。从图5a可以看出,未接种少根紫萍时,培养液中的MCs含量随铜绿微囊藻浓度的增加而增加;接种少根紫萍后,在铜绿微囊藻为20 mL·L-1时,培养液中的MCs含量均为最低。随着少根紫萍浓度的增加,培养液中的MCs先下降后上升,在少根紫萍浓度为400 mg·m-2时,其含量最低。当铜绿微囊藻浓度为20 mL·L-1、少根紫萍浓度为400 mg·m-2时,培养液中的MCs含量最低为8.41 μg·mL-1。图5b为少根紫萍体内的MCs含量,随着铜绿微囊藻和少根紫萍浓度的增加,少根紫萍体内的MCs含量先上升后下降;在少根紫萍浓度为400 mg·m-2时,所以铜绿微囊藻接种浓度中根紫萍体内的MCs含量均为最高。当铜绿微囊藻浓度为20 mL·L-1、少根紫萍浓度为400mg·m-2时,少根紫萍体内的MCs含量最高为286.87 μg·g-1,说明少根紫萍吸收了培养液中的MCs,净化了水体。
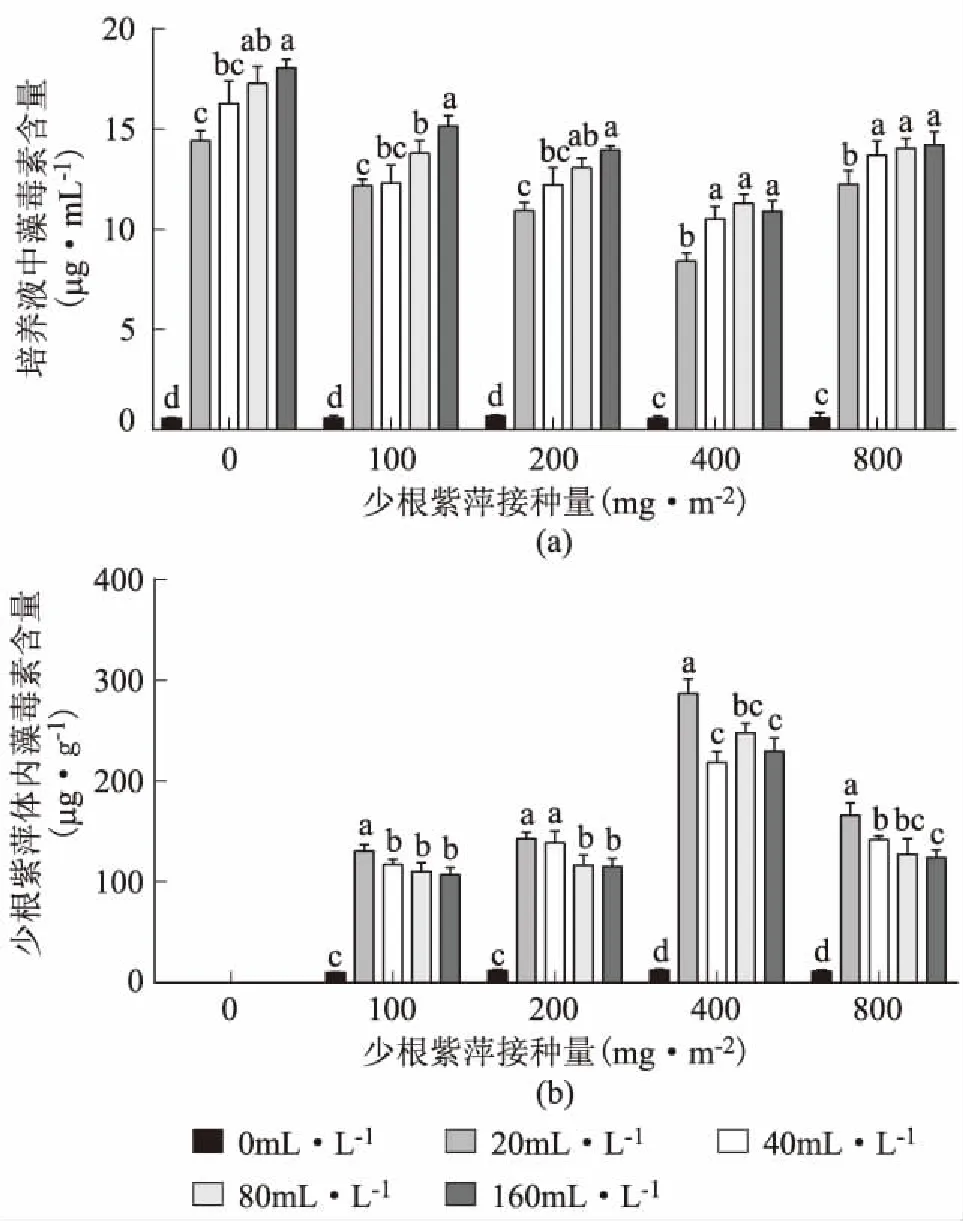
图5 培养液及少根紫萍体内微藻毒素含量Fig.5 The content of microcystins in the culture medium and Spirodela punctata不同颜色柱为不同铜绿微囊藻浓度;不同字母表示同组数据间存在显著差异性,p<0.05
2.6 不同浓度少根紫萍及铜绿微囊藻双因素方差分析表
表1为不同浓度少根紫萍及铜绿微囊藻对各指标双因素方差分析结果。从表中可以看出,少根紫萍和铜绿微囊藻浓度单独作用时,少根紫萍鲜重、干重、鲜重增长率、总叶绿素、少根紫萍体内MCs含量、培养中TN、TP的去除率以及MCs含量p值均小于0.05,表明各单因素对少根紫萍鲜重、干重、鲜重增长率和总叶绿素含量均有显著影响,对TN、TP的去除率及MCs含量也存在显著影响。但当二者交互作用后,少根紫萍鲜重p=0.316、干重p=0.119均大于0.05,表明二者交互作用对少根紫萍鲜重、干重则不存在显著影响。但少根紫萍鲜重增长率、总叶绿素、少根紫萍体内MCs含量、培养中TN、TP的去除率以及MCs含量p值均小于0.05,表明二者交互作用后对污染水体修复具有显著作用,说明少根紫萍与铜绿微囊藻共培养后对污染水体的修复比单独培养具有更好的效果。
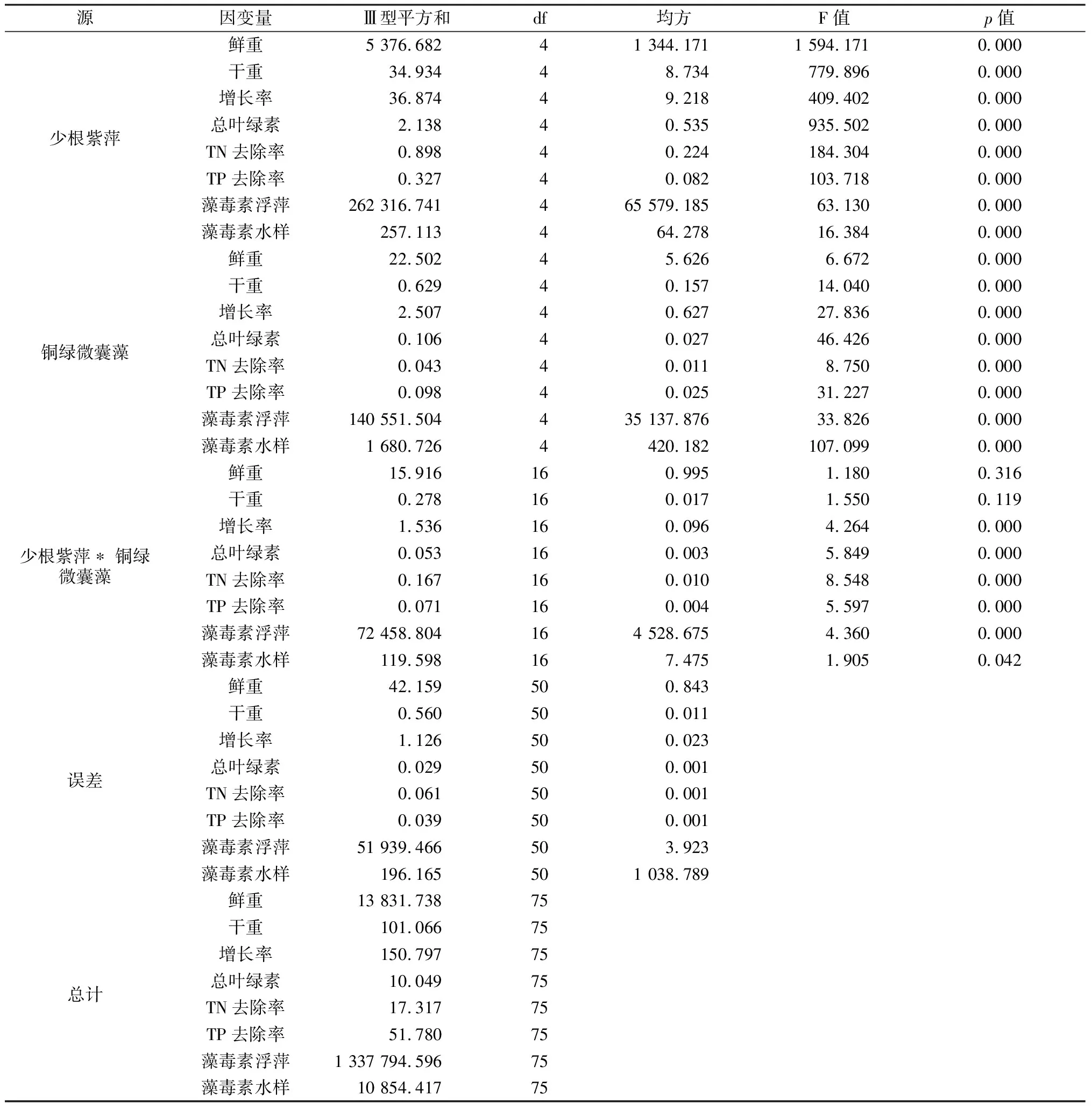
表1双因素重复实验方差分析表
p值表示数据间显著差异性,p<0.05
3 讨论
3.1 铜绿微囊藻对少根紫萍生长的影响
铜绿微囊藻和少根紫萍共培养15 d后,接种了20 mL·L-1铜绿微囊藻浓度的处理下,少根紫萍的鲜重、干重、增长率及叶绿素含量均增加,说明低浓度的铜绿微囊藻促进了少根紫萍的生长;而接种了160 mL·L-1铜绿微囊藻浓度的处理下,少根紫萍的鲜重、干重、增长率及叶绿素含量均呈现下降的趋势,说明高浓度的铜绿微囊藻抑制了少根紫萍的生长。铜绿微囊藻和少根紫萍均为水生生物,可利用阳光、营养物质进行生长,因此两者之间存在一定的竞争。当水体中铜绿微囊藻数量较少时,产生的藻毒素也较少,对少根紫萍造成的胁迫程度较低,对其造成的危害不大,反而可增加其竞争性,在一定程度上促进少根紫萍对营养物质的吸收;且铜绿微囊藻呼吸作用产生的CO2还可提高少根紫萍的光合作用效率,从而促进了少根紫萍的生长。反之,当接种的铜绿微囊藻数量较大,使其成为优势物种,不但利用水中的营养物质进行大量繁殖,减少少根紫萍的营养物质吸收量,而且当其生物量达到一定程度后造成水华现象,降低水中溶氧量,改变水体环境;同时铜绿微囊藻还会产生藻毒素,对少根紫萍造成胁迫,影响其叶绿素含量的合成、降低光合作用效率等[18],从而影响少根紫萍的生长。随着少根紫萍浓度的增大,其鲜重、增长率及叶绿素含量先增加后降低,可能是因为浓度较低时少根紫萍群落未达到饱和,鲜重、增长率及叶绿素含量随浓度的增加而增加;而当少根紫萍群落达到饱和后,浓度过大导致其覆盖密度过大、间距过小,造成拥挤和老化现象,由此降低了其增长率。同时拥挤的环境还会造成部分少根紫萍光照不足,降低光合作用,从而影响少根紫萍的生长。
3.2 少根紫萍对污染水体TN、TP的影响
TN、TP含量是富营养化水体的主要指标之一。TN、TP等营养物质过多会造成水生生物特别是藻类生物的大量繁殖,从而促使“水华”、“赤潮”等现象频发。许多研究均表明浮萍对污染水体中TN、TP具有较好的吸收效果。于斌研究表明稀脉浮萍对自然水体中TN、TP的去除率可达78.58%和90.26%[19]。王春英等也研究表明小浮萍对P的去除率介于90%~95%[20]。本实验中铜绿微囊藻和少根紫萍共培养降低了水体中TN、TP含量。其中少根紫萍浓度为800·m-2时,TN、TP去除率最大,但此时少根紫萍生长状况较差,达不到物质的最大利用效率;少根紫萍浓度为400 mg·m-2时,TN、TP去除率也较高,少根紫萍生长状况也较好。在铜绿微囊藻为20 mL·L-1时营养物质去除效果最好,此时铜绿微囊藻与少根紫萍形成一个稳定的生长状态,铜绿微囊藻与少根紫萍在整个群落中均为优势物种,可吸收水中营养物质来促进自身的生长,达到水体修复和物质充分利用的双赢局面。因此可根据铜绿微囊藻的数量设计与少根紫萍共培养的最适浓度,达到最佳污水处理和物质的最大利用率。
3.3 少根紫萍对污染水体微囊藻毒素的影响
铜绿微囊藻细胞死亡破裂后会释放藻毒素,污染水体。许多研究表明水生生物可积累藻毒素,尹黎燕等发现微囊藻可在水生植物苦草中积累[21]。宋海亮也发现水生植物床可有效地去除富营养化水中的藻毒素[22]。本实验空白对照组培养液中的MCs含量随着铜绿微囊藻浓度的增加而增加;当铜绿微囊藻与少根紫萍共培养后,培养液中的MCs含量均少于铜绿微囊藻单独培养,证明少根紫萍降低了培养液中的MCs含量。而随着少根紫萍浓度的增加,培养液中MCs含量先减少后增加,少根紫萍体内微囊藻毒素先增加后减少,这与少根紫萍的生长状况一致,表明少根紫萍生长状况对微囊藻毒素存在一定的影响。少根紫萍与铜绿微囊藻共培养后水体中MCs降低,少根紫萍体内微囊藻毒素上升,表明少根紫萍可吸收水体中的微囊藻毒素,达到修复水体的目的。同时少根紫萍和铜绿微囊藻对水体中的营养物质、光照等还存在竞争关系,可抑制其繁殖速度,减少铜绿微囊藻细胞数量;同时少根紫萍漂浮在水面生长,到其数量较多时,在一定程度上会遮住水面,导致铜绿微囊藻无法获得阳光,降低其光合作用,从而减少水中藻类数量,最终减少铜绿微囊藻细胞死亡裂解后释放的MCs。
4 结论
铜绿微囊藻和少根紫萍共培养比各自单独培养对污染水体具有更好的修复效果。低浓度铜绿微囊藻可促进少根紫萍生长,高浓度铜绿微囊藻抑制少根紫萍生长。当水体中铜绿微囊藻生物量为2.0×108个·mL-1左右,少根紫萍为400mg·m-2时,少根紫萍的生长状况最好,且对污染水体的修复效果较好。因此可以选择低浓度铜绿微囊藻和400mg·m-2的少根紫萍共培养用于湿地污染水体修复。

