响应面法优化菌株发酵冷冻调理羊肉工艺
母应春,郑璞,李秋桐,苏伟,母雨
(贵州大学酿酒与食品工程学院,贵州 贵阳 550025)
冷冻调制食品是以水产品、农产品或畜产品为主要原料,经调制加工,并急速冷冻保持冻结状态的冷冻食品[1]。冷冻调理食品在种类上不胜枚举,主要归为五大类:中式点心、火锅用料、裹面油炸品、菜肴料理、糕饼点心[2]。畜类冷冻调理肉制品即对原料肉进行前处理,如标准化的注射、滚揉、腌制等工艺,消费者只要购回进行解冻,通过蒸煮、煎炒、烧烤或微波加热等简单的烹饪手段即可食用[3]。常见的研究包括调理鸡肉[4-5]、调理牛肉[6-7]、调理猪肉[8-9]等工艺,但用菌种发酵冷冻调理肉制品却鲜有报道。
本试验将采用筛出的米根霉TZH3 与米曲霉TZH4 对羊肉进行发酵,制成冷冻调理羊肉制品。通过试验已经证实,米根霉TZH3 与米曲霉TZH4 不仅能够产生脂肪酶,能对羊肉脂肪进行水解,还能够降解4-甲基辛酸和4-乙基辛酸等膻味脂肪酸,能对羊肉的风味进行改善。通过对原料预处理、修整、注射菌液、加料、滚揉、腌制等工艺流程,选择菌种接种量、保水剂添加量、发酵温度和发酵时间为自变量,以冷冻调理羊肉熟制后的产品感官评定和pH 值为响应值,以获得菌种发酵冷冻调理羊肉的最优配方。
1 材料与方法
1.1 材料与试剂
白山羊原料肉:沿河鑫龙农牧开发有限责任公司。
大豆蛋白:谷神生物科技集团有限公司;食盐:云南省盐业有限公司;味精:广州奥桑味精有限公司;白糖:太古糖业有限公司;冰水。
PDA 培养基:马铃薯浸粉 5.0 g、葡萄糖 20.0 g、琼脂 15.0 g、氯霉素 0.1 g、蒸馏水 1 000 mL,pH7.0,121 ℃灭菌20 min。
1.2 仪器与设备
立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;电热恒温培养箱(DPH-420 型):天津天泰仪器有限公司;电子天平(FA2004N):上海青海仪器有限公司;肉类pH 计(HI98163):意大利哈纳仪器公司;便携式色差仪(NR200):深圳市三恩时科技有限公司。
1.3 方法
1.3.1 调理羊肉的配方
选用优质白山羊后腿肉,去皮去筋膜及其附属物后,向腿肉中注射菌剂,随后将大豆蛋白、2%的食盐、0.5%的味精和0.5%的蔗糖溶解在10%的冰水中,充分涂抹在羊腿肉表面。
1.3.2 调理羊肉的制作工艺及操作要点
原料预处理→修整→注射菌液→加料→滚揉→腌制→微冻→切片→包装→成品
1.3.2.1 原料预处理
取排酸后的白山羊后腿肉,去掉皮,去掉筋膜及其附属物。
1.3.2.2 修整
将羊腿肉块修切整齐,便于后期切片大小均匀。
1.3.2.3 注射菌剂
注射菌剂时,应用注射器在不同方面扎多个孔,使菌剂分布均匀,发酵完全。
1.3.2.4 加料
将大豆蛋白、食盐、味精和蔗糖溶解在冰水中,搅拌均匀后对羊腿肉进行涂抹,使辅料充分附着在肉表面。
1.3.2.5 滚揉
滚揉时应注意力度,使羊腿肉得到充分按摩。
1.3.2.6 腌制
腌制时用保鲜膜将羊腿肉包好,放于30 ℃下静置腌制一段时间。
1.3.2.7 微冻
将腌制好的羊腿肉取出,置于-4℃下进行微冻3h。
1.3.2.8 切片
将冻好的羊腿肉取出,切成0.5 mm 左右厚度的肉片,使肉片大小厚度形状均匀。
1.3.2.9 包装
将处理好的肉片装入聚乙烯蒸煮袋中,摆放好后抽真空包装即为成品,于-18 ℃下冷冻保藏。
1.3.3 发酵菌剂的制备
参照李静雯等[10]的方法,将保存于斜面中的米根霉TZH3 与米曲霉TZH4 活化2 代,接种到新的PDA斜面培养基中,30 ℃下培养72 h。培养完毕后,向斜面培养基中加入5 mL 无菌水并轻轻刮下孢子,重复4次,将清洗所得孢子液合并于盛有无菌玻璃珠的三角瓶中,反复振荡后用灭菌脱脂棉进行过滤,得到的孢子液即为发酵用菌剂,调整孢子液浓度为108cfu/mL,米根霉TZH3 与米曲霉TZH4 按照体积比1 ∶1 进行复配,备用。
1.3.4 单因素试验
以感官评分、pH 值、色差和蒸煮损失率为评价指标,探究菌种接种量、大豆蛋白添加量、发酵时间、发酵温度对调理羊肉的影响,以不添加菌种和大豆蛋白的羊肉为空白对照组。单因素试验设计中各因素的水平如表1所示。
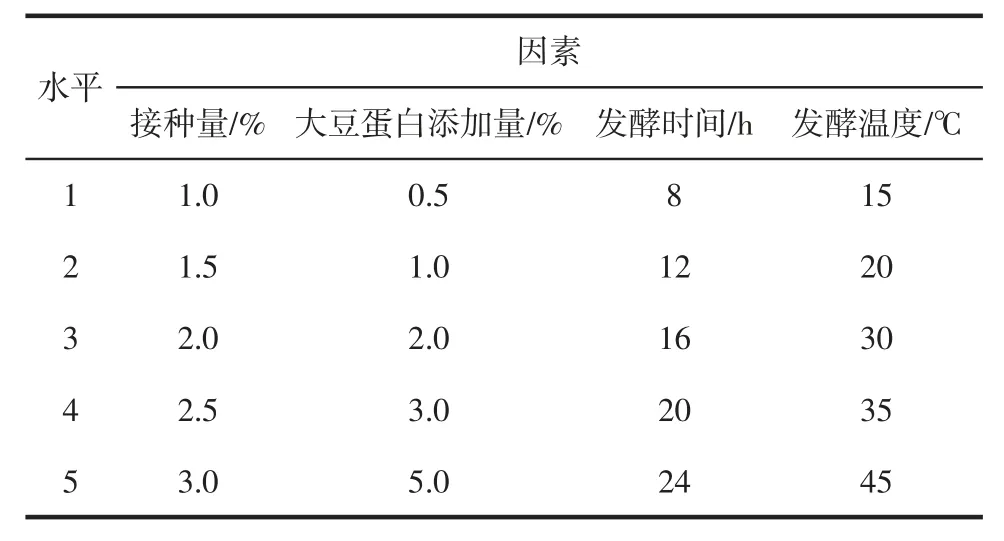
表1 单因素试验中各因素水平表Table1 Levels of independent variables used for single method
1.3.5 响应面试验
结合单因素试验结果,以pH 值为响应值,选取对产品影响较大的因素进行响应面试验设计中心组合试验,确定制作冷冻调理羊肉的最佳工艺条件。
1.3.6 感官评定
选择10 名具有食品专业背景的人员作为感官评定小组,对羊肉的色泽、香气、滋味、口感和组织状态进行评分,感官评价标准和评分[11]如表2所示。

表2 感官评分标准Table 2 Criteria for sensory evaluation of sausage
1.3.7 pH 值、色差和蒸煮损失率的测定
使用肉类pH 计对调理羊肉的pH 值进行测定,利用便携式色差仪对调理羊肉的亮度值(L*)、红度值(a*)和黄度值(b*)进行测定,蒸煮损失率的计算为:蒸煮损失/%=(蒸煮前样品质量-蒸煮后样品质量)/蒸煮前样品质量×100[12],每个样品平行测定3 次。
1.3.8 数据处理
每个试验做3 个平行,测定结果以平均数±标准偏差表示,并利用SPSS 20.0 和Design-Expert V 8.0.6软件对试验数据进行处理分析。
2 结果与分析
2.1 单因素试验结果
2.1.1
菌种接种量对调理羊肉感官评分及pH 值的影响见图1。
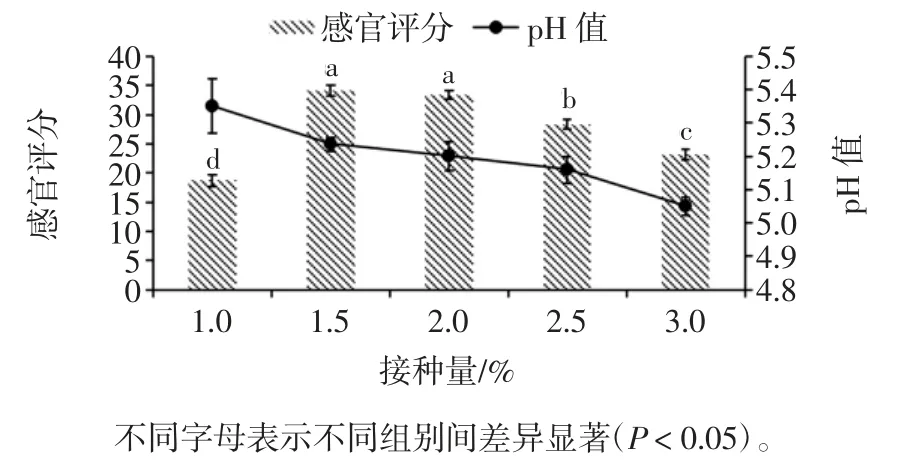
图1 接种量对调理羊肉感官评分和pH 值的影响Fig.1 Effect of inoculum size on sensory score and pH value of conditioned lamb
由图1可知,当菌种接种量为1.5%时,调理羊肉的的感官评分最高为(34.1±0.88)分,此时调理羊肉的pH 值为5.24±0.02;当菌种接种量为1.0%时,调理羊肉的感官评分最低为(18.7±0.95)分,此时调理羊肉的pH 值为5.35±0.08。菌种接种量为1.5%和2.0%的调理羊肉,其感官评分显著高于接种量为1.0%、2.5%和3.0%的调理羊肉(P <0.05)。说明调理羊肉的pH 值随着菌种的接种量增加而降低。米根霉(Rhizopus oryzae)是目前发酵生产L-乳酸的重要菌株[13],L-乳酸常用作酸味剂、防腐剂。乳酸盐能改善肉制品的嫩度、风味、颜色等,但是高浓度的乳酸盐会影响肉制品中蛋白质的表达和稳定性[14]。米曲霉(Aspergillus oryzae)能将糖类物质转化为曲酸,曲酸具有较强的抗氧化活性,能够对肉制品起到一定的护色作用,同时曲酸还具有一定的金属离子螯合能力,特别是能够与肌红蛋白中的三价铁离子螯合生成血红色,据此可取代亚硝酸盐作为发色剂应用于肉类食品的加工领域[15]。因此,当菌种接种量过多时,产酸过多导致pH 值过低,对调理羊肉的色泽、香气和滋味等造成一定的影响,因此感官评分降低;当菌种接种量过少时,调理羊肉发酵不充分导致固有膻味较重,香味较淡,因此感官品质较差。
菌种接种量对调理羊肉的色差影响见表3。
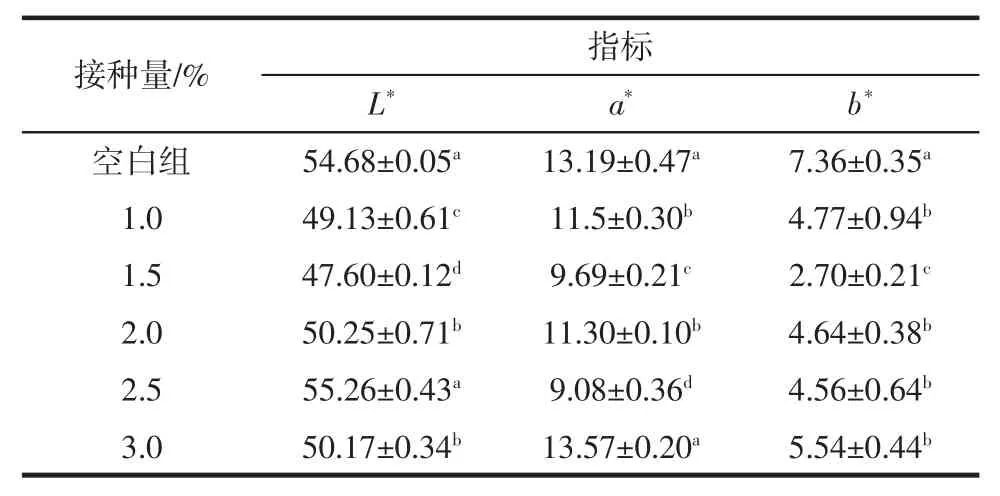
表3 接种量对调理羊肉色差的影响Table 3 Effect of inoculum size on color difference of conditioned lamb
由表3可知,空白组和接种量为2.5%调理羊肉的L*值显著高于其他处理组(P <0.05);空白组和接种量为3.0%的a*值显著高于其他处理组(P <0.05);空白组的b*值显著高于其他处理组(P <0.05)。
菌种接种量对调理羊肉蒸煮损失率的影响见图2。
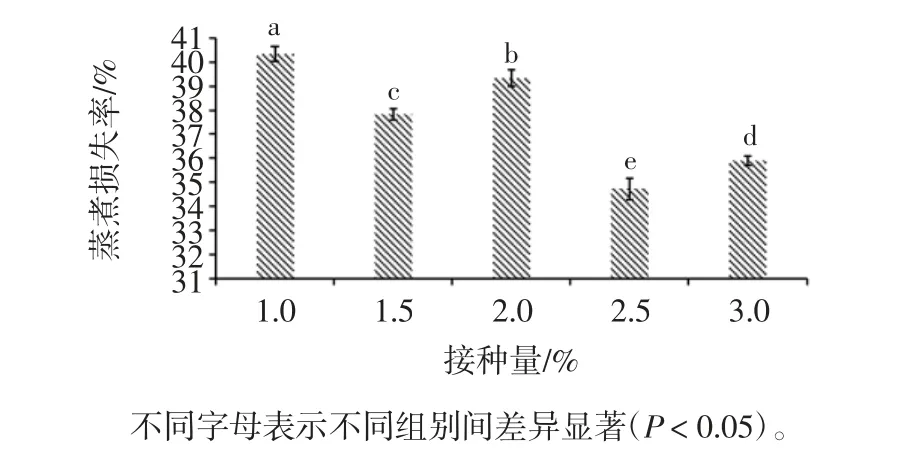
图2 接种量对调理羊肉蒸煮损失率的影响Fig.2 Effect of inoculum size on cooking loss rate of conditioned lamb
由图2可以看出,菌种接种量为1.0%的调理羊肉蒸煮损失率最高为(40.33±0.31)%,菌种接种量为2.5%的调理羊肉蒸煮损失率最低为(34.72±0.43)%,且各处理组间的差异显著(P <0.05)。随着菌种接种量的增加,调理羊肉的蒸煮损失率明显降低。霉菌能产生蛋白酶,由于酶的作用,使肉中的肌细胞由紧张变为松弛状态,使得肉的持水力增加,蒸煮损失率显著降低[16]。
2.1.2 大豆蛋白添加量对调理羊肉的影响
大豆蛋白添加量对调理羊肉感官评分及pH 值的影响见图3。
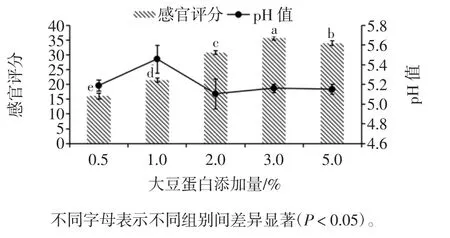
图3 大豆蛋白添加量对调理羊肉感官评分和pH值的影响Fig.3 Effect of soy protein addition on sensory score and pH of conditioned lamb
由图3可知,当大豆蛋白添加量为3.0%时,调理羊肉的的感官评分最高为(35.7±0.67)分,此时调理羊肉的pH 值为5.16±0.04;当大豆蛋白添加量为0.5%时,调理羊肉的感官评分最低为(16.1±0.99)分,此时调理羊肉的pH 值为5.19±0.06。大豆蛋白接种量为3.0%的调理羊肉,其感官评分显著高于大豆蛋白添加量为 0.5 %、1.0 %、2.0 %和 5.0 %的调理羊肉(P <0.05)。肉制品在加热熟制过程中,肉蛋白会形成一个凝胶基质,将其他成分裹在中间。加热时肉类蛋白形成的网络基质将植物蛋白、多糖等添加物包埋在其中,从而增加了凝胶的硬度,咀嚼性也随之提高[17]。经冷冻过后的调理羊肉蒸煮损失率增加,随着水分的损失羊肉的色泽、口感等会有所变化,而大豆蛋白等保水剂的添加能对调理羊肉的品质起到保护和修饰的作用。因此随着大豆蛋白添加量的增多,调理羊肉的感官评分上升。但当大豆蛋白添加过多时,羊肉固有的香味被掩盖,并含有较多残渣,对调理羊肉的香气和口感等造成影响,因此感官品质有所下降。
大豆蛋白添加量对调理羊肉的色差影响见表4。
由表4可知,空白组调理羊肉的L*值与其他处理组的差异显著(P < 0.05),a*值同理;空白组与大豆蛋白添加量为0.5%的b*值无显著差异,而与其他处理组的差异显著(P <0.05),说明大豆蛋白的添加对调理羊肉的色泽具有明显的影响。
大豆蛋白添加量对调理羊肉蒸煮损失率的影响见图4。
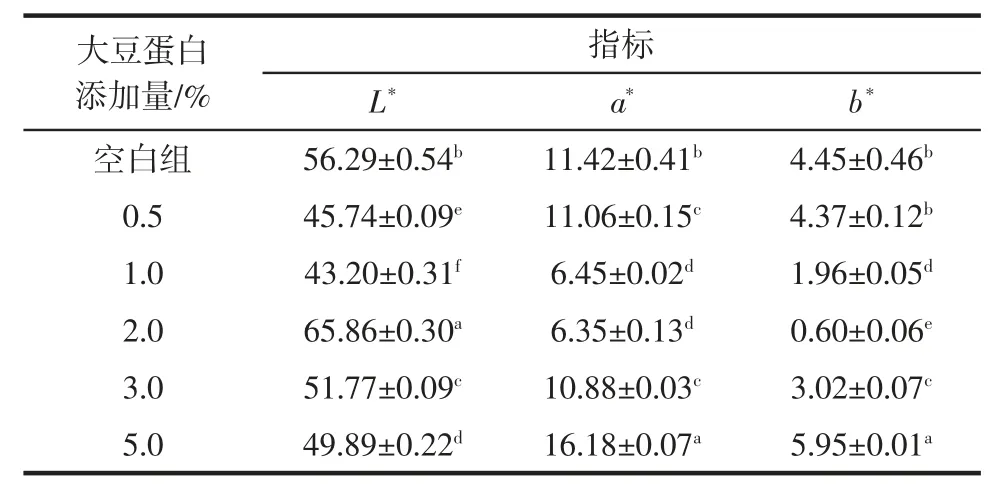
表4 大豆蛋白添加量对调理羊肉色差的影响Table 4 Effect of soy protein addition on color difference of conditioned lamb
由图4可知,随着大豆蛋白添加量的增加,调理羊肉的蒸煮损失率降低,当大豆蛋白添加量为5%时,调理羊肉蒸煮损失率显著低于其他处理组(P <0.05),为(30.66±0.48)%。吴立根等[18]向鸡胸肉中添加全溶大豆蛋白(60%)的效果明显,当添加量为7%时,鸡胸肉的蒸煮出品率达到最佳为102.01%,证实了大豆蛋白在提高肉的保水性有着积极的意义。但由于过量蛋白粉影响了对调理羊肉的评价,综上所述选择3.0%的大豆蛋白添加量较适宜。
2.1.3 发酵时间对调理羊肉的影响
发酵时间对调理羊肉感官评分及pH 值的影响见图5。
由图5可知,调理羊肉的pH 值随着发酵时间的延长而呈现出下降的趋势,当发酵时间为12 h 时,调理羊肉的感官评分最高为(31.7±0.95)分,此时调理羊肉的pH 值为5.55±0.02;当发酵时间为20 h 时,调理羊肉感官评分最低为(18.9±0.99)分,此时的调理羊肉的 pH 值为 5.01 ± 0.02。调理羊肉发酵 20 h~24 h 时,调理羊肉的pH 值过低,酸味较重,对羊肉原有的鲜美滋味造成影响,咀嚼性有所提高,色泽较差。张宁等[19]在研制乳酸菌发酵牦牛骨泥香肠工艺的过程中,发现随着香肠发酵时间延长,香肠pH 值值会逐渐降低,因为随着发酵时间的增加,菌的活性逐渐增强,产酸能力也随之增强,所以pH 值下降较快。但到达一定时间后,pH 值下降越来越不明显,这是因为过低的pH 值已经不是合适该乳酸菌生长,因此pH 值不再持续下降。发酵时间过长时,乳酸菌产酸较多,会使香肠整体口味偏酸,进而影响人们的食欲。与本试验结果一致。
发酵时间对调理羊肉的色差影响见表5。
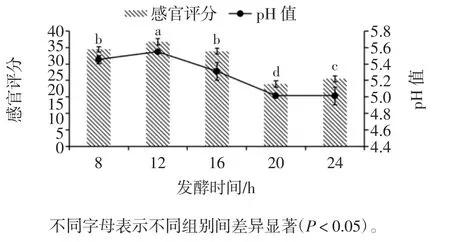
图5 发酵时间对调理羊肉感官评分和pH 值的影响Fig.5 Effect of fermentation time on sensory score and pH value of conditioning lamb
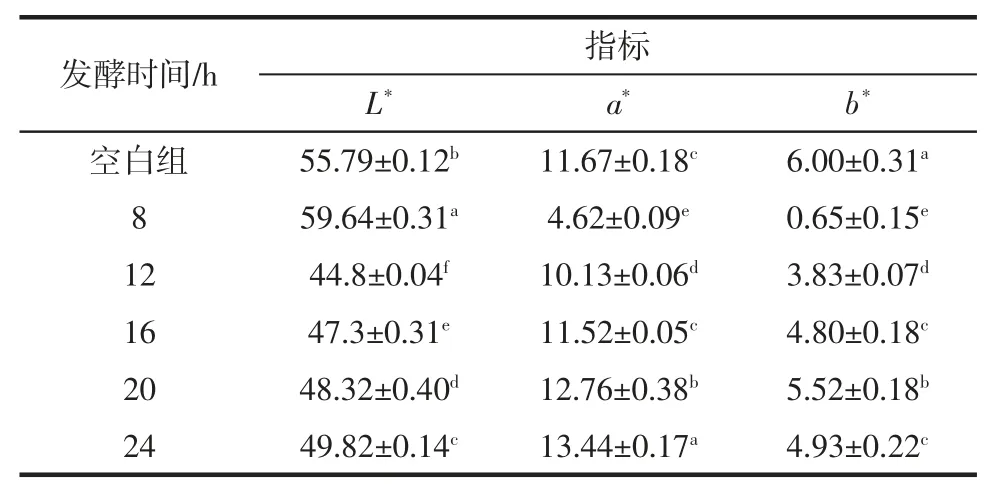
表5 发酵时间对调理羊肉色差的影响Table 5 Effect of fermentation time on color difference of conditioned lamb
由表5可知,空白组调理羊肉的L*值与其他处理组的差异显著(P < 0.05),b*值同理;空白组和发酵时间为 16 h 的 a*值差异不显著(P < 0.05)。
发酵时间对调理羊肉蒸煮损失率的影响见图6。
由图6可知,随着发酵时间的延长,调理羊肉的蒸煮损失率减少,说明菌种在发酵时对羊肉的质构特性造成影响,对羊肉的保水性具有一定的积极作用。当发酵时间为16 h,调理羊肉的蒸煮损失率达到最低为(35.27±0.20)%。发酵时间越短,调理羊肉的pH 值降低得越慢,菌株产生的蛋白酶在低酸性条件下达到等电点,导致蛋白质溶解度降低,酶活性下降[20],肉的持水力降低,因此蒸煮损失率较高,说明菌株产生的蛋白酶可能在酸性条件下活性较强。综上所述,选择16 h发酵时间较为适宜。
2.1.4 发酵温度对调理羊肉的影响
发酵温度对调理羊肉感官评分及pH 值的影响见图7。
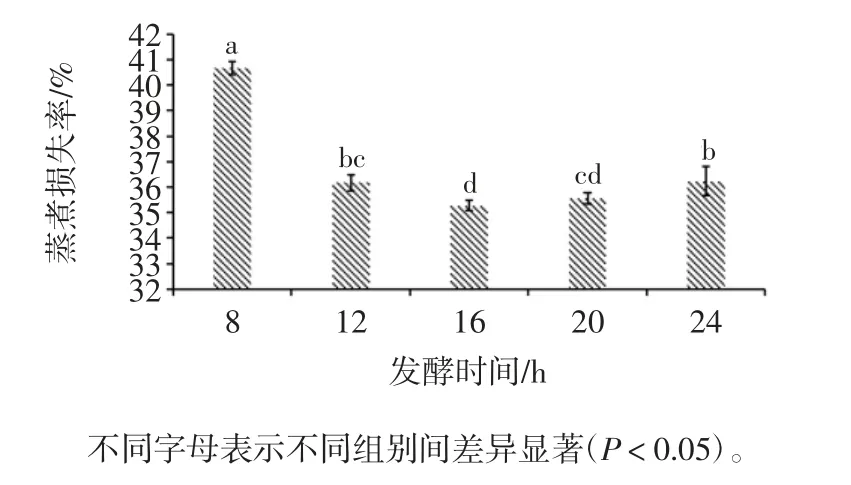
图6 发酵时间对调理羊肉蒸煮损失率的影响Fig.6 Effect of fermentation time on cooking loss rate of conditioned lamb
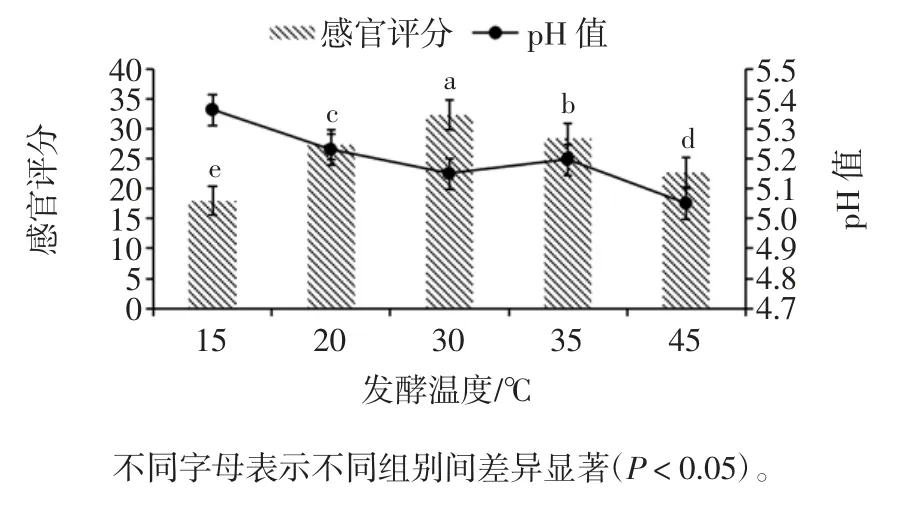
图7 发酵温度对调理羊肉感官评分和pH 值的影响Fig.7 Effect of fermentation temperature on sensory score and pH value of conditioning lamb
由图7可知,当发酵温度为30 ℃时,调理羊肉的感官评分最高为(32.4±0.52)分,且显著高于其他处理组(P < 0.05),此时调理羊肉的 pH 值为 5.15 ± 0.04;当发酵温度为15 ℃时,调理羊肉的感官评分最低为(18.0±0.94)分,此时调理羊肉的pH 值为5.36±0.06。黄丹等[21]对四川传统发酵肉中乳酸菌进行分离鉴定,并对其发酵特性进行研究,发现温度对于菌株生长及产酸影响较大。当环境温度为20 ℃~30 ℃,分离菌株的OD 值与总酸逐渐升高,当温度高于最适温度30 ℃时,其OD 值开始下降;当温度继续升高,菌株的生长及产酸能力受到极大的抑制。调理羊肉的pH 值在15 ℃~30 ℃逐渐下降,而在35 ℃时呈上升趋势,说明过高或过低的温度不利于菌种的生长,产酸不足导致pH 值较高,影响了调理羊肉的色泽、香味和滋味等,因此感官评分降低。当发酵温度为45 ℃时,接种的菌种生长受到抑制,但由于环境中的其他优势菌种开始生长繁殖,因此pH 值持续下降,但调理羊肉失去原有香味并稍有异味,感官评分降低。
发酵温度对调理羊肉的色差影响见表6。
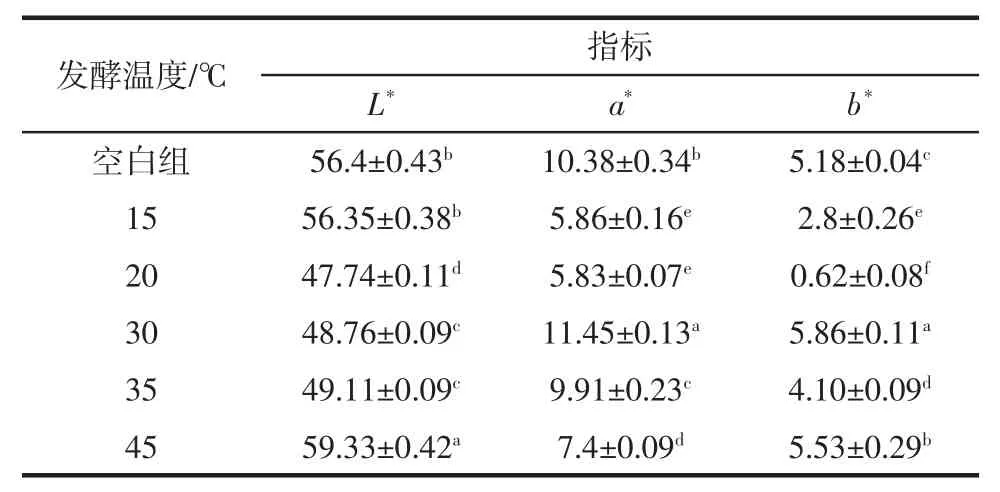
表6 发酵温度对调理羊肉色差的影响Table 6 Effect of fermentation temperature on color difference of conditioned lamb
由表6可知,空白组与发酵温度为15 ℃调理羊肉的L*值差异不显著(P <0.05);空白组与其他处理组的a*值差异显著(P <0.05),空白组与其他处理组的b*值差异同样显著。
发酵温度对调理羊肉蒸煮损失率的影响见图8。
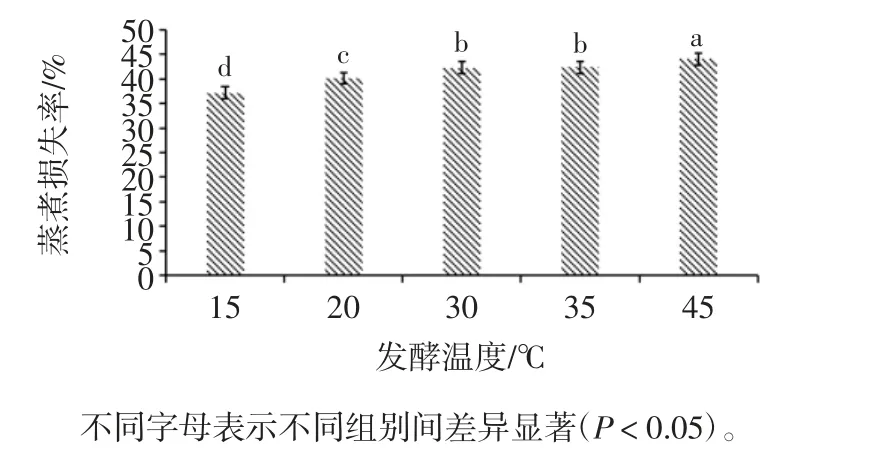
图8 发酵温度对调理羊肉蒸煮损失率的影响Fig.8 Effect of fermentation temperature on cooking loss rate of conditioned lamb
由图8可知,当发酵温度为45 ℃时,调理羊肉的蒸煮损失率最高为(44.06±0.60)%,且显著高于其他处理组(P < 0.05);当发酵温度为 15 ℃时,调理羊肉的蒸煮损失率最低为(37.20±0.31)%。说明随着发酵温度的升高,菌株产酶活性较差,同时调理羊肉中的水分损失增加,不能保留羊肉原有的品质。因此,选择发酵温度30 ℃较适宜。
综上所述,当 pH 值在 5.15~5.55 之间,调理羊肉的感官评分最高,此时调理羊肉的香气、滋味和口感等较为适宜,该条件下有利于米根霉和米曲霉的的生长繁殖和脂肪酶的产生,能对羊肉的风味起到改善的作用。在不同的菌种接种量、大豆蛋白添加量、发酵时间和发酵温度中,调理羊肉的感官评分和pH 值间差异均显著(P <0.05),因此以这几个因素为自变量,感官评分和pH 值为响应值,进行响应面优化试验。
2.2 响应面优化试验结果
2.2.1 响应面优化试验结果及方差分析
在单因素试验结果的基础上,以菌种接种量(A)、大豆蛋白添加量(B)、发酵时间(C)和发酵温度(D)为自变量,感官评分(Y1)和 pH 值(Y2)为响应值,按照Box-Behnken 中心组合设计原理,进行响应面试验,因素与水平如表7所示。
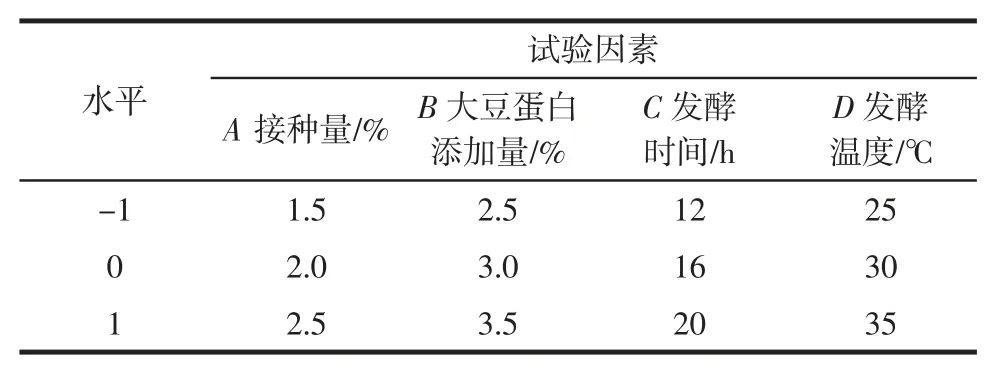
表7 发酵条件优化响应面试验因素与水平Table 7 Fermentation conditions optimization response surface test factors and levels
响应面试验设计及数据结果如表8所示,对试验数据进行方差分析,结果见表9和表10。
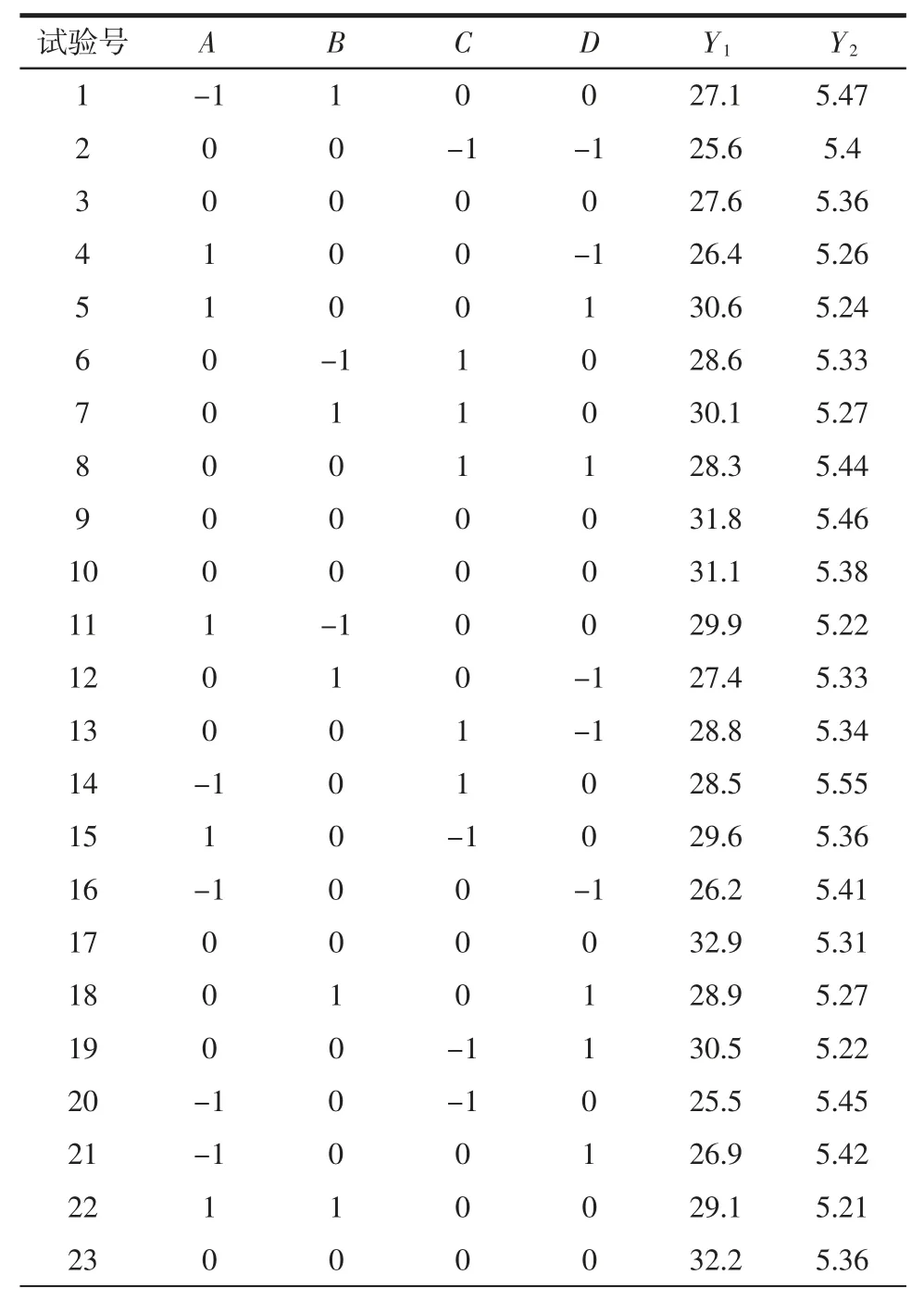
表8 响应面试验设计及结果Table 8 Response surface test design and results
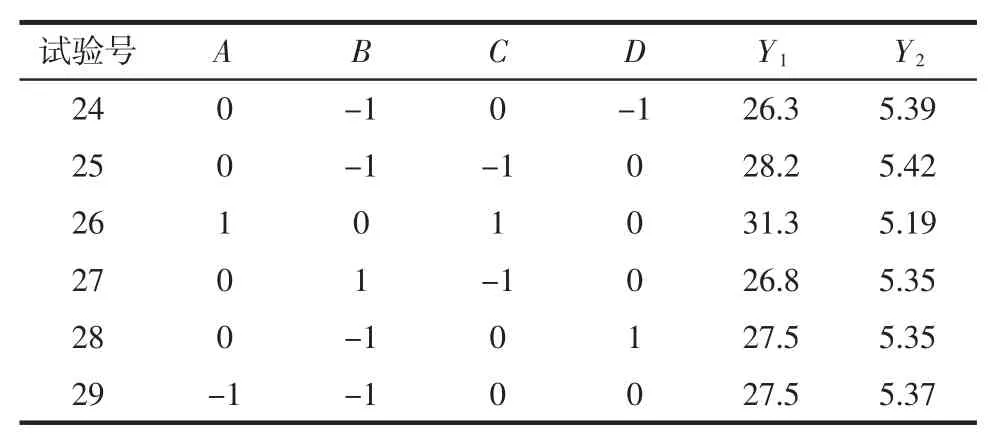
续表8 响应面试验设计及结果Continue table 8 Response surface test design and results
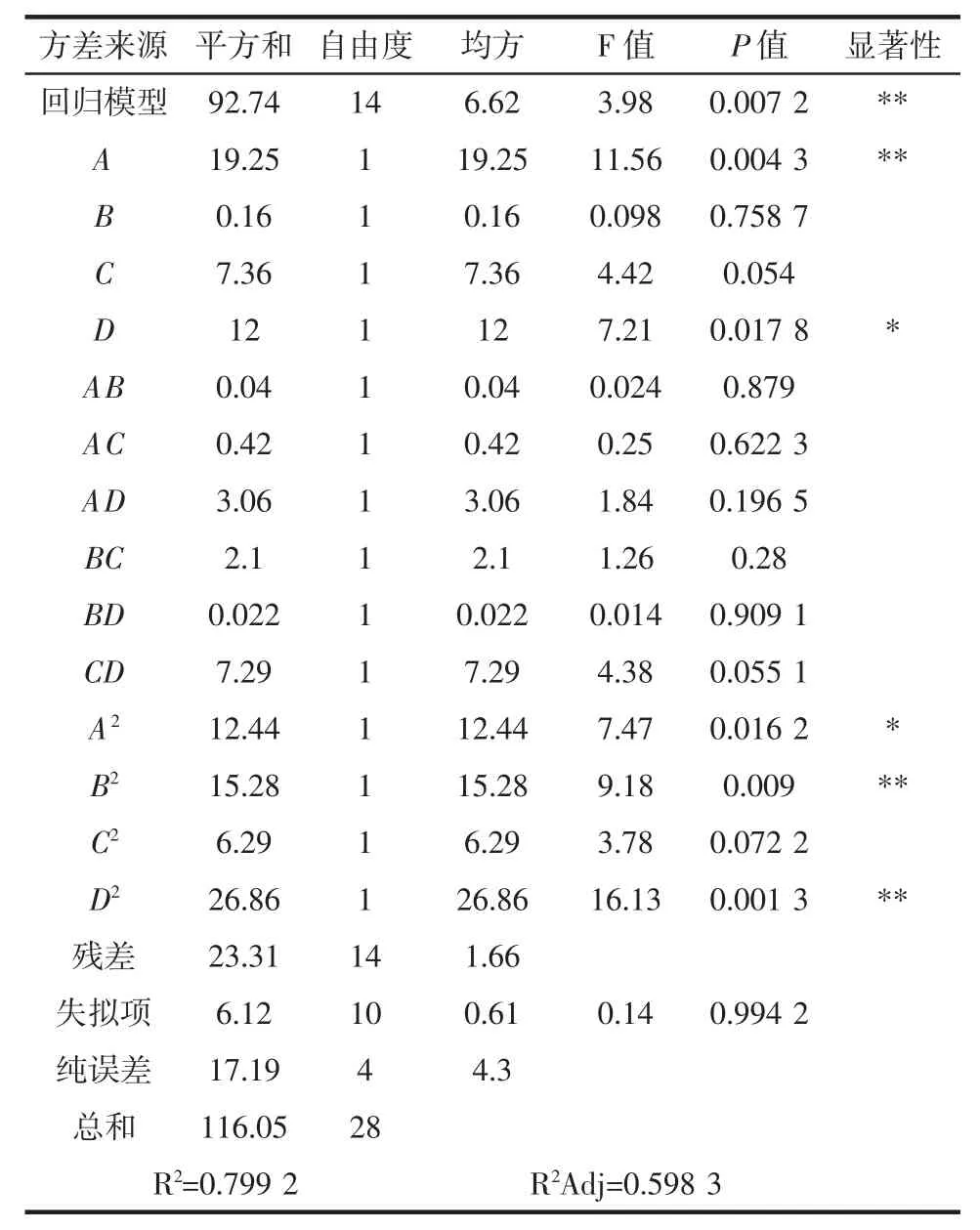
表9 感官评分拟合二次多项式模型方差分析Table 9 Analysis of variance of sensory score fitting quadratic polynomial model
使用Design-Expert V 8.0.6 软件对表8试验数据进行多元回归拟合,得到自变量(A、B、C、D)与感官评分(Y1)之间的二次多项式回归模型方程为:
Y1=-149.120 00+17.993 33A+31.173 33B+3.428 33C+5.374 00D-0.400 00AB -0.162 50AC + 0.350 00AD +0.362 50BC+0.030 000BD-0.067 500CD-5.540 00A2-6.140 00B2-0.061 563C2-0.081 400D2
由表9方差分析可知,感官评分的模型确定系数R2=0.799 2,校正系数R2Adj=0.598 3,模型的P 值为0.007 2,说明模型极显著,失拟项P 值为0.994 2>0.05,影响不显著,表明回归方程与实测值之间拟合较好;一次项A,二次项B2、D2对感官评分的影响极显著(P<0.01),而一次项 D,二次项 A2的差异显著(P<0.05)。由表9中各因素的P 值可知,各因素对调理羊肉感官评分的影响大小依次为接种量(A)>发酵时间(C)>发酵温度(D)>大豆蛋白添加量(B)。
感官评分(Y1)拟合二次多项式模型的方差分析见表9。
自变量(A、B、C、D)与 pH 值(Y2)之间的二次多项式回归模型方程为:
Y2=+3.546 00+0.960 33A+1.038 00B-0.060 583C+0.006 633 33D-0.110 00AB-0.033 750AC-0.003AD+0.00125BC-0.002BD+0.0035CD-0.049667A2-0.13467B2+0.000 552 083C2-0.000 896 667D2
pH 值(Y2)拟合二次多项式模型的方差分析见表10。
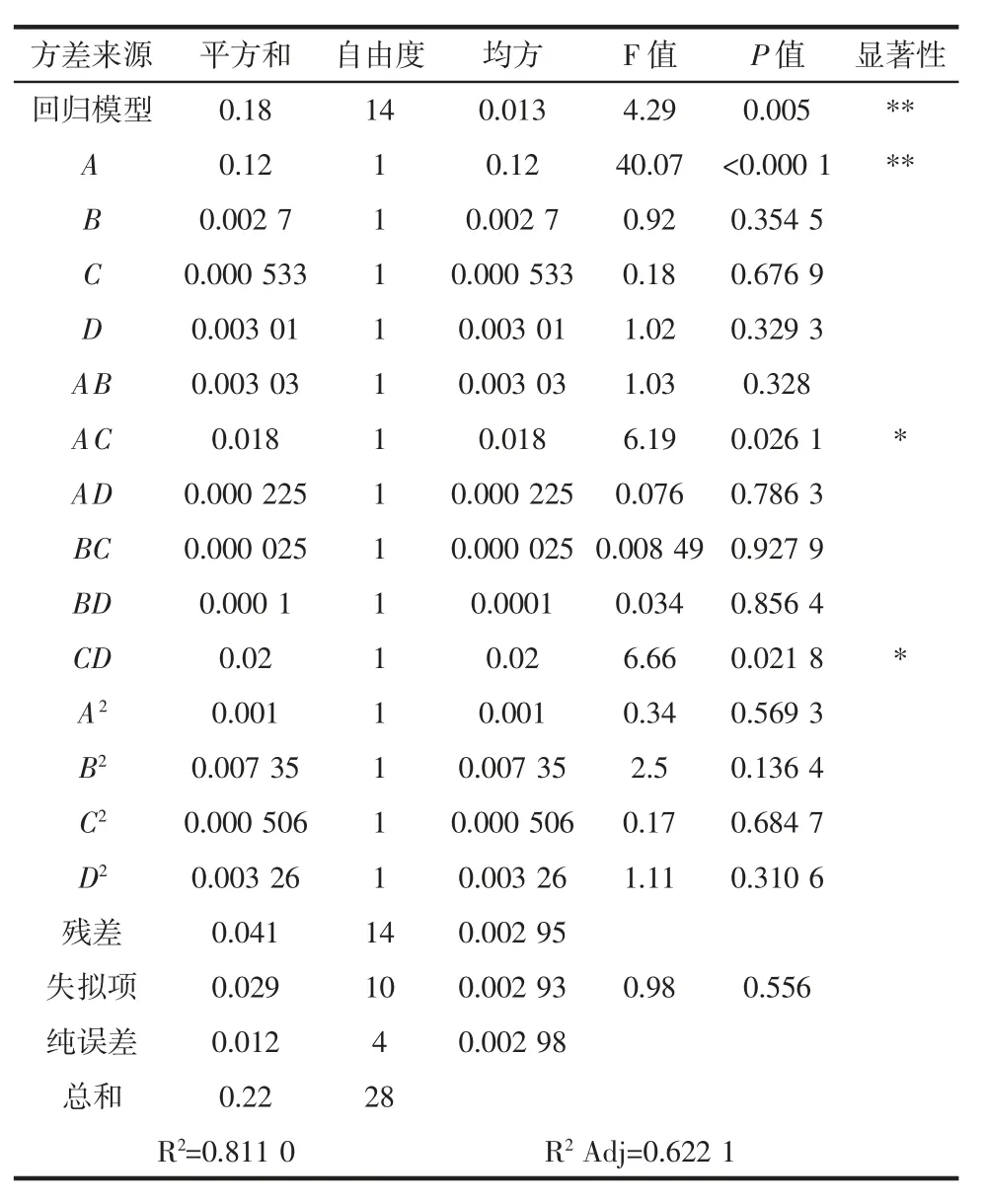
表10 pH 值拟合二次多项式模型方差分析Table 10 Variance analysis of pH fitting quadratic polynomial model
由表10方差分析可知,pH 值的模型确定系数R2=0.811 0,校正系数R2Adj=0.622 1,模型的P 值为0.005,说明模型极显著,失拟项 P 值为 0.556>0.05,影响不显著,表明回归方程与实测值之间拟合较好;一次项A 对感官评分的影响极显著(P<0.01),而交互作用项 AC、CD 的差异显著(P<0.05)。由表10中各因素的P 值可知,各因素对调理羊肉pH 值的影响大小依次为接种量(A)>发酵温度(D)>大豆蛋白添加量(B)>发酵时间(C)。
2.2.2 各因素间的交互作用分析
图9中显示了各因素之间的交互作用对调理羊肉感官评分的影响。
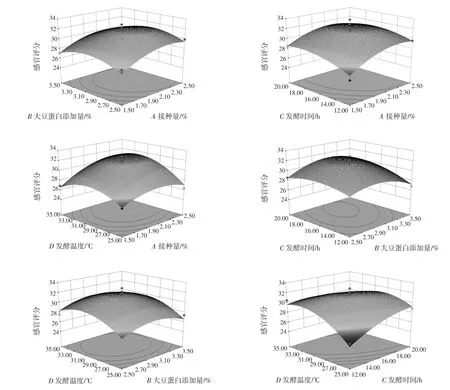
图9 各因素之间的交互作用对调理羊肉感官评分影响的响应曲面和等高线Fig.9 Response surface and contour of the interaction between various factors on the sensory score of conditioning lamb
由图9可知,接种量与大豆蛋白添加量、接种量与发酵时间、接种量与发酵温度、大豆蛋白添加量与发酵时间、大豆蛋白添加量与发酵温度、发酵时间与发酵温度对调理羊肉感官评分的交互作用均不显著。
图10中显示了各因素之间的交互作用对调理羊肉pH 值的影响。
由图10可知,接种量与大豆蛋白添加量、接种量与发酵温度、大豆蛋白添加量与发酵时间、大豆蛋白添加量与发酵温度对调理羊肉pH 值的交互作用不显著,而接种量与发酵时间、发酵时间与发酵温度间的交互作用显著。
综合表8中的响应值Y1和Y2,通过Design-Expert V 8.0.6 软件对方程进行求解,得到调理羊肉最佳发酵条件为:菌种接种量1.71%,大豆蛋白添加量3.11%,发酵时间19.98 h,发酵温度30.09 ℃,此时的感官评分为30.01,pH 值为5.50。为了验证最优发酵条件,考虑到实际操作的可行性,将优化所得最佳发酵条件修正为:菌种接种量1.7 %,大豆蛋白添加量3.0 %,发酵时间20 h,发酵温度30 ℃。在上述确定的最优发酵条件下重复3 次验证试验,得到调理羊肉的感官评分为(30.35±0.69)分,pH 值为 5.46±0.05,与理论值接近,说明二次多项式模型拟合度较好。
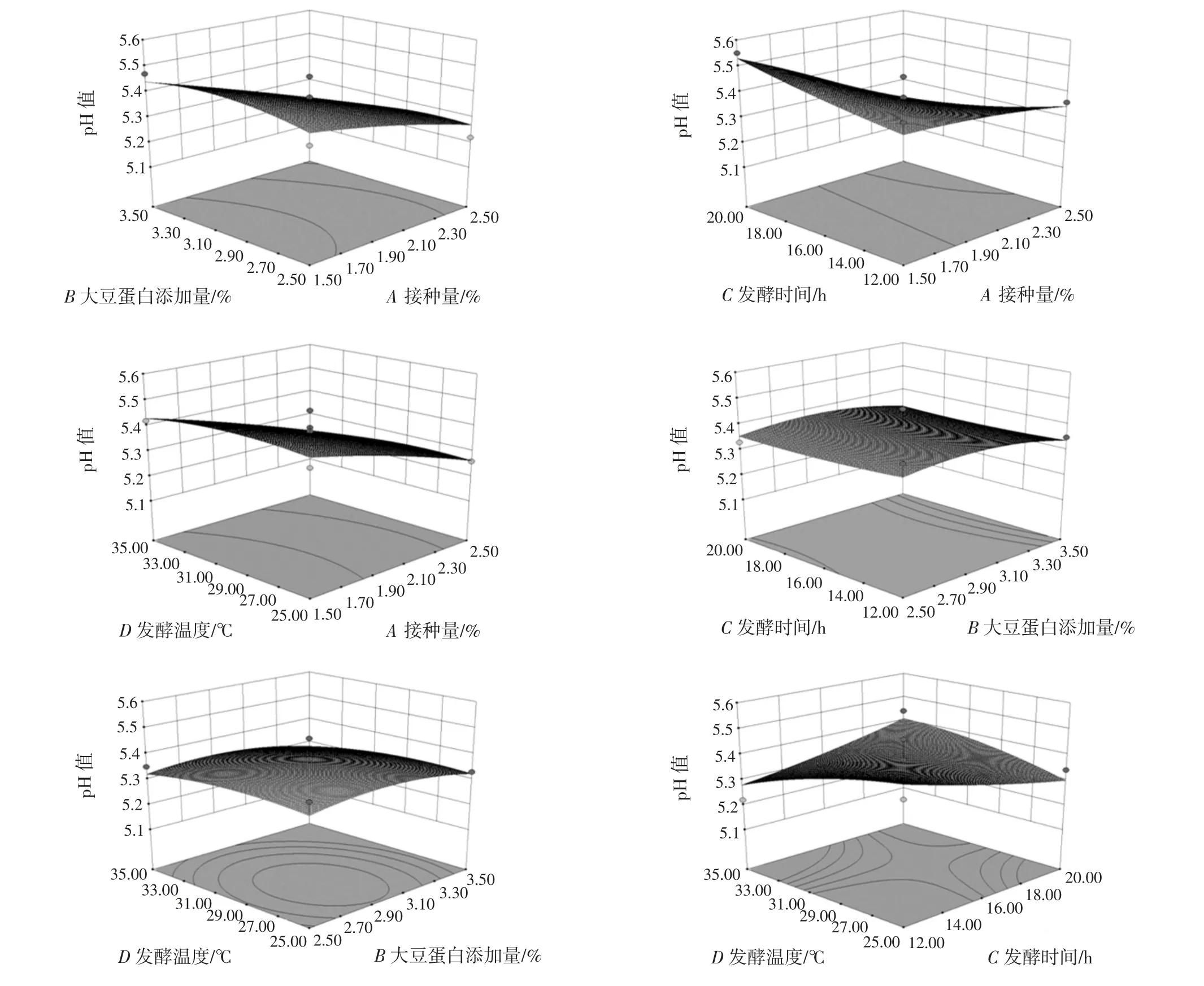
图10 各因素之间的交互作用对调理羊肉pH 值影响的响应面和等高线Fig.10 Response surface and contours of the interaction between various factors on the pH of conditioning lamb
3 结论
本试验采用了具有除膻作用的菌株米根霉TZH3和米曲霉TZH4 对调理羊肉进行发酵,结合感官评分、pH 值、色差和蒸煮损失率探究了菌种接种量、大豆蛋白添加量、发酵时间和发酵温度对冷冻调理羊肉的影响。在此基础上利用响应面优化试验进一步分析,以调理羊肉的感官评分和pH 值为响应值,得到加工调理羊肉的最佳工艺参数为:菌种接种量1.7%,大豆蛋白添加量3.0%,发酵时间20 h,发酵温度30 ℃,此时调理羊肉的感官评分为(30.35±0.69)分,pH 为5.46±0.05,与理论值相近。当 pH 值在 5.15~5.55 之间,调理羊肉的感官评分较高,此时调理羊肉的香气、滋味和口感等较为适宜。该条件下有利于米根霉和米曲霉的的生长繁殖和脂肪酶的产生,能对羊肉的风味起到改善的作用。同时在该酸性条件下,羊肉的咀嚼性和组织状态得到提高,提升了羊肉对食用者的可接受性。

