2种因素对兰州百合继代组培苗生长的影响
段四喜,徐春莲,汤王外,和寿星*
(1.大理市农业环境保护监测站,云南 大理 671000;2.云南省农业科学院 高山经济植物研究所,云南 丽江 674100)
兰州百合(Liliumdavidiivar.unicolor)是百合科(Liliaceae)百合属(Lilium)川百合的变种,为多年生鳞茎草本植物,有很高的食用、药用、保健和观赏价值[1,2]。采用组织培养进行百合的快速培养和脱毒复壮,可促进百合商品种球的生产和百合新品种的培育[3-5]。其中,不定芽诱导的多少是影响植株组织培养的关键因素[5,6]。但是在初代诱导结束以后,有无不定芽产生会对兰州百合继一代试管苗产生怎样的影响尚未见报道。
在兰州百合组培中往往将组培分为初代、继代和生根3个阶段[7,8]。其中,继代培养是植物组织培养过程中的重要环节,也是离体保存种质资源的重要手段。该阶段通常需要连续多代的培养,在整个组培过程中占据的比例大、周期长[9-13]。在此阶段如果激素(尤其是NAA和6-BA)浓度过高或者过低,均会严重影响组培苗的生长发育;但若两者浓度和比例适宜,则可实现外植体的快速繁殖[5,8,14]。在百合继代培养中NAA和6-BA浓度范围一般在0.1~1.0 mg/L[14-16]。随着离体培养技术的发展,很多学者发现多种植物组培苗在长期继代保存过程中增殖能力和生根能力会发生变化[10,17,18],例如:卷丹[11]、东方百合[19]、龙牙百合[20]等继代培养3次时组培苗分化和长势最好,最有利于移栽,之后随着继代次数的增加鳞茎分化率不断下降;杜捷等[12]发现兰州百合继代培养5次以后无分化能力。但上述学者都仅局限于研究继代频次数对百合组培苗分化和长势的影响,并未引入在这一动态过程中激素浓度是否有必要适当调整的研究。截止目前,仅有本课题组就兰州百合继一代和继二代的激素浓度需要适时调整做过相关研究[14],但在后续继代培养过程中,激素浓度是否需要适当调整等并未有相关研究。因此,如何既能最大限度根据不同的继代频次调整激素浓度,又可以使组培苗快速健康的生长是目前生产需要解决的关键问题。基于此,本试验的目的一是探讨在继一代组培中初代有无不定芽产生对试管苗生长的影响;二是在最佳继代次数3次时,使NAA和6-BA浓度在0.1~1.0 mg/L范围内,继续探讨不同继代次数激素浓度的调整对试管苗生长发育情况的影响,旨在提高兰州百合再生植株的效率,为种质资源的保存奠定技术基础。
1 材料与方法
1.1 试验时间、地点
于2017年4月在云南省农业科学院高山经济植物研究所组培室进行鳞片组织培养。
1.2 试验材料
1.2.1 材料 兰州百合鳞茎采集于丽江市龙山镇,供试材料鳞片保持完好,抱合紧密、健壮、无病斑、色泽光亮、无机械损伤,鳞茎盘无损坏。
1.2.2 培养条件 先在4 ℃冰箱中保存40 d,之后采用固体MS 培养基,培养基中蔗糖30 g/L,琼脂6.5 g/L,pH 值5.8,根据试验材料添加其他物质,121 ℃高压灭菌25 min。接种后放到培养室中培养,培养温度为(25±2) ℃,日光灯光源,光照强度2000 lx,光照时间16 h /d。
1.3 试验方法
1.3.1 初代有无不定芽产生对继一代生长的影响 在初代接种30 d后,筛选出初代未污染的外植体,设3个处理,各处理激素浓度如表1所示,同时将每个处理都分为有不定芽产生和无不定芽产生两处理,每瓶接种4个点,每处理接种30瓶,重复3次。接种后15、18、25、28 d观察并记录未污染外植体获得率、转绿率和死亡率。
1.3.2 不同激素浓度对继一代兰州百合生长的影响 在初代最优培养基MS+1.0 mg/L NAA +0.1 mg/L 6-BA中(已有前期结果[14]),将有不定芽产生的试管苗进行切割,每瓶接种4个点,设3个处理,各处理激素浓度如表1所示,每隔一段时间观察记录初代有不定芽产生3个处理的生叶率、死亡率和小鳞茎个数,接种33 d后统计叶片数和小苗株数。
1.3.3 不同激素浓度对继二代兰州百合生长的影响 在继一代最优培养基中,筛选出长势基本一致的试管苗,剪除叶片,将其进行切割,每瓶接种4个点,接种于继二代的3个处理中,各处理激素浓度如表1所示。每隔一段时间观察记录继二代的发芽率、生叶率、叶片数和不定芽个数。
1.3.4 不同激素浓度对继三代兰州百合生长的影响 在继二代最优培养基中,筛选出长势基本一致的试管苗,剪除叶片,将其进行切割,每瓶接种4个点,各处理激素浓度分别如表1所示。接种后30 d观察生叶率、发芽率、叶片数和不定芽个数,筛选出最适宜的继三代培养基。
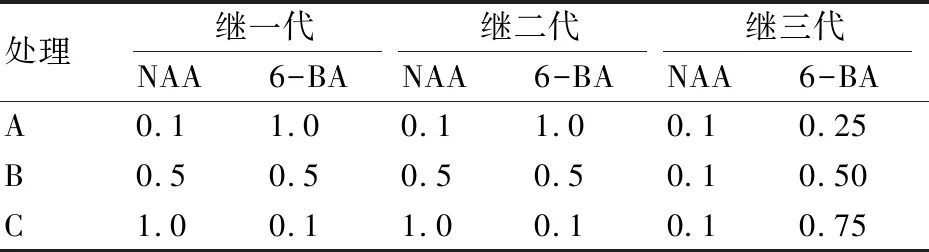
表1 不同继代次数的激素浓度 mg/L
1.3.5 相关计算公式 未污染外植体获得率(%)=(未污染外植体个数/外植体接种总数)×100%。
外植体存活率(%)=(未污染且存活的个数/外植体接种总数) ×100%。
外植体转绿率(%)=(转绿个数/未污染的外植体总数) ×100%。
外植体发芽率(%)=(发芽的个数/未污染的外植体总数) ×100%。
外植体生叶率(%)=(长叶个数/未污染的外植体总数) ×100%。
1.4 统计分析
采用Microsoft Excel 2003和SPSS软件统计分析数据。
2 结果与分析
2.1 初代有无不定芽产生对继一代生长的影响
由图1~图3可知,在继一代培养中,有无不定芽两处理未污染外植体获得率、转绿率和死亡率3个指标差异均显著。有不定芽产生处理的外植体获得率、转绿率远高于无不定芽产生处理,死亡率则远低于无不定芽产生处理。在继一代培养结束后,无不定芽产生处理3个激素浓度组合死亡率均为100%,有不定芽产生处理则为A处理死亡率稍高达到19.02%外,其于两个处理死亡率均较低。
在15~28 d范围内,两处理未污染外植体获得率变化均较平缓,尤其在继一代培养的后期(25~28 d)污染率不再增加。就外植体转绿率情况而言,在接种后15~25 d范围内A处理有无不定芽两处理间无显著差异,而B和C两处理间差异显著,有不定芽产生处理远高于无不定芽产生处理,但在接种后期(接种后28 d)差异不显著。
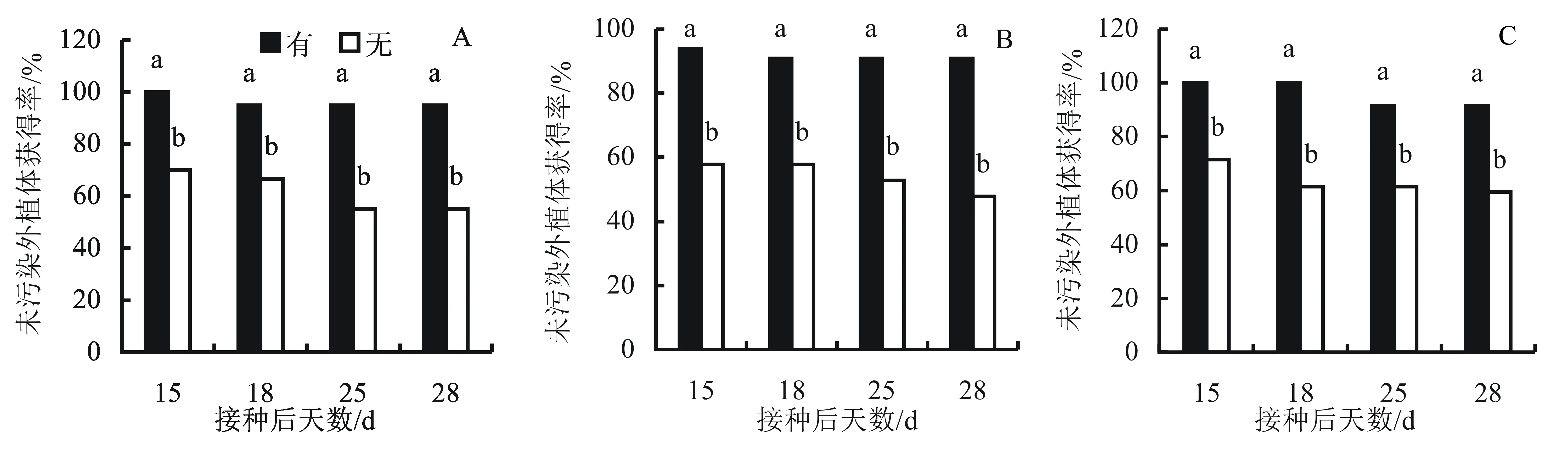
图1 初代有无不定芽产生对继一代未污染外植体获得率的影响

图2 初代有无不定芽对继一代外植体转绿率的影响
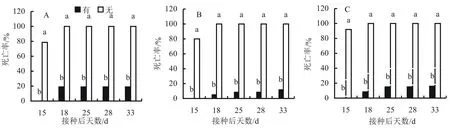
图3 初代有无不定芽对继一代外植体死亡率的影响
2.2 不同激素浓度对兰州百合继一代生长的影响
由表2可知,3个激素浓度处理间各时期生叶率、死亡率、小鳞茎个数和叶片数差异显著,长势变化幅度较大。就生叶率而言,在接种后13~20 d时A处理稍强,接种后23~33 d,B处理稍强。在接种后20 d 3个处理在不同程度上都呈现死亡现象,死亡率表现为A>C>B。在接种后13 d 3个处理间小鳞茎个数差异不显著,接种20~33 d后差异均显著,为B>A>C;接种33 d后,尽管3个处理叶片数间差异不显著,但是叶片数以B处理稍多。综合而言,在继一代培养中以B处理(MS+0.5 mg/L NAA+0.5 mg/L 6-BA)的激素浓度最有利于兰州百合生长发育,其次为C处理,而A处理稍差(图4)。
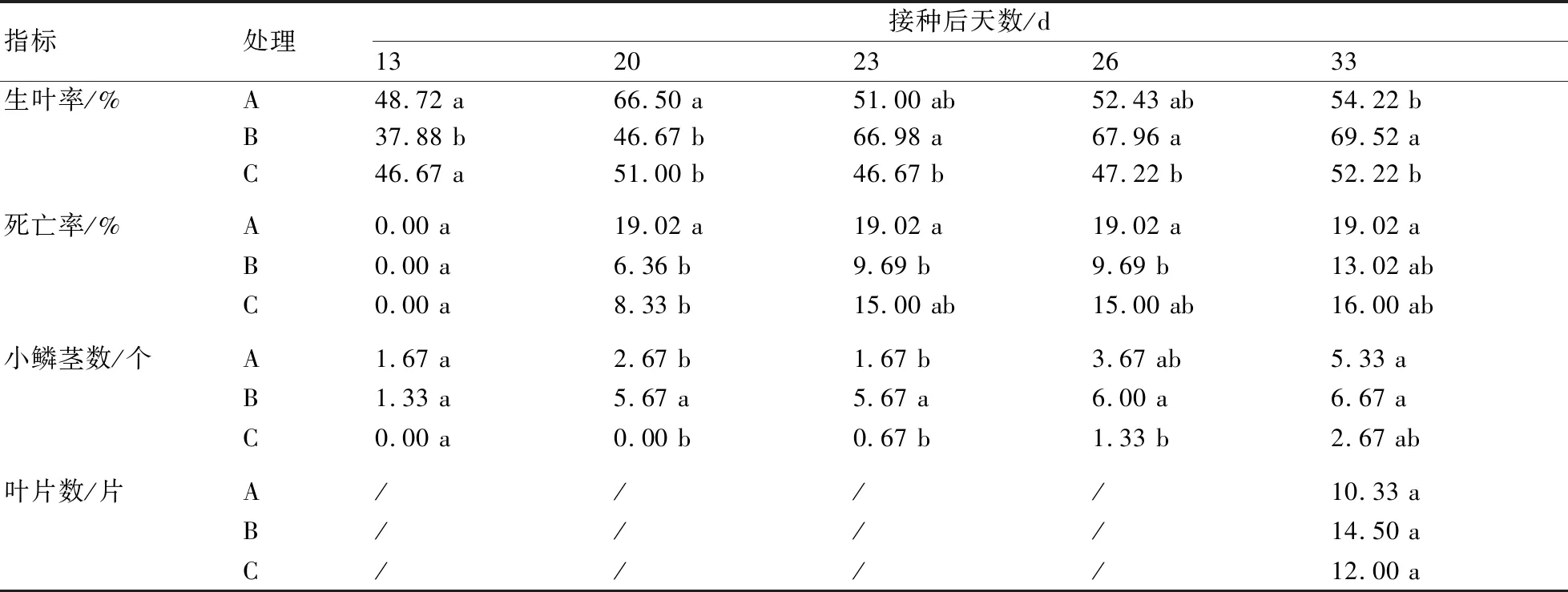
表2 不同激素浓度对继一代兰州百合生长的影响
注:“/”表示此指标没有统计。下同。

图4 激素浓度对继一代苗长势的影响(接种后20 d)
2.3 不同激素浓度对继二代兰州百合组培苗的影响
由图5可知,试管苗生叶率基本呈现正态分布,接种后7~17 d生叶率快速增多,17~38 d变化平缓,38~44 d急剧下降。除接种后34 d为A>B>C外,在各阶段生叶率均呈现B>A>C。从接种后7 d开始发芽率不断的下降,在38~44 d急剧下降,各阶段发芽率均表现为C>A>B。由表3可知,3个处理叶片数和不定芽数有差异但不显著,除接种后44 d叶片数和不定芽数为B稍大于A外,其余均为A>B>C。继二代兰州百合培养以A(MS+0.1 mg/L NAA+1.0 mg/L 6-BA)为最适培养基,其次为B,而C处理相对较差(图6)。

表3 不同激素浓度对继二代兰州百合生长的影响
2.4 不同激素浓度对继三代兰州百合组培苗生长的影响
由表4可知,继三代各阶段生叶率始终远高于发芽率。3个处理生叶率C最高,发芽率C最低,生叶率和发芽率均为C与A和B两处理差异显著,而A和B间差异不显著。各处理叶片数间差异不显著。不定芽个数除接种后31 d差异显著,为C>A>B外,其余各阶段在接种后不同时期无显著差异。继三代处理6-BA浓度在0.25~0.50 mg/L范围内波动时,A和B两处理生长发育情况基本一致,6-BA浓度的变化对百合鳞片的增殖扩繁影响甚微。因此,在继三代培养中以C处理(MS+0.1 mg/L NAA+0.75 mg/L 6-BA)为最适培养基,而A和B处理长势接近,暂不能区分何种激素浓度为适宜培养浓度(图7)。
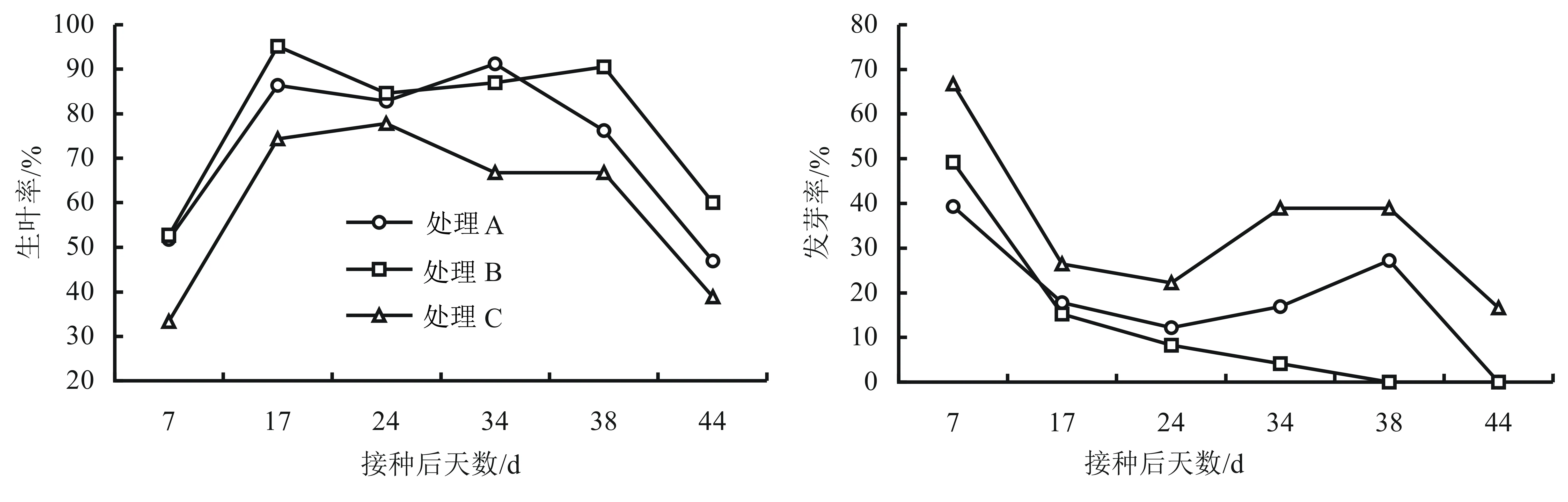
图5 激素浓度对继二代生叶率和发芽率的影响

图6 激素浓度对继二代苗长势的影响
3 讨论与结论
初代有无不定芽产生与继一代试管苗存活有很大的关系,初代培养30 d后,无不定芽产生处理一般可认定为死亡[9,21-22]。尽管在继一代培养中,初代无不定芽产生处理接种后有转绿现象出现,且转绿率在最高时可达42.86%,但是在本试验条件下,3种激素浓度处理均不会再产生不定芽,继一代培养结束后(接种后33 d)完全死亡。这进一步说明,初代培养30 d左右后,无不定芽产生处理一般可认定为死亡。因此,在筛选继一代培养材料时,应挑选初代已产生不定芽的材料,以提高试管苗的存活率。
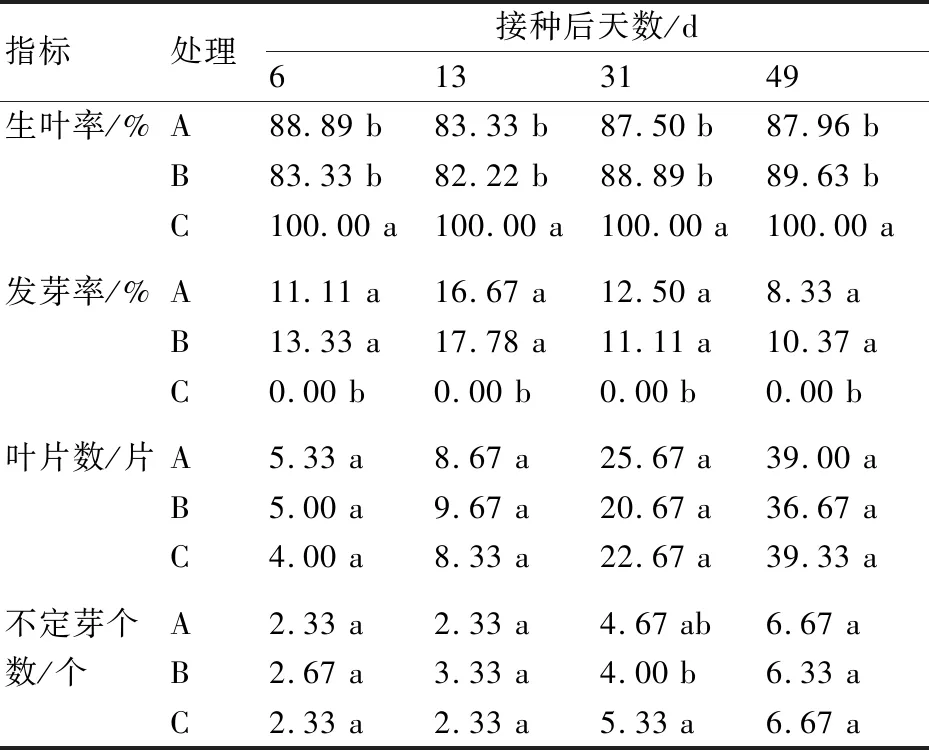
表4 不同激素浓度对继三代兰州百合生长的影响

图7 激素浓度对继三代苗长势的影响(接种后35 d)
在百合的组织培养研究中已经证实6-BA和NAA浓度水平是百合不定芽能否产生的关键因素[5,8,14],在其增殖时对激素浓度也有不同的要求[23]。本课题组前期研究结果也表明继一代培养基以MS+0.1 mg/L NAA+1.0 mg/L 6-BA为最佳培养基,继二代以MS+0.1 mg/L NAA +0.5 mg/L 6-BA为适宜培养基[14]。但本试验研究结果表明继一代和继二代分别以MS+0.5 mg/L NAA+0.5 mg/L 6-BA和MS+0.1 mg/L NAA+1.0 mg/L 6-BA为适宜培养基。诱导培养33 d后,最佳继一代培养基生叶率、小鳞茎数和叶片数分别为69.52%、6.67个和14.50片,但死亡率仅为13.02%;最佳继二代培养基生叶率、叶片数和小鳞茎数在最高时分别达到91.18%、21.00片和7.67个;与前期研究结果相比,本试验继一代培养基NAA浓度提高5倍,6-BA浓度却降低了2倍;继二代NAA浓度不变,6-BA浓度却提高2倍。这可能与前期试验均从上一代中筛选长势一致的试管苗进行下一代组培扩繁,而本试验在上一代最优培养基中筛选出长势基本一致的试管苗进行下一代组织培养有关。这可能导致植物本身内源激素的水平不同,另外内源激素又随植物组织的部位以及生长期等条件而变动,从而改变各处理所需的适宜激素水平,这进一步说明不同外源植物生长调节剂水平显著影响植物的生长发育[24,25],但具体机理有待于进一步研究探讨。继三代培养以MS+0.1 mg/L NAA+0.75 mg/L 6-BA为最佳培养基,生叶率和发芽率在各阶段均为100%和0.00%,而6-BA浓度为0.25、0.50 mg/L的两处理对不同激素水平表现不敏感,这一方面应与继代后期体细胞无性系变异有关,另一方面应与激素浓度过低,芽的生长受到抑制有关[26-28]。

