小剂量肠内营养对感染性休克伴急性胃肠功能损伤患者炎症反应及预后的影响
霍继浩,纪燕玲,宋涛涛,冯晓凯
(鹤壁市人民医院EICU,河南 鹤壁 458030)
感染性休克是临床中的急危重症,感染发生后机体会产生大量抗炎及促炎细胞因子,导致免疫损伤和血管内皮损伤的发生,从而进一步加重了患者病情[1]。对于感染性休克,传统的治疗方案首先处理原发病灶,积极引流感染灶,给予抗感染治疗,维持内环境器官灌注的稳定,以改善患者病情。尽管给予对症支持治疗,但是大量炎性细胞因子加剧了患者器官功能损伤,使得感染性休克患者的死亡率依然较高[2]。在感染性休克患者救治中,给予肠内营养治疗对肠功能进行保护,并减少并发症已经得到临床认可[3]。不过由于低蛋白血症等原因,患者会出现不耐受现象,而且部分患者会合并急性胃肠功能损伤(AGI),尤其是Ⅲ级AGI患者,往往终止肠内营养治疗[4]。不过在临床实际中发现,感染性休克伴AGI患者虽然无法耐受全量或者半量的肠内营养治疗,但是完全不能耐受肠内营养治疗的情况较少[5],对于该类患者是否给予可耐受剂量的肠内营养治疗目前临床中并无定论。基于此,本研究分析了小剂量肠内营养对感染性休克伴AGI患者炎症反应及预后的影响,报告如下。
1 资料与方法
1.1 一般资料
收集2014年1月至2016年1月鹤壁市人民医院收治的感染性休克合并AGI患者67例,入选标准:1)均符合ACCP/ SCCM会议共识中的诊断标准[6];2)均伴有组织灌注不足及血流动力学不稳定[5];3)AGI分级为Ⅲ级[6];4)所有患者均接受同一医师指导治疗;5)病例资料齐全者。排除标准:1)入住ICU后1周内死亡者;2)合并恶性肿瘤、心脏瓣膜病或者急性冠状动脉综合征者;3)伴有自身免疫性疾病者;4)合并原发性消化系统功能障碍者;5)发病超过12 h入住ICU者。67例患者中,男48例,女19例;年龄26~73岁,平均(47.83±13.19)岁。根据不同治疗方案即有无肠内营养治疗分为对照组(n=31)和研究组(n=36),2组患者的一般资料比较差异均无统计学意义(P>0.05),见表1。
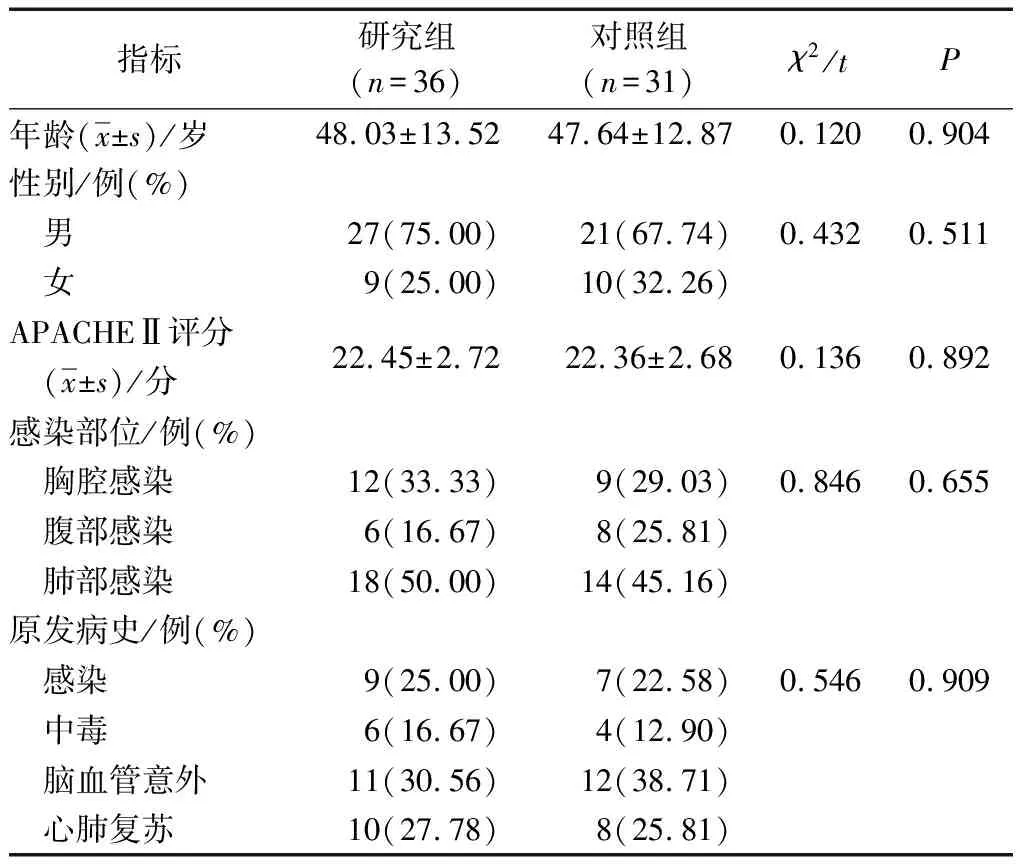
表1 2组患者一般资料比较
1.2 治疗方法
所有患者在明确诊断之后,于发病12 h内入ICU进行治疗。所有患者均在同一组医师指导下接受治疗。对照组给予液体复苏治疗,保持患者呼吸道通畅,行气管插管,给予机械通气支持,并根据ACCP/ SCCM会议共识给予治疗[6],进行血液、痰液或者可疑体液培养,根据细菌学检查结果给予敏感性高的广谱抗生素进行抗感染治疗,补充体液以维持内环境稳定,肠外营养支持治疗,必要时给予红细胞输注以及器官支持治疗。研究组在对照组治疗基础上加用小剂量肠内营养治疗,将短肽型肠内营养剂(商品名:百普素,德国 Milupa GmbH公司生产,规格:125 g·袋-1)配置成为1 kcal·mL-1,经鼻空肠营养管输注,根据患者耐受情况调整剂量,以患者能耐受剂量为维持量。
1.3 观察指标与检测方法
1)炎症因子及肠功能屏障指标:分别于治疗前及治疗1周抽取静脉血10 mL,常温放置30 min,以3500 r·min-1进行离心,离心5 min后提取血清,放置于-20 ℃冰箱中保存待检,通过酶联免疫吸附试验法测定血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)及C反应蛋白(CRP)等炎症因子水平,所需试剂盒购于北京百晶生物技术有限公司,严格按照试剂盒说明进行操作;通过定量检测试剂盒检测D-乳酸、内毒素(ET)和二胺氧化酶(DAO)等肠功能屏障指标水平。2)临床指标:记录患者ICU入住时间、机械通气时间、抗生素使用时间、APACHEⅡ评分。3)短期预后:治疗4周后,记录患者死亡例数及死因。
1.4 统计学方法
2 结果
2.1 研究组治疗情况
研究组患者肠内营养治疗剂量为723.6~1 528.9 kJ·d-1(200~400 kcal·d-1),中位剂量为1 263.2 kJ·d-1;在肠内营养治疗过程当中,36例患者均出现了程度不同的腹胀现象,其中3例患者出现呕吐,给予调整体位、降低输注速度或者暂停输注等处理后缓解,有10例患者给予甲氧氯普胺注射液10 mg静脉推注,无一例患者出现完全不能耐受或者严重并发症。
2.2 2组临床指标比较
研究组ICU入住时间、抗生素使用时间、机械通气时间以及治疗后APACHEⅡ评分均明显低于对照组,差异均有统计学意义(P<0.05),见表2。
2.3 2组炎性因子水平比较
2组治疗前血清TNF-α、IL-6、CRP水平比较差异均无统计学意义(P>0.05)。2组治疗1周后血清TNF-α、IL-6、CRP水平均较治疗前显著降低(P<0.05),且研究组降低较对照组更为显著(P<0.05),见表3。
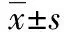
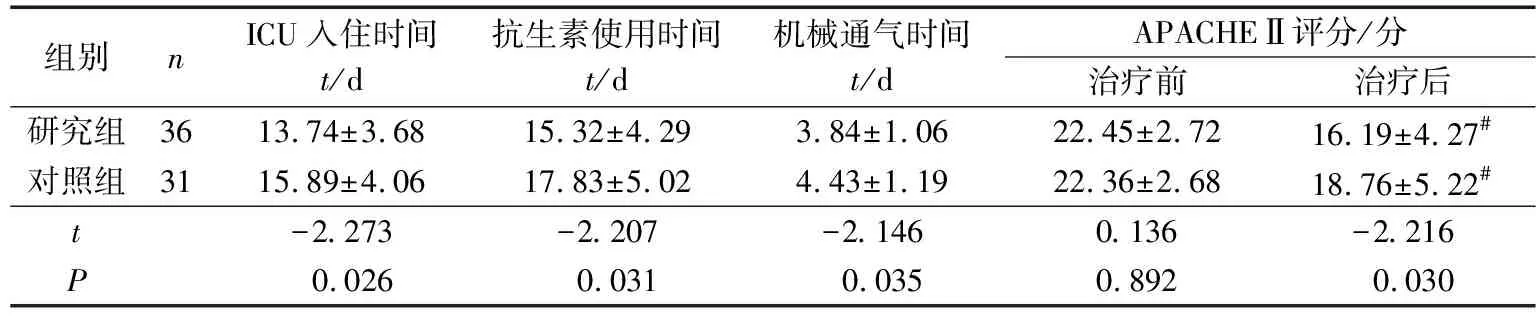
组别nICU入住时间t/d抗生素使用时间t/d机械通气时间t/dAPACHEⅡ评分/分治疗前治疗后研究组3613.74±3.6815.32±4.293.84±1.0622.45±2.7216.19±4.27#对照组3115.89±4.0617.83±5.024.43±1.1922.36±2.6818.76±5.22#t-2.273-2.207-2.1460.136-2.216P0.0260.0310.0350.8920.030
#P<0.05与同组治疗前比较。
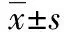
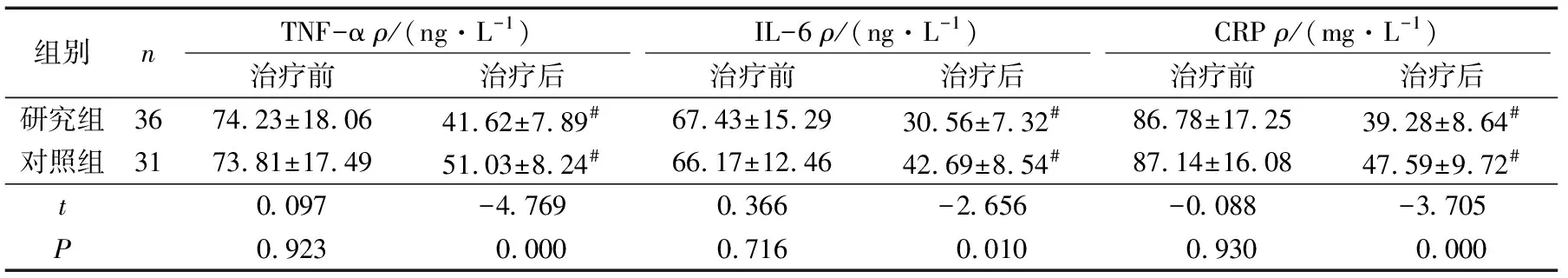
组别nTNF-α ρ/(ng·L-1)IL-6 ρ/(ng·L-1)CRP ρ/(mg·L-1)治疗前治疗后治疗前治疗后治疗前治疗后研究组3674.23±18.0641.62±7.89#67.43±15.2930.56±7.32#86.78±17.2539.28±8.64#对照组3173.81±17.4951.03±8.24#66.17±12.4642.69±8.54#87.14±16.0847.59±9.72#t0.097-4.7690.366-2.656-0.088-3.705P0.9230.0000.7160.0100.9300.000
#P<0.05与同组治疗前比较。
2.4 2组肠屏障功能指标比较
2组治疗前血清D-乳酸、ET以及DAO水平比较差异均无统计学意义(P>0.05)。2组治疗1周后血清D-乳酸、ET以及DAO水平均较治疗前显著降低(P<0.05),且研究组降低较对照组更为显著(P<0.05),见表4。
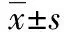
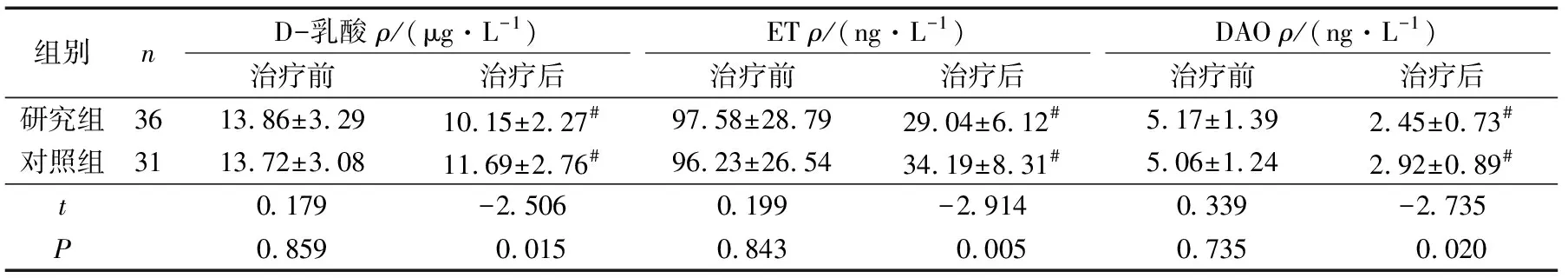
组别nD-乳酸 ρ/(μg·L-1)ET ρ/(ng·L-1)DAO ρ/(ng·L-1)治疗前治疗后治疗前治疗后治疗前治疗后研究组3613.86±3.2910.15±2.27#97.58±28.7929.04±6.12#5.17±1.392.45±0.73#对照组3113.72±3.0811.69±2.76#96.23±26.5434.19±8.31#5.06±1.242.92±0.89#t0.179-2.5060.199-2.9140.339-2.735P0.8590.0150.8430.0050.7350.020
#P<0.05与同组治疗前比较。
2.5 2组病死率比较
治疗28 d后,67例患者中死亡19例,存活48例,死亡率为28.36%;其中研究组死亡9例,死因分别为多器官功能障碍综合征1例,呼吸衰竭4例,感染性休克4例,病死率为25.00%;对照组死亡10例,弥散性血管内凝1例,多器官功能障碍综合征2例,呼吸衰竭2例,感染性休克5例,病死率为32.26%;2组病死率比较差异无统计学意义(χ2=0.432,P>0.05)。
3 讨论
当感染性休克发生时,由于机体对感染反应失调,进而造成一系列病理情况发生。感染所引起的大量炎性细胞因子释放至血液中,造成血管功能障碍出现,第三间隙体液丢失,严重患者可出现感染性休克,部分患者会出现多系统器官功能衰竭[7]。出现全身炎症反应时本身即可造成胃肠道缺血,出现休克之后患者肠道供血不足会明显加重,即便给予胃肠减压、控制饮食以及液体复苏等治疗,虽然在总体上可达到改善的预期目标,但是患者肠道缺血情况可能仍然存在,同时受到禁食等因素影响,患者肠屏障功能被破坏难以避免[8]。在患者肠屏障被破坏之后,肠道大量细菌会移位至血液中造成肠源性感染,从而进一步加剧患者全身状况。
在感染性休克的临床治疗中,及早给予肠内营养支持治疗有助于改善患者全身状况。马年斌等[9]的研究显示,对于重症感染性休克患者于发病48 h内给予肠内营养治疗可促进患者恢复,并减少了并发症的发生。不过对于伴有AGI尤其是Ⅲ级的感染性休克患者,由于胃肠功能衰竭,其耐受肠内营养的剂量要明显低于83.68 kJ·kg-1·d-1(20 kcal·kg-1·d-1),此时给予肠内营养支持是否安全,且是否有必要给予肠内营养支持目前临床中尚未定论。本研究中,在不以维持或者改善患者营养状况的前提条件之下,对小剂量肠内营养支持在感染性休克伴AGI患者中的应用效果进行了分析,研究发现,研究组患者耐受肠内营养的中位剂量为1 263.2 kJ·d-1,且无一例患者出现完全不能耐受或者严重并发症;而且通过实施小剂量肠内营养支持治疗,研究组ICU入住时间、抗生素使用时间、机械通气时间以及APACHEⅡ评分均明显低于对照组,表明给予小剂量肠内营养治疗可促进患者恢复。研究结果提示对于感染性休克伴AGI Ⅲ级患者给予肠内营养支持治疗有一定可行性,不过需要更多样本进一步证实。
TNF-α和IL-6均是促炎性细胞因子,在慢性炎症维持以及急性炎症级联放大中均发挥了重要促进作用[10];CRP为急性期反应蛋白的一种,临床中评估感染程度的主要指标,水平越高表示感染越严重[11]。本研究发现,经过治疗之后,研究组患者血清TNF-α、IL-6以及CRP值明显低于对照组,表明小剂量肠内营养支持治疗可以进一步减轻患者的炎症反应,这对感染性休克患者病情改善具有重要作用。D-乳酸为细菌代谢产物的一种,人类细胞自身并无法产生D-乳酸,在肠屏障功能出现损伤后,此时D-乳酸能够进入至外周血进而被检测到,因而反映了机体肠黏膜损伤情况以及肠道通透性[12]。DAO属于肠黏膜上皮细胞内酶的一种,肠黏膜细胞受到损伤之后可进入至外周血当中,为反映机体肠黏膜上皮屏障是否完整的重要指标之一[13]。ET为革兰阴性细菌细胞壁脂多糖成分,当机体肠黏膜屏障功能正常时,能够阻挡内毒素及新UN进入至血液中,而当肠屏障功能损伤后ET能够通过肠黏膜进入至循环系统中[14]。因此,通过测定血清D-乳酸、DAO以及ET值可以在一定程度上反映机体肠屏障功能。本研究中,通过分析2组患者肠屏障功能指标发现,研究组患者血清D-乳酸、DAO以及ET值均明显低于对照组,提示小剂量肠内营养治疗可改善肠屏障功能。进一步分析发现,治疗28 d后,2组患者病死率并无明显差异,提示小剂量肠内营养治疗对感染性休克伴有AGI患者短期预后并无明显改善。
在肠内营养支持治疗过程中,笔者体会到:1)感染性休克患者病情复杂且多变,每个患者的病情均存在不同,应当针对患者病情给予个体化治疗,及时调整肠内营养的剂量及输注速度;2)在肠内营养实施过程中要注意安全性,尤其是胃肠功能衰竭者,密切观察患者病情变化情况,出现腹胀、胃潴留以及呕吐等症状时,可降低输注速度,无法缓解者可暂停使用,症状好转之后可先低速应用,如5 mL·h-1的速度,从而确保患者安全进行肠内营养支持治疗。
综上所述,对于感染性休克合并AGI患者给予小剂量肠内营养治疗可减轻应激反应、炎症反应,改善肠屏障功能,促进患者恢复,但对患者短期预后并无明显改善。不过本研究样本量偏少,且为非随机对照前瞻性研究,在随后的研究中应开展多中心、大样本、前瞻性研究进一步证实。

