缺血性脑白质病变的临床特征与危险因素分析
王祥翔,柴湘婷
(青岛西海岸新区人民医院神经内科,山东 青岛 266400)
脑白质病变(white matter lesions,WMLs),通常指脑白质高信号(white matter hyperintensities,WMHs)或称脑白质疏松(leukoaraiosis,LA),颅脑CT表现为白质密度减低,Hu值较正常低5~10 Hu,磁共振(magnetic resonance imaiging,MRI)表现为T2加权或液体衰减翻转恢复序列(fluid-attenuated inversion recovery,FLAIR)侧脑室旁或皮质下白质的点状、斑片状或融合性高信号,边缘模糊。有调查[1]发现,WMLs在卒中患者中占67%~98%,其中大动脉粥样硬化性卒中的WMLs患病率为55.4%,短暂性脑缺血发作和小卒中者为62%,此外,约2/3的血管性认知障碍存在WMLs。
WMLs影像学可分为脑室周围白质高信号(periventricular white matter hyperintensities,PWMHs)和深部白质高信号(deep white matter hyperintensities,DWMHs)。根据影像特点或形态,通常将PWMHs描述为侧脑室角周围帽状(caps)、细线状(pencil-thin lining),以及月晕状包绕侧脑室(halo);DWMHs则通常分为小点状(punctate)、斑片状和融合灶(confluent)。MRI随访研究[2]发现最初的WMLs体积越大,扩展的速度就越快;平滑的帽状PWMHs和点状的DWMHs可无临床表现,不规则的月晕状PWMHs和融合的DWMHs则会产生明显的组织损伤。WMLs以认知障碍为突出表现,其他症状包括情感障碍、步态不稳、尿失禁以及假性球麻痹。作为脑小血管病(cerebral small vessel diseases,CSVD)的特征之一,WMLs目前认为有多种因素参与,包括缺血、血管内皮损伤、β淀粉样物质沉积、氧化应激、血脑屏障受损以及遗传因素[3-4]等,但目前最被接受的主要机制是穿支动脉损害引起的缺血低灌注学说。
基于以上研究背景,本研究收集了1年内青岛西海岸新区人民医院收治的短暂性脑缺血发作(transient ischemic attack,TIA)和脑梗死(cerebral infarction,CI)患者的临床资料,通过病例对照研究,了解在最常见的缺血环境中WMLs的临床特点和分布规律,探讨在缺血机制下导致明显的WMLs的危险因素。
1 资料与方法
1.1 资料来源与病例选择标准
连续收集2017年6月至2018年5月就诊于本院神经科的TIA/CI患者的临床资料,包括患者的性别、年龄、吸烟史、卒中史、高血压病史、糖尿病史,完善常规辅助检查,包括本研究准备筛选的危险因素,即低密度脂蛋白胆固醇(LDL-C)、糖化血红蛋白(HbA1C)、血清游离三碘甲状原氨酸(T3)水平等。纳入标准:1)符合TIA以及CI定义,TIA发病时间7 d以内,CI包括大动脉粥样硬化型以及小动脉闭塞型,发病时间3周以内;2)CI患者美国国立卫生研究院卒中量表(the National Institutes of Health Stroke Scale,NIHSS)评分≤25分;3)主要病因即最常见的高血压性动脉硬化或动脉粥样硬化;4)患者本人及家属配合检查。排除标准:1)颅内动脉瘤、血管畸形、脑动脉炎、颅内静脉病、静脉窦及脑部静脉血栓形成、高血压脑病等;2)合并其他可能导致WMLs的疾病,如明确的神经系统变性疾病、偏头痛、脑积水、炎性脱髓鞘、颅内感染、明显的精神障碍等可能导致脑白质病变的患者;3)合并危重的代谢疾病、加重病情的感染、自身免疫性疾病、肿瘤、脑外伤、中毒、药物过量或成瘾、营养缺乏以及其他严重的全身系统性疾病;4)存在可能导致WMLs的遗传或发育异常性疾病;5)出血性脑卒中;6)妊娠或哺乳期妇女,以及年龄<18岁的患者。入选患者出院后分别经过30、90 d随访,病情恢复符合脑血管病的演变规律。所有入选病例均获得了其本人或其监护人的知情同意。研究对象或其监护人均签署知情同意书,而且本研究经本院医学伦理委员会审核通过。
1.2 心电图及心脏超声检查
先通过心电图Sokolow-Lyon指数(SV1+RV5)>38 mm为标准初步筛选左心室肥厚(left ventricular hypertrophy,LVH)[5],应用GE Vivid7 Dimension彩色多普勒超声显像仪进一步明确判断。诊断标准参考美国超声心动图协会推荐的测量方法计算左室质量指数(LVMI),根据国内人群研究标准以男性LVMI>125,女性LVMI>120作为LVH的诊断标准[5]。
1.3 颈动脉超声检查
应用GE Vivid7 Dimension彩色多普勒超声显像仪判断颈动脉内中膜厚度(intima-media thickness,IMT),IMT即管腔与血管内膜交界处到血管中膜与外膜交界处的垂直距离。取不同位点IMT值的最大值作为颈动脉IMT值,超过0.9 mm定义为颈动脉IMT增厚(increased IMT,IIMT),彩超检查提示颈动脉斑块者亦即IIMT。
1.4 颅脑磁共振评估
入院3 d内完成美国GE 1.5T MR检查。WMLs的分级参照Fazekas评分标准,将PWMHs和DWMHs分开评分,读片依据FLAIR序列。PWMHs 0分即无白质病变;1分即侧脑室枕角或额角帽状高信号或侧脑室边缘铅笔样薄层信号;2分即室周光滑的晕圈;3分即粗糙较厚的室周病变,边缘不规则的高信号,延伸到深部白质。DWMHs 0分为无白质病变;1分即深部白质斑点状(病灶最大直径<5 mm)或小片状病灶;2分即广泛斑片状白质高信号并早期开始融合倾向;3分即病变大面积融合或不规则融合,病灶最大直径>10 mm。借助T1/T2/弥散成像(diffusion-weighted imaging,DWI)/常规自旋回波(spin echo,SE)+GRE序列(即T2*WI)排除梗死灶、软化灶和CSVD的其他影像学特征,包括腔隙以及血管周围间隙等信息干扰。二者相加得白质高信号总分,其中1~2分为轻度(mild WMLs)即认为无明显白质病变,3~4分为中度(moderate WMLs),5~6分为重度(severe WMLs)[6]。评分完毕,患者可再分为无明显脑白质病变组(无明显WMLs组,Fazekas 0~2分)和明显脑白质病变组(明显WMLs组,Fazekas 3~6分)。
1.5 统计学方法
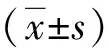
2 结果
2.1 基线资料
共收集具备完善临床资料的患者223例,临床资料包括性别、年龄、吸烟史、卒中史、高血压或糖尿病史、LDL-C等,患者均完成心脏彩超和颈动脉彩超评估以及MR检查。其中男110例(49.3%)、女113例(50.7%),吸烟史53例(23.8%),卒中史42例(18.8%),高血压病146例(65.5%),糖尿病57例(25.6%),LVH 65例(29.1%),IIMT 175例(57%),年龄分布33~89(66.91±11.69)岁、中位年龄68.00岁,LDL-C分布1.16~5.72(3.03±0.80)mmol·L-1、中位值2.94 mmol·L-1。糖尿病患者中38例完成发病期间HbA1C检查,数值分布为6.0%~13.1%(8.62±2.21)%、中位值为8.10%;14例完成T3筛查,数值分布为2.99~5.35(4.12±0.65)pmol·L-1,中位值为4.10 pmol·L-1。223例患者中TIA发病者107例(48.0%),急性脑梗死(acute cerebral infarciton,ACI)新发病者116例(52.0%);CI患病者(CI组)135例(60.5%),单纯TIA患病者(单纯TIA组)88例(39.5%);未见WMHs者11例(4.9%),轻度WMLs者86例(39.5%),中度WMLs者95例(42.6%),重度WMLs者31例(13.9%);按Fazekas评分,无明显WMLs组97例,明显WMLs组126例。
2.2 脑白质病变类型与卒中事件发生的关系
CI组PWMHs、DWMHs评分分别为1.58(0~3)、1.67(0~3)分,单纯TIA组PWMHs、DWMHs评分分别为1.27(0~3)、0.99(0~3)分;CI组PWMHs、DWMHs评分均显著大于TIA组(P=0.004、0.000)。以PWMHs、DWMHs评分作为自变量,卒中事件是否发生作为因变量,进行成组资料的非条件概率Logistic回归分析,结果显示,PWMHs评分增高与卒中事件无显著相关(OR=0.830、P=0.510),DWMHs评分增高是卒中事件发生的独立危险因素(OR=2.922、P=0.000)。见表1。

表1 脑白质病变类型与卒中事件发生的Logistic回归分析
2.3 缺血性脑白质病变危险因素单因素分析
明显WMLs组患者的年龄、高血压、LVH、IIMT及卒中史构成比与无明显WMLs组比较差异均有统计学意义(P<0.05),见表2。

表2 明显WMLs组与无明显WMLs组各指标比较
2.4 缺血性脑白质病变独立危险因素多因素分析
以年龄、高血压、LVH、IIMT及卒中史为自变量,以是否存在明显WMLs为因变量,进行Logistic回归分析,结果显示,年龄、高血压以及LVH是明显缺血性脑白质病变的独立危险因素,见表3。
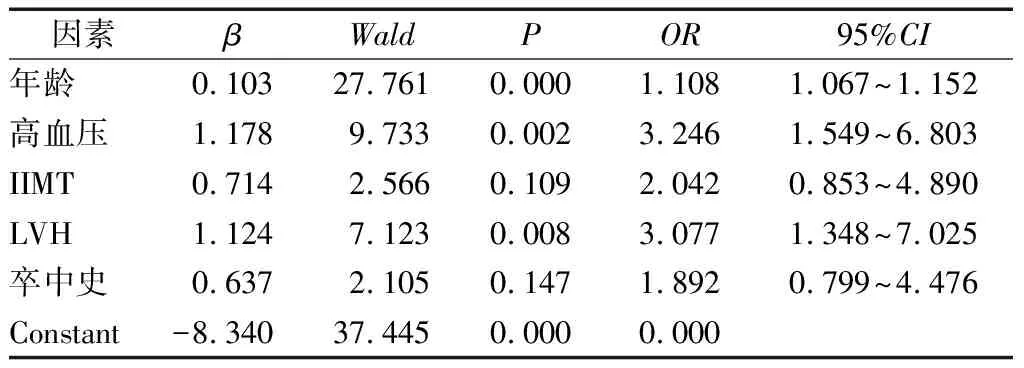
表3 缺血性脑白质病变独立危险因素多因素Logistic回归分析
3 讨论
WMLs是临床中频繁遇见的MRI影像特征。与CT相比,MRI在检测WMLs方面更为敏感。目前常用的基于MRI的量表包括本研究采用的Fazekas量表外,还包括Wahlund年龄相关脑白质改变(ARWMC)评分和胆碱能通路白质量表(CHIPS)。ARWMC分级标准由于详尽、全面的分区,对各脑区WMLs的检测及在评估WMLs与认知功能的相关性方面具有优势。CHIPS量表因与AD的发病机制紧密联系,在观察AD及轻度认知障碍(MCI)患者的胆碱能通路方面的白质损害更具优势,而且可以更好地评估MCI患者WMLs与认知功能的相关性。Fazekas量表优点是与上述两种量表协同性良好,操作简单易行,也有助于缺血性卒中防治工作的开展[7]。
本研究发现,CI组的PWMHs和DWMHs评分均高于单纯TIA组,这提示2种类型的WMLs与卒中发作有关,这在之前以社区人群为研究对象的Framingham前瞻性研究中已得到证实[8]。WMLs的主要病理改变是小胶质细胞和星形胶质细胞活化、增生,少突胶质细胞减少以及弥漫性脱髓鞘和轴突损伤,皮层神经元缺失导致的Wallerian变性也参与其中[9]。WMLs的病理基础也因部位不同而有所差异,PWMHs表现为室管膜细胞破坏、胶质增生,小胶质细胞明显激活,证明炎性反应参与;点状DWMHs表现为小动脉周围间隙扩大,伴局部髓鞘减少,融合的DWMH病灶则表现为髓鞘广泛脱失,轴突和少突胶质细胞的部分丧失,伴不同程度的星形胶质细胞增生,血管密度减少、小血管迂曲,提示血管机制参与。多数临床研究[9]认为,缺血相关性WMLs早期往往见于额叶,之后可向侧脑室周围、枕叶和半卵圆中心发展,其他位置如脑桥上中部、中央区易受累,该位置的WMHs与头晕有关。本研究发现严重的DWMHs与卒中事件显著相关,所以从临床角度证实了上述病理特点。
以往研究[10]认为年龄和高血压是人群WMLs的最重要的危险因素。本研究结果提示,年龄、高血压和左室肥厚是本地区缺血性WMLs加重的独立危险因素,同时也未发现T3与缺血性WMLs的明确关系,与以往研究较一致。有研究[11]证实,WMHs存在于40%~70%50岁左右的健康人群,60~70岁的人群中80%以上有WMHs,到80~90岁则几乎可达100%;在老年常见的中枢神经系统变性病中,阿尔茨海默病(AD)中存在WMLs者占28.9%~100%,在帕金森病(PD)中存在WMLs者为30%~55%。WMLs严重程度与年龄相关,原因包括白质髓鞘磷脂绝对浓度随年龄增加而减少,老年WMLs患者的脑血管密度减低;相应区域的脑白质的责任血管逐渐出现动脉硬化、扭曲、拉伸等改变,使白质呈持续低灌注,而且PWMHs处于动脉供血区的边缘带,对低灌注更加敏感[12]。
GRUETER等[13]认为内皮功能障碍对缺血性WMLs发病极为重要,是小血管缺血的第一步。内皮功能障碍可通过减少血流量和损害血管自动调节能力而导致组织损害。长期高血压引起颅内深穿支动脉管壁增厚、管腔狭窄,脑循环自动调节机制受损,血压波动影响血流灌注。穿通支起始处或近端的微动脉瘤可导致腔隙性梗死,而弥漫性穿通支病变会导致多发性腔隙性梗死和WMLs。同时高血压可导致血管内皮破坏、血脑屏障通透性变化及静脉回流受损,血管源性毒素和脑水肿可损害轴索细胞,导致脑白质髓鞘脱失。慢性脑供血不足(CCCI)是1991年日本第16次脑卒中学会首次提出的诊断,与之相关的概念还有慢性脑低灌注、慢性脑缺血、脑动脉硬化症等。CCCI是一个慢性的、进行性的过程,是脑灌注不足以满足正常脑代谢需求,但尚未造成梗死灶的状态。正常生理状态下成人每100 g脑组织血流量约为50 mL·min-1;当脑血流量≤20 mL时,缺血所致的级联反应开始被激活,出现不可逆性脑梗死。每100 g脑组织血流量在50~20 mL·min-1范围内,一般不出现梗死,但可出现神经细胞功能障碍,为低灌注状态。LVH常由高血压病所致,同时又在心血管病的发病及死亡中发挥重要作用。LVH导致的脑血流动力学改变使脑白质细胞低灌注,造成慢性脑白质缺血、缺氧,最终发生脱髓鞘改变[10]。
本研究未证明超声诊断的IIMT是缺血性WMLs加重的独立危险因素,可能是由于颅内动脉狭窄与WMLs有更为直接的关系,Willis动脉环对颅内的血流代偿作用,从而部分缓解了颈动脉狭窄对脑白质供血的影响。CHUANG等[14]的研究显示,Willis环异常可导致颈动脉粥样硬化患者出现白质疏松,而颈动脉支架置入术可使患者WMLs程度也随之减轻。所以如果结合颅内动脉MRA进行评估,可能会得到更为直接的提示,而且还应涵盖对血管弹性和顺应性的评估。此外SABA等[15]对90例60岁以上的患者应用多排CT扫描显示,颈动脉壁厚度(CAWT)与LA之间预后相关性。以0.9 mm为阈值,CAWT增厚与LA之间存在显著相关性。任何研究都可能存在测量偏倚,所以研究结论可能也与筛查工具或诊断标准有关。
上述研究因素中,性别、吸烟、卒中史、糖尿病和高血脂已被证实是心脑血管疾病的传统危险因素,但在本研究中上述因素与缺血性WMLs的直接关系未得到证实。但是既往研究[16]认为糖尿病患者WMLs进展速度往往较快,病程较长的糖尿病患者WMLs也较明显;而且HbA1C提示近2~3个月糖代谢水平,所以难以有效反映脑白质在高血糖环境中的累积暴露时间,同时此研究也无法排除患者近期应用降糖药物对糖化血红蛋白的影响。所以尽管本研究在设计时结合文献对WMLs的危险因素进行了初步筛选,但作为病例对照研究,难免存在不可控因素。因此期待更确切的量化标准,在队列研究中进一步探讨各种危险因素与缺血性WMLs的关系。

