水稻中2个小分子热激蛋白基因启动子的序列分析及功能鉴定
郭虹霞,王创云,赵 丽,王陆军,张丽光,邓 妍
(山西省农业科学院 作物科学研究所,太原 030031)
水稻作为最主要的粮食作物之一,世界约50%的人口以稻米为主要粮食,为人类的粮食安全作出了巨大贡献。水稻的生长在一定程度上受到各种逆境胁迫的影响,温度是影响水稻生长发育最主要的气候因子,研究表明,适温以上,气温每升高1℃,水稻的产量会减少10%[1]。全球气温的持续升高,严重制约着水稻的生产,当前亟需深入水稻耐热的分子机制研究,确保水稻生产的可持续发展。
热激蛋白(heat shock proteins,HSPs)是指生物遭受逆境胁迫时(如高温)体内新合成或含量增加的一类具有分子伴侣活性的蛋白质[2]。根据分子质量的大小,热激蛋白可分为HSP100、HSP90、HSP70、HSP60和sHSP(small heat shock proteins)[3-4]5个家族,小分子热激蛋白(sHSPs)是最重要的一类分子伴侣,其分子质量一般为15~50ku,不同于其他大部分热激蛋白家族成员间的高度保守, sHSPs基因间的氨基酸序列相似性不足25%,在其二级结构中含有一个80~100个氨基酸组成的保守的ACD(α-晶体蛋白结构域)结构域。sHSPs在植物热激蛋白中含量最为丰富[5],与植物耐热性关系密切[3]。正常生长条件下,大多数sHSP在植物组织中不积累,而在热激或其他胁迫的诱导下,sHSP 的含量急速增加[6],有的甚至可提高200倍以上;有些sHSP在植物生长发育的特定时期如胚胎发生、花粉粒发育、种子萌发、种子及果实成熟等过程中表达[7-8]。研究表明,高温胁迫下,sHSP能自发形成大小为200~300ku的同源寡聚体,并与其他分子伴侣相互作用,帮助受损蛋白重新折叠。除了在耐热胁迫方面的重要作用外,sHSPs对冷、旱、盐等胁迫的防御也具有重要作用[9]。研究表明,超表达水稻Hsp17.7基因,可以提高水稻的耐热性和抗旱性[10-11],过量表达叶绿体sHSPs[12-13]和ER-sHSPs[14]能提高番茄的抗寒性。此外,sHSPs还有抑制细胞凋谢、促进细胞骨架形成,及保护电子传递链(线粒体sHSP)和光系统Ⅱ的电子传递(叶绿体sHSP)等作用[15]。
前期研究表明,在水稻幼穗分生组织进行枝梗原基分化和花器官原基分化初期有种类丰富的热激蛋白基因及其共分子伴侣和热激转录因子高水平特异表达。其中2个基因是位于1号染色体编码sHSP的基因Os01g0136200和Os01g 0136100(分别命名为Os16.9A和Os16.9B),Os16.9A和Os16.9B大小相同,结构相似,都不含内含子。
本试验对Os16.9A和Os16.9B的启动子进行生物信息学分析,并利用过量表达和Cas9基因编辑技术研究Os16.9A和Os16.9B与水稻耐热性的关系,为深入研究Os16.9A和Os16.9B的功能奠定了基础,对深入了解热激蛋白参与植物正常生长发育及防御胁迫应答的分子机理具有重要意义。
1 材料与方法
1.1 试验材料与试剂
供试植物材料为粳稻品种‘中花11’,大肠杆菌菌株DH10B为山西省农业科学院作物科学研究所实验室保存;植物超表达载体pBWA(V)KS-ccDB和基因编辑载体pBWA(V)H_cas9i2- 01g04380由武汉伯远生物科技有限公司提供;限制性内切酶、DNA Ligation Kit Ver.2购自Takara公司;凝胶回收试剂盒购自东盛生物公司;PCR引物由上海生工生物工程有限公司合成;DNA测序由上海英骏生物技术公司完成。
1.2 生物信息学分析
在http://www.ncbi.nlm.nih.gov/网站上,利用tBLASTN软件对Os16.9A、Os16.9B基因进行同源性分析,通过DNAStar、MEGA6软件构建Os16.9A、Os16.9B及其同源蛋白的系统进化树。
1.3 基因克隆及载体构建
1.3.1 过表达载体构建 以水稻叶片cDNA为模板总RNA。根据Os16.9A、Os16.9B序列设计引物(表1),按照如下反应体系(引物1:0.2 μmol/L ,引物2:0.2 μmol/L,dNTP:200 μmol/L,10×Buffer:2 μL,Taq:1U,cDNA:4 ng,ddH2O:补齐50 μL)扩增(98 ℃预变性10 min;98 ℃变性30 s,58 ℃退火30 s,72 ℃延伸 30 s,32个循环;72 ℃延伸15 min,14 ℃10 min)目的片段,切胶、回收。将用凝胶纯化试剂盒回收的 PCR 产物与空载体pBWA(V)KS-ccDB连接,转化获得重组质粒后,进行菌液 PCR,选PCR 扩增结果为阳性的菌液进行测序。重组载体见图1。
1.3.2 基因编辑载体构建 根据Os16.9A、Os16.9B全长cds及基因组序列,在尽量靠近cds 5′端选定4个靶标,设计引物(表1),将靶标构建至中间载体,PCR反应条件为,95 ℃变性10 min,55 ℃退火10 min然后利用EcoR31Ⅰ限制性内切酶切割中间载体并进行多片段的组装,获得最终载体(图2),由于Os16.9A、Os16.9B序列的高度同源性,2个基因共用一个载体。
2 结果与分析
2.1 Os16.9A和 Os16.9B的同源性分析
通过http://www.ncbi.nlm.nih.gov/ 和http://rgp.dna.affrc.go.jp/E/ 网站分析发现Os16.9A和Os16.9B均位于水稻1号染色体PAC克隆P0443D08上,大小相同,转录方向相反(图3),且都含有共同的Alpha-crystallin结构(图4),将克隆的Os16.9A和Os16.9B所编码的150个氨基酸进行比对发现,仅存在一个氨基酸的差异(图5),相似性高达到99%,软件分析预测显示Os16.9A和Os16.9B蛋白主要定位于细胞质和线粒体基质中。

表1 引物序列Table 1 Primer sequences
注:1-4表示构建超表达载体引物,5-12表示构建基因编辑载体引物;下划线为酶切位点。
Note:1-4 Primers for over-expression vectors,5-12 primers for gene editing vectors;the underline marked the digestion site.

图1 过表达载体图谱Fig.1 Overexpression vector map
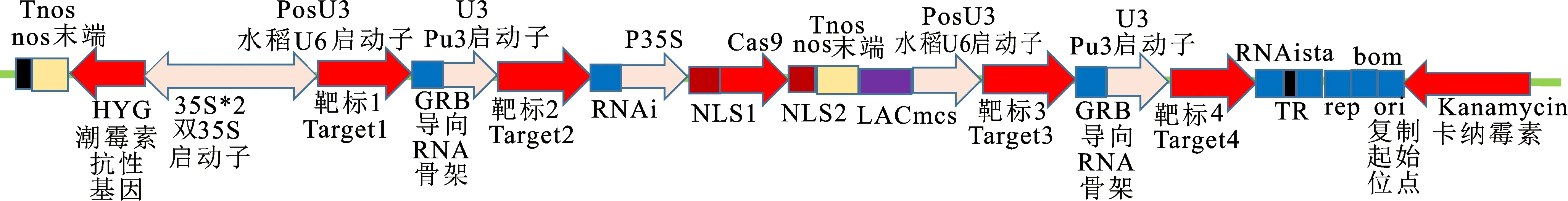
图2 基因编辑载体图谱Fig.2 Gene editing vector map
2.2 系统进化关系分析
利用网站http://www.ncbi.nlm.nih.gov/对Os16.9A和Os16.9B的氨基酸序列进行比对分析,结果显示在水稻中与这2个基因的氨基酸相似性达50%以上的基因有8个,这些基因主要分布在1号染色体和3号染色体上,很可能是通过祖先基因的多次复制产生的。通过DNAStar、MEGA6软件构建出系统进化树(图6),这些蛋白可分为7个亚枝,Os16.9A和Os16.9B在同一分枝上,且Os16.9A、Os16.9B与Os01g0136000处于同一亚枝,表明Os16.9A、Os16.9B与Os01g0136000蛋白的亲缘关系较近,而与其余蛋白亲缘关系较远。
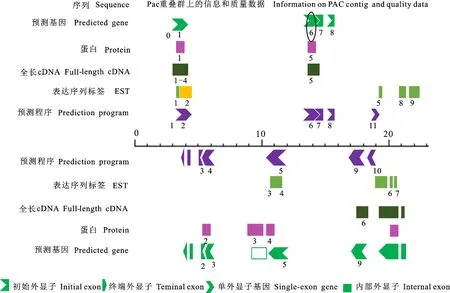
图3 目的基因在PAC克隆上的位置Fig.3 The location of target genes on PAC clones

a. Os16.9A;b. Os16.9B;c.Alpha-crystallin结构域 Alpha-crystallin domain

图5 Os16.9A、 Os16.9B基因的氨基酸序列比较Fig.5 Amino acid sequences comparison of Os16.9A and Os16.9B
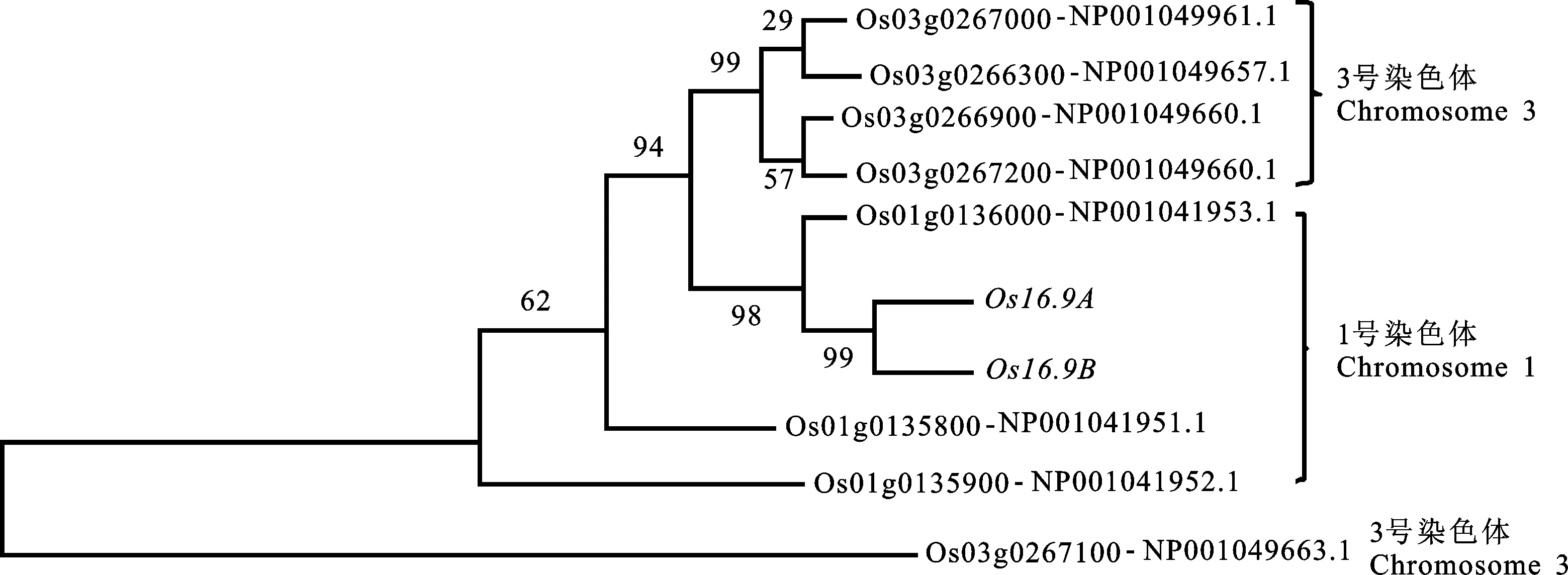
图6 水稻中 Os16.9A、 Os16.9B氨基酸水平同源基因进化树Fig.6 The phylogenetic tree of Os16.9A and Os16.9B proteins from rice
2.3 启动子序列分析
对2个基因起始密码子间2 590 bp的序列正反向进行了启动子元件分析(http://www.dna.affrc.go.jp/PLACE/signalscan.html),发现其中不对称分布了多种顺式作用元件(图7,表2),其中HSE、ACGT aterd1、NTBBF1arrolb、GATA-box、CAAT-box、TATA-box在Os16.9A和Os16.9B启动子区都存在,但是相对起始密码子所在的位置有差别,而且Os16.9A和Os16.9B的TATA-box的具体序列不同。此外,G-box、LTRE、CCAAT-box是Os16.9A启动子区所特有的,BSI是Os16.9B启动子区所特有的。推测Os16.9A和Os16.9B可能在热激等环境胁迫下及植物生长的特定时期表达,2个基因启动子可能共用起始密码子之间2 590 bp的序列或者这段序列可能具有双向启动子功能。

红色标注Os16.9B的启动子元件 The red is the promoter element ofOs16 .9B;绿色标注Os16.9A的启动子元件 The green is the promoter element ofOs16 .9A;两基因转录方向相反 The two genes are transcribed in the opposite direction
图7Os16.9A、Os16.9B基因起始密码子间的序列及其包含的启动子元件
Fig.7 The sequence between the initiating codons of theOs16.9AandOs16.9Bgenes and the promoter elements

表2 Os16.9A、 Os16.9B启动子元件序列及功能Table 2 The sequences and function of Os16.9A and Os16.9B promoter elements
2.4 转基因植株的耐热分析
为了研究Os16.9A和Os16.9B与水稻耐热性的关系,本研究通过遗传转化获得了Os16.9A和Os16.9B的过量表达及基因编辑转化植株。同时将在同样生长条件下的4叶期野生型‘中花11’、过量表达转基因植株和基因编辑转基因植株进行耐热处理,比较它们的耐热性是否存在差异。在42 ℃高温处理2 h后,于正常生长环境下恢复生长3~5 d后观察植株的生长情况,结果发现过表达转基因植株的生长状况好于野生型‘中花11’,而基因编辑转基因植株则出现比较明显的萎蔫,枯黄现象,生长状况比野生型‘中花11’差 (图8)。
热处理前后,分别提取过表达、基因编辑及野生型‘中花11’植株叶片RNA,利用RT-PCR的方法检测Os16.9A表达情况,结果表明,在正常生长条件下,过表达转基因植株中表达量较对照‘中花11’高,而编辑转基因植株中基本没有表达;42 ℃热激2 h后,‘中花11’和过表达转基因植株表达量有所增加(图9)。

a-c. 未处理的植株 Untreated plants; d-f. 42 ℃热激处理2 h,恢复正常生长5 d后的植株 Plants treated at 42 ℃ for 2 h,then grow under normal growth conditions for 5 days; a、d . 过表达Os16.9B转基因植株 Transgenic plants overexpressingOs16.9B; b、e .‘中花11’对照 ‘ZH11’ controls; c、f .Os16.9B基因编辑转基因植株 Transgenic plants ofOs16.9Bgene deiting
图8 苗期热激处理
Fig.8 Heatshock treatment of rice seedling
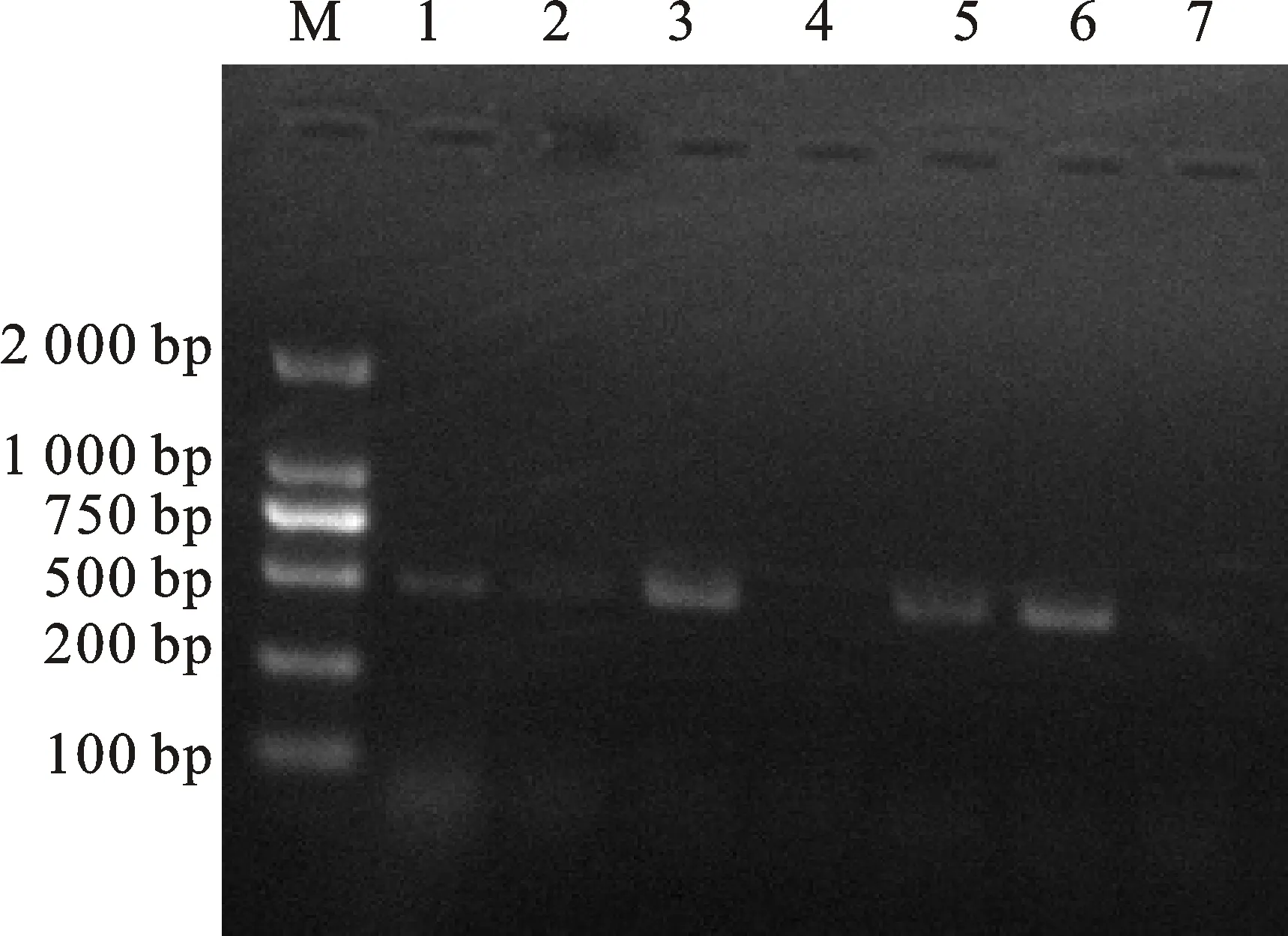
M.DNA分子质量标准DL2000 DL2000 marker; 1-4.未热激植株的RT-PCR结果 Result of the untreated plants ; 5-7. 42 ℃热激2 h植株RT-PCR结果 Result of the plants treated at 42 ℃ for 2 hours; 1、2、5. ‘中花11’ ‘ZH11’; 3、6.Transgenic plants overexpressingOs16.9B;4、7.Os16.9B基因编辑转基因植株 Transgenic plants ofOs16.9Bgene deiting
图9 转基因植株的RT-PCR结果
Fig.9 RT-PCR result of transgenic plants
3 讨 论
水稻是世界上重要的粮食作物,高温胁迫可严重影响水稻的育性和品质,因此需要对水稻耐热的分子机制进行研究,确保水稻生产的可持续发展。
高等植物复杂的表达调控中,转录水平的调控发挥着重要作用。启动子作为重要的调控开关,对其结构及功能的研究具有重要作用。Os16.9A和Os16.9B都编码小分子热激蛋白(sHSPs),通过序列比对分析,发现Os16.9A和Os16.9B是位于水稻1号染色体PAC克隆P0443D08上的2个基因,它们的编码框大小相同, 都不含有内含子。Os16.9A和Os16.9B之间仅存在1个氨基酸差异,氨基酸序列的相似性高达到99%,且都存在Alpha-crystallin结构,但是编码框外的序列,如5′UTR和3′UTR则完全不同。
本研究对Os16.9A和Os16.9B起始密码子间2 590 bp的序列分析,发现多种顺式作用元件在2个基因启动子区的分布是不对称的,且大多与胁迫诱导和组织特异性表达有关。因此,推测这2个基因间的序列可能具有双向启动子的功能,且这2个基因可能在热激等胁迫条件下及植物生长的特定时期表达。利用GUS报告融合系统对2个基因表达特性的研究结果[16]表明热激会诱导这2个基因的大量表达,而在正常生长条件下,Os16.9A和Os16.9B在根、茎、幼穗的维管组织中表达,两者的表达模式无论是在胁迫环境下还是正常发育过程中都基本相似,验证了本试验对于这2个基因间的序列可能具有双向启动子的功能,且这2个基因可能在热激等胁迫条件下及植物生长的特定时期表达的推测。对转基因植株的热激处理发现,过表达Os16.9A和Os16.9B能够提高水稻对高温胁迫的耐受能力。
4 结 论
Os16.9A和Os16.9B起始密码子之间2 590 bp的序列作为双向启动子驱动这2个基因反向转录,Os16.9A和Os16.9B的表达模式相似,在正常生长条件下,对于根、茎、幼穗的维管组织等分化和发育有关,且在热激等环境胁迫时,能够提高水稻对高温等胁迫的耐受能力。

