“乳黄消散”对临床型奶牛乳房炎治疗效果
张 行,李新圃,杨 峰,王旭荣,罗金印,白东东,李宏胜
(中国农业科学院 兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,兰州 730050)
奶牛乳房炎是奶牛养殖业中最常见的一种疾病,是奶牛乳房受到病原菌侵袭或机械损伤而引起的奶牛乳腺组织炎症。在奶牛养殖业中,奶牛乳房炎是花费成本最高的一类疾病,给奶牛养殖业带来巨大的直接和间接经济损失。直接经济损失包括治疗成本、患乳的废弃、治疗后乳房炎复发所需的周期性非产奶时间等,间接经济损失包括产奶量下降、乳品质量降低、干奶期提前和淘汰率增加等。引起奶牛乳房炎的病原菌可分为传染性致病菌和环境型致病菌,其中传染性致病菌主要以金黄色葡萄球菌和链球菌为主,环境型致病菌与奶牛的栖息环境密切相关,较常见的是大肠杆菌和克雷伯氏菌属[1]。长期以来,国内外对奶牛乳房炎的防治主要以抗生素治疗为主[2-4]。但由此造成的严重后果也愈加突出,除了较高的治疗成本外,由于长期过量使用、滥用抗生素导致的细菌耐药性甚至多重耐药细菌的出现,以及乳汁中抗生素残留等问题也日益严重,严重制约奶牛业的健康发展,也给人们的身体健康带来严重威胁[5-6],随着人们更青睐于绿色、无抗、有机奶制品,以及世界范围内对抗生素使用的要求越来越严格,抗生素在临床中的应用越来越受限制[7]。此外,生物被膜的产生更增强了细菌对抗生素的耐药性[8]。中药为纯天然植物,含有多种生物活性成分,具有抗菌、消炎、不易产生耐药性、低或无残留等特点,另外,有些中药成分还具有增强机体免疫力、提高动物生产性能等辅助功效。因此,应用中药治疗奶牛乳房炎已成为国内外学者研究的焦点,具有广阔的市场前景[9-14]。
1 材料与方法
1.1 试验用药物
“乳黄消散”规格为每袋500 g,由中国农业科学院兰州畜牧与兽药研究所中兽医研究室生产,主要由丹参、远志、连翘、地肤子等10味药材组成。对照药物为市售“公英散”,规格为每袋 500 g,主要由蒲公英、金银花、连翘、芙蓉叶等组成,批准文号为兽药字(2012)031045028,河北宝典药业有限公司生产,批号为20170701。
1.2 主要试剂及器材
营养肉汤、血平板均购自广东环凯微生物科技有限公司,Bacterial DNA Kit购自OMEGA公司,16S rDNA Bacterial Identification PCR Kit购自TaKaRa公司,SEDI PCR仪购自威泰克公司,隔水式恒温培养箱购自上海一恒科学仪器有限公司。兰州隐性乳腺炎诊断液(LMT) 由中国农业科学院中兽医研究所药厂生产,批号为20160808。诊断及检测判定标准参照产品说明书及文献[15]进行,将待测乳汁挤入诊断盘中,将诊断盘倾斜大约 60°,弃去多余乳样,使检验杯中乳样约为 2 mL,加入2 mL LMT诊断液,水平同心圆旋转摇动诊断盘 5~30 s,60 s 内判断结果,分为“-”(阴性),“+”(可疑),“+”(弱阳性),“++”(阳性),“+++”(强阳性)。
1.3 试验动物分组及乳样采集
将甘肃省某奶牛场40头患临床型乳房炎的泌乳牛随机分成4组(表1),分别为高、中、低剂量 “乳黄消散”处理组和1个“公英散”对照组。采样前,先用温水清洗乳头,再用体积分数为75%的酒精棉球擦拭乳头与挤奶者手指,弃去前3把奶样,用灭菌试管接取2~5 mL左右的奶样,拧紧瓶塞,注明采样的时间、牛号、乳区,并及时 送检。
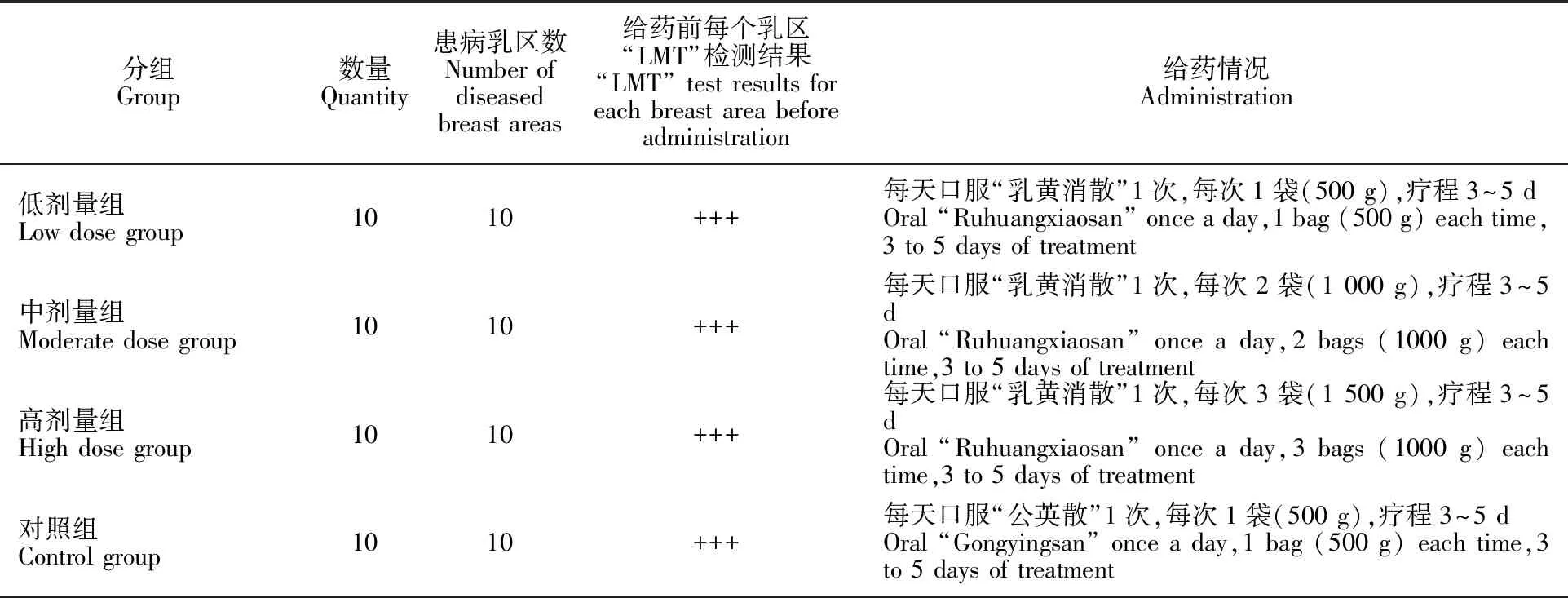
表1 试验奶牛分组及给药情况Table 1 Test grouping and administration of dairy cows
1.4 细菌的分离与鉴定
将治疗前后采集的奶样摇匀后,每份样品用接种针无菌挑取2~3铂耳圈划线于血琼脂平板,同时吸取该奶样20 μL接种于2 mL营养肉汤管中,用以增菌培养,均于37 ℃恒温培养箱中培养18~20 h,取出血琼脂平板后挑取可疑单菌落接种于营养肉汤管中,进行纯化培养,对于血平板上未长菌者,继续培养至48 h,并取其增菌肉汤再划血平板培养,培养48 h后仍未长菌的,即可认为无细菌生长。
将纯化的单菌落肉汤培养液涂片进行革兰氏染色,镜检纯粹后,根据菌体颜色,结合菌落形态、特性,将分离纯化的细菌分为链球菌、葡萄球菌、肠杆菌、革兰氏阳性杆菌等,并提取细菌基因组DNA,PCR扩增16S rRNA基因并测序,在NCBI上在线比对16S rRNA基因序列,确定病原菌种类。
1.5 治疗方法
首先将待治疗奶牛用牛鼻钳固定,将“乳黄消散”和“公英散”分别用温开水冲调混匀,待温度降至40 ℃左右时,用灌胃瓶缓慢灌服,每天灌服1次,连续用药3~5 d。其中“乳黄消散”低剂量组每次灌服1袋,中剂量组每次灌服2袋,高剂量每次灌服3袋;对照药物“公英散”每次灌服1袋,治疗结束后观察治疗效果、LMT检测情况及乳汁细菌检测情况。
1.6 疗效评价
治疗后,患牛乳房红肿、硬结、热感消失,奶样外观、采食量、奶产量和精神恢复正常,为痊愈;乳房红肿、硬结和热胀感明显减轻,乳汁水样或絮状沉淀减少或消失,奶产量有所增加,为有效;乳房临床症状未改善或情况恶化,放弃本中药治疗而用其他方法治疗,为无效。
1.7 数据分析
试验数据用SPSS 25.0单因素 ANOVA 处理,分析不同剂量组之间治疗效果的差异显 著性。
2 结果与分析
2.1 临床治疗效果
由表2可知,对照组的治愈率极显著低于试验组的治愈率(P<0.01),低剂量组的治愈率极显著低于中剂量和高剂量组(P<0.01),中剂量组的治愈率极显著高于高剂量组(P<0.01);对照组的总有效率极显著低于3个试验组,低剂量组的总有效率极显著低于中剂量组和高剂量组(P<0.01),中剂量组的总有效率极显著高于高剂量组(P<0.01)。
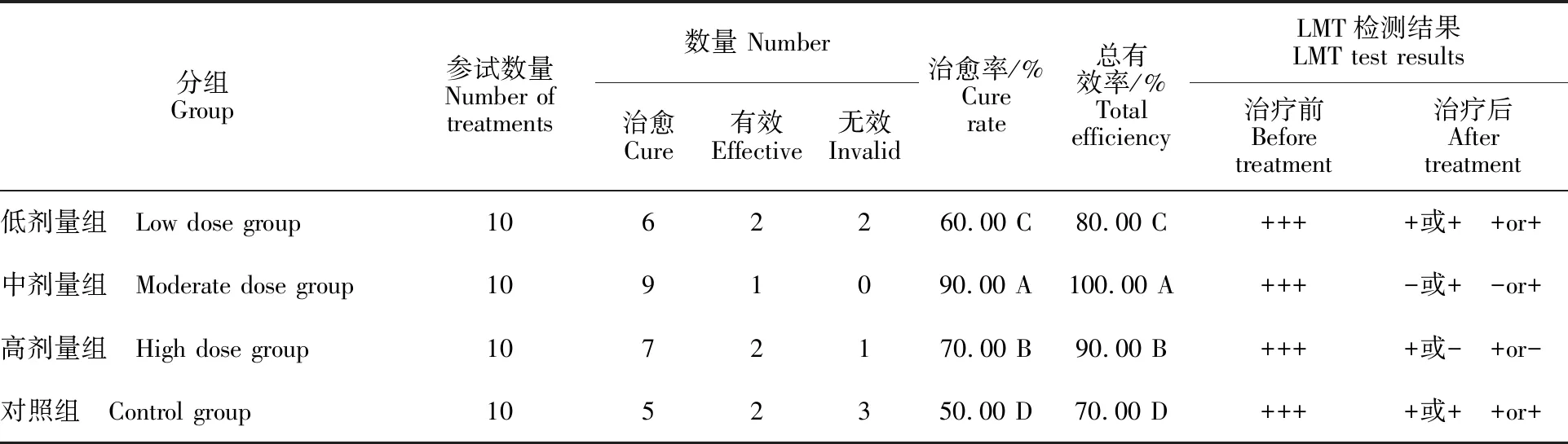
表2 “乳黄消散”与“公英散”治疗临床型奶牛乳房炎临床效果统计Table 2 Statistics on the clinical effects of “Ruhuangxiaosan” and “Gongyingsan” in the treatment of clinical bovine mastitis
注:用Duncan氏法进行多重比较,同列标注不同大写字母表示组间差异极显著(P<0.01);-.阴性,+.可疑,+.弱阳性,++.阳性, +++.强阳性。
Note:Multiple comparisons were performed using the Duncan’s method.Different capital letters in the same column indicate that the differences between the groups are extremely significant (P<0.01); -.Negative,+.Suspicious,+.Weak positive,++.Positive, +++.Strong positive.
2.2 “乳黄消散”与“公英散”治疗前后奶样中的细菌变化情况
治疗前后乳汁细菌检测结果显示(表3),治疗前采集的40个乳区样品中有35个样品检出细菌,细菌检出率为87.50%,主要为大肠杆菌、无乳链球菌、屎肠球菌和乳房链球菌等。治疗结束后3~5 d同一乳区检菌结果显示,试验组的细菌总转阴率达66.67%~100.00%,细菌转阴率为马胃葡萄球菌、乳房链球菌和巨型球菌最高 (100.00%),其次是无乳链球菌(83.33%)和大肠杆菌(80.00%),屎肠球菌转阴率最低(66.67%),对照“公英散”组的细菌总转阴率达50.00%~ 100.00%。
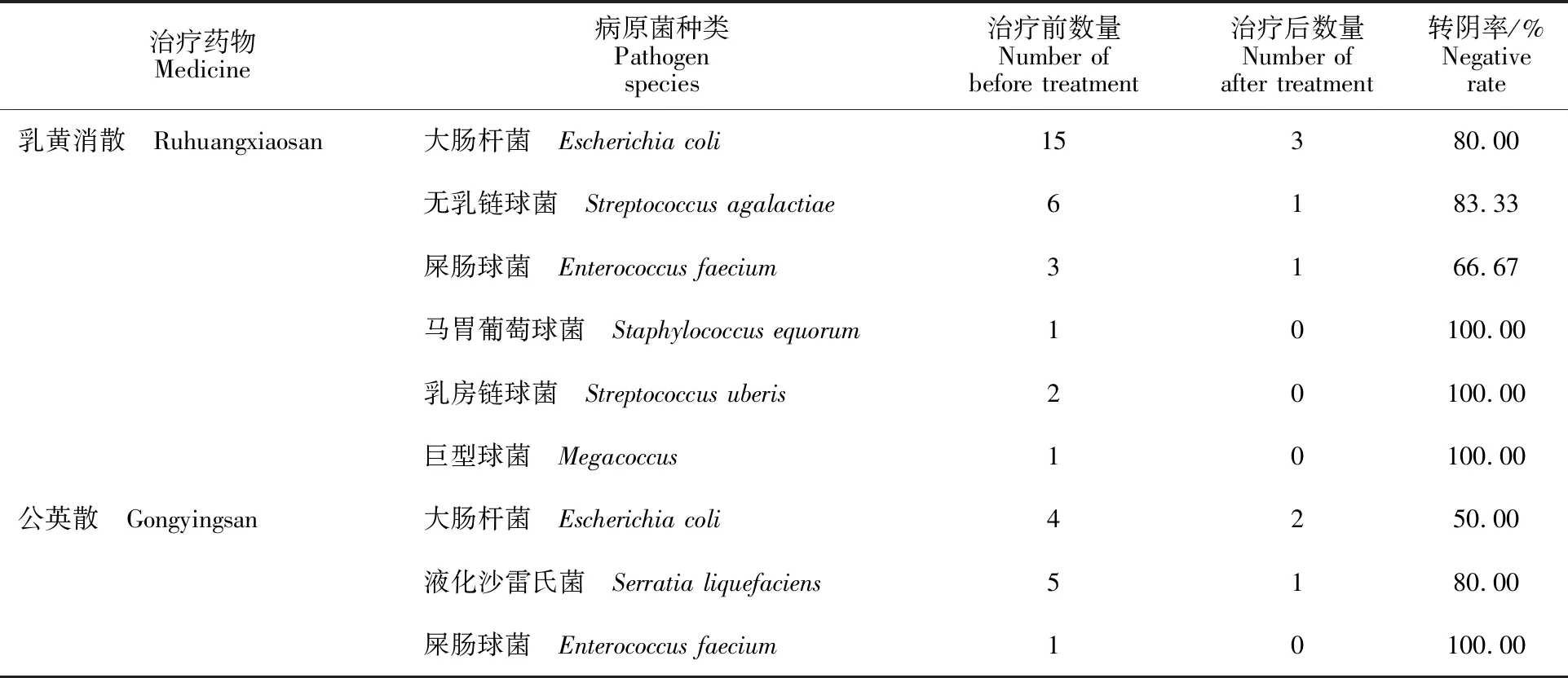
表3 治疗前后奶样中细菌变化情况Table 3 Changes of bacterial in milk samples before and after treatment of dairy cows with clinical mastitis
3 讨 论
目前,对于奶牛乳房炎的治疗主要还是以抗生素为主。由于抗生素的滥用,造成乳汁中药物残留及耐药菌株增多,使乳房炎的治疗效果下降。因此,用中药治疗奶牛乳房炎成为国内外学者研究的方向[13-14,16]。在中兽医学研究中,奶牛乳房炎又被称为乳痈,中兽医解释为“无血则乳无以生,无气则乳无以化”,是因外部邪毒侵入乳房与积乳互结,造成乳腺乳络不畅,导致动物机体阴阳失衡而引起。临床上主要症状表现为乳房红肿、硬结、乳汁水样变性或血乳,患牛精神萎靡、体温升高、奶产量及采食量减少。为此,中兽医以清热解毒、活血通乳、抗菌消炎及消肿祛痛为治疗原则,通过调理并改善动物机体的各种生理功能达到有效治疗奶牛乳房炎的目的。本研究结果显示,“乳黄消散”低剂量组治愈率60.00%,总有效率80.00%,平均治疗时间3.7 d,治疗后乳汁LMT检测由“+++”转为“+或+”;中剂量组治愈率90.00%,总有效率100.00%,平均治疗时间3.2 d,治疗后乳汁LMT检测由“+++”转为“-或+”;高剂量组治愈率70.00%,总有效率90.00%,平均治疗时间为3.6 d,治疗后乳汁LMT检测由“+++”转为“+或-”;“公英散”治愈率50.00%,总有效率70.00%,平均治疗时间4.1 d,治疗后乳汁LMT检测由“+++”转为“+或+”。 “乳黄消散”高、中、低3个剂量组治愈率与总有效率均极显著高于对照“公英散”组 (P<0.01),而“乳黄消散”中剂量组治愈率及总有效率极显著高于高剂量组和低剂量组 (P<0.01),表明“乳黄消散”中剂量是治疗临床型奶牛乳房炎的最佳剂量。本次试验“乳黄消散”高和低2个剂量组的临床治愈率与郭蕾等[17]、张玲等[18]、王学红等[19]和董奎龙等[20]的结果基本一致,但中剂量组的临床治愈率较高,分析原因可能与用药量偏大及收治病例较少有关,需进一步扩大临床试验加以验证。本研究还发现,临床治愈率的高低与平均治疗时间及LMT检测的严重程度存在显著的相关性,即治愈率越高,平均治疗时间越短,乳汁LMT检测严重程度越低。治疗前后乳汁细菌检测结果显示,治疗前采集的40个乳区样品有35个样品检出细菌,细菌检出率为87.50%。治疗结束后3~5 d同一乳区检菌结果显示,“乳黄消散”3个剂量组的细菌总转阴率达66.67%~ 100.00%。对照“公英散”组的细菌总转阴率达50.00%~100.00%。细菌转阴率按照高低排列主要为马胃葡萄球菌、乳房链球菌和巨型球菌最高(100.00%),其次是无乳链球菌 (83.33%)和大肠杆菌(80.00%),屎肠球菌转阴率最低 (66.67%)。目前,国内外学者对于药物治疗奶牛乳房炎前后进行乳汁中细菌变化情况的研究鲜有报道。对于临床型奶牛乳房炎的疗效判定标准,通常以患牛精神、食欲及奶产量基本恢复正常,乳房红、肿、热、痛及硬结消失、乳汁肉眼观察转为白色、无絮状物及沉淀等指标来判定是否治愈。然而,单从肉眼观察临床症状消失即判定为临床治愈,会造成有些泌乳牛乳房炎复发,这可能与乳汁中细菌没有完全转阴有一定关系[10]。另外,有研究表明,乳汁体细胞数与奶牛乳房炎的发生呈正相关,可以作为评判奶牛乳房感染程度的重要指标[21]。因此,对于临床型奶牛乳房炎疗效的判定,除观察临床症状,还应结合细菌学及乳汁体细胞检测,这样才更加合理全面。本次“乳黄消散”临床试验表明,中剂量治疗奶牛乳房炎效果最好,但由于每次口服1 000 g,可能造成治疗成本偏高。因此,今后在保证疗效的基础上,如何降低成本可能是中兽药治疗奶牛乳房炎亟需解决的问题。未来中兽药的推广与应用,可大大减少抗生素在治疗奶牛乳房炎上的使用,降低细菌耐药性的产生与乳汁中抗生素残留等问题。中兽药现代化的发展,为奶牛乳房炎提供一种新的治疗途径,具有非常可观的开发应用前景。

