人羊膜间充质干细胞膜片的构建及其成软骨诱导的实验研究
尤奇 段小军 张骏 金瑛 彭旭 刘毅
1 遵义医学院附属医院关节外科(贵州遵义563000)
2 陆军军医大学西南医院关节外科(重庆400038)
关节软骨是一种没有血管、神经、淋巴系统的结缔组织。关节软骨一旦损伤很难依靠自身完全修复,而关节软骨损伤后若未能及时有效处理,后期可能导致严重后遗症[1]。目前软骨缺损的修复方法很多,包括微骨折术[2]、骨软骨移植术[3]、软骨细胞移植术[4]以及无细胞支架材料[5-6]等,但由于以上每种方法均有其自身的局限性,尚不能满足临床需求。随着软骨组织工程的发展,研究者们积极地寻找能够修复损伤软骨组织的种子细胞和支架材料。近年来,人羊膜间充质干细胞(human amniotic mesenchymal stem cells,HAMSCs)的研究越来越受到研究者的重视,其取自于废弃的胎盘,来源广泛且对人体无额外伤害,也不存在伦理道德争议。有研究表明HAMSCs增殖能力要强于骨髓间充质干细胞(bone marrow derived mesenchymal stem cell,BMSCs),而且具有高丰度、高纯度、低免疫原性等特点[7-9]。1993年日本学者Okano 提出了细胞膜片技术,该技术不需要蛋白酶的消化和外源性支架材料,通过细胞外基质的分泌形成膜片组织,然后将膜片用于修复组织缺损和改善器官功能,避免了支架材料降解带来的炎症反应问题[10]。目前,HAMSCs应用于软骨损伤修复的研究还相对较少,本研究采用一种简单的方法构建HAMSCs 膜片,并研究其向成软骨方向分化的潜能以及利用HAMSCs 膜片构建组织工程软骨的可行性,以期为软骨组织工程提供新的种子细胞,同时为软骨损伤修复提供一种新思路。
1 材料与方法
1.1 主要材料、试剂及仪器
实验中所收集的7个胎盘均来自于遵义医学院附属医院产科足月产产妇,无其他基础疾病,术前均签署知情同意书,符合遵义医学院伦理委员会要求。
低糖DMEM/F12 培养基(GIBCO,美国)、高糖DMEM 培养基(GIBCO,美国),Ⅱ型胶原酶(GIBCO,美国)、胰蛋白酶(GIBCO,美国)、FBS(GIBCO 公司,美国);BFGF(PEPROTECH,美国),TGFβ3(PEPROTECH,美国),地塞米松(SIGMA,美国),维生素C(Solarbio,北京),丙酮酸钠(Solarbio,北京),胰岛素(Solarbio,北京),转铁蛋白(Solarbio,北京),兔抗人Ⅱ型胶原抗体(abcam,美国),山羊抗兔IGg(中杉金桥,北京),逆转录试剂盒、SYBRPremix EXTaptTM试剂盒(Takara,日本),番红试剂盒(Solarbio,北京),甲苯胺蓝(Sigma,美国),鼠抗人CK-19 单克隆抗体(abcam,美国),鼠抗人波形蛋白单克隆抗体(abcam,美国),山羊抗鼠FITC荧光二抗(Invitrogen,美国),CCK-8 试剂盒(Dojin-do,日本),FACS Calibur流式细胞仪(Becton Dickinson,美国),实时荧光定量PCR 仪(CFX96,BIO-RAD,美国),酶标仪(SUNRISE,TEC-CAN,奥地利),倒置相差显微镜(Nikon,日本),荧光显微镜(OLYMPUS,日本)扫描电镜(Crossbeam340,德国)。
1.2 HAMSCs提取、培养
将羊膜从胎盘上剥离,PBS 反复冲洗3 次,剪成大小约为1 mm×1 mm×1 mm 的碎片,0.25%胰蛋白酶-0.02%EDTA消化2次,PBS漂洗后,加入0.75 mg/ml Ⅱ型胶原酶,于37℃水浴震荡消化大约45 分钟,至肉眼看到只有很小的羊膜碎片为止,300目滤网过滤收集细胞滤液,以1500 rpm 离心6 分钟。弃上清,用含10%FBS 低糖DMEM-F12培养基重悬细胞,以1×105个/ml的密度种于培养瓶内,置于37℃、5%CO2及饱和湿度培养箱内培养。每3天更换1次培养基。
1.3 构建HAMSCs膜片以及成软骨诱导的HAMSCs膜片
取第3代HAMSCs,将细胞以3×105/cm2的密度种植于6孔板中,每孔加入4 ml成膜片培养基(含体积分数15%FBS,1%谷氨酰胺,1%非必需氨基酸,10 ng/ml BFGF,50 μg/ml 抗坏血酸,1%双抗液的低糖DMEMF12 培养基)培养,于37℃、5%CO2培养箱内培养,每隔两天换液1次,连续培养15天以构建HAMSCs膜片。
取第3 代HAMSCs,将细胞以3×105个/cm2的密度种植于6孔板中,每孔加入4 ml成膜片诱导培养基,培养7天后,换用成软骨诱导培养基(含10%FBS,TGF-β310 μg/ml,50 mg/ml 抗坏血酸,地塞米松10-7mol/L,1%丙酮酸钠,6.25 mg/L 胰岛素,6.25 mg/L 转铁蛋白,1%双抗液的高糖DMEM 培养基)培养,置于37℃、5%CO2饱和湿度培养箱内,每隔两天换液1次,连续培养15天以构建成软骨诱导的HAMSCs膜片。
1.4 观测指标
1.4.1 HAMSCs形态学观察
倒置相差显微镜下观察原代细胞、P1 代细胞以及传代后的第3代HAMSCs培养72小时后的细胞大体形态和生长情况。
1.4.2 HAMSCs的鉴定及纯度分析
采用流式细胞术检测HAMSCs CD34、CD11B、CD19、CD45、HLA-DR、CD44、CD73、CD90、CD105的表达情况。
1.4.3 HAMSCs波形蛋白和角蛋白19(CK-19)的检测
利用免疫荧光法检测HAMSCs 波形蛋白和CK-19的表达情况。
1.4.4 HAMSCs增殖活性检测
取融合率为85%以上的第3代HAMSCs细胞,消化并制成密度为1×104个/ml的细胞悬液,取100μl加入96孔板中,设置5 个副孔,5 个空白对照组孔。将96 孔板置于37℃,5%CO2的培养箱中培养24小时后,分别向5个副孔和5 个空白对照孔加入10 μl CCK-8 溶液,将培养板在培养箱内孵育4 小时,酶标仪检测波长为450 nm 处的吸光度值,每24 h 测1 次,以后连续测10天,每天记录数据并绘制增殖曲线。
1.4.5 HAMSCs膜片细胞形态学观察、扫描电镜检测以及流式细胞术检测
倒置相差显微镜下观察HAMSCs 膜片细胞形态、分布以及生长情况。②将成膜片诱导15天的HAMSCs用戊二醛固定,扫描电镜(SEM)观察膜片的结构、细胞形态以及细胞外基质的分泌。③将成膜片诱导15 天的HAMSCs 进行流式细胞术检测,观察干细胞表型分子CD44、CD73、CD90、CD105的表达情况。
1.4.6 成软骨诱导HAMSCs 膜片细胞形态学观察以及成软骨相关分子表达水平检测
①倒置相差显微镜下观察成软骨诱导HAMSCs膜片细胞的形态、分布以及生长情况。②实时荧光定量PCR 检测:对培养15 天的HAMSCs 膜片和成软骨诱导的HAMSCs 膜片进行COLⅡ、SOX9、蛋白聚糖(ACAN)mRNA表达水平的检测。用Trizol提取细胞的RNA,紫外分光光度计检测RNA 提取量,将逆转录得到的cDNA 模板进行荧光定量PCR 检测。以β-actin 为内参,通过2-△△Ct法计算目标基因相对表达量。引物在NCBI基因库中进行比对,由上海生工生物工程股份有限公司合成(表1)。

表1 基因引物序列及产物长度
1.4.7 成软骨诱导HAMSCs 膜片HE、甲苯胺蓝、番红、免疫组化检测
将成软骨诱导15 天的HAMSCs 膜片用4%多聚甲醛固定后,进行HE、甲苯胺蓝、番红以及Ⅱ型胶原免疫组化检测,观察细胞形态和细胞分布、蛋白聚糖、Ⅱ型胶原的表达。
1.5 统计学方法
采用SPSS17.0 统计软件进行数据分析,数据以均数±标准差表示,两组间比较采用独立样本t检验,检验水准α=0.05.
2 结果
2.1 HAMSCs形态学观察
原代培养的HAMSCs呈长梭形、椭圆形或多角形,贴壁生长。经1~2次传代培养后,可获得纯度较高的人羊膜间充质干细胞,第3 代HAMSCs 多呈长梭形,贴壁生长,可见旋涡状、鱼群状生长的细胞(图1)。
2.2 HAMSCs鉴定及纯度分析
取第3 代HAMSCs 进行流式细胞术检测,结果显示:干细胞特性分子CD44、CD73、CD90、CD105 高表达,表达率99%以上,CD34、CD11B、CD19、CD45、HLADR阴性表达(图2)。
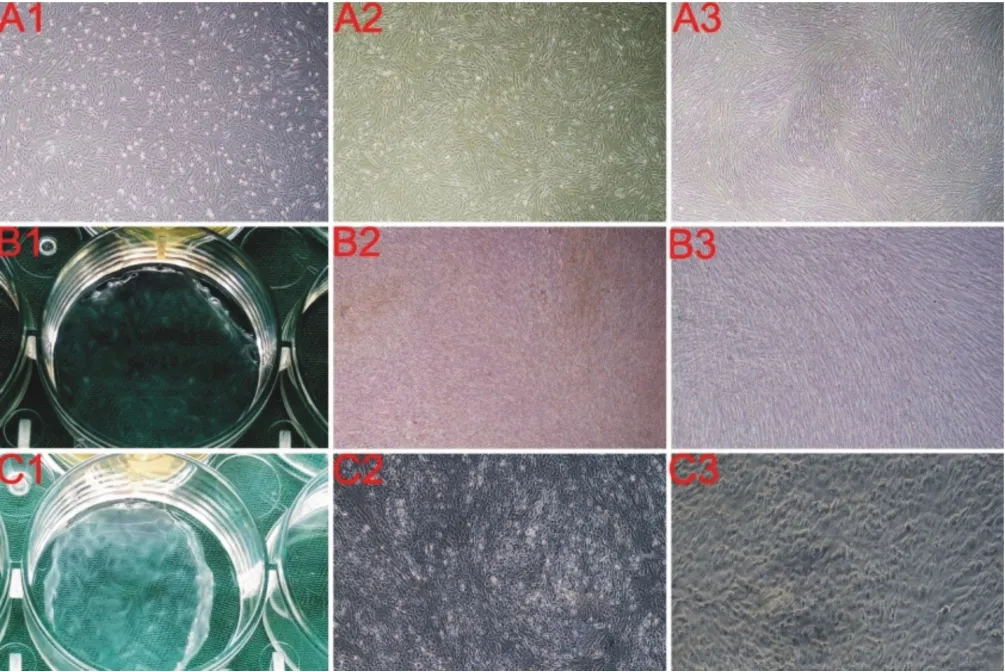
图1 HAMSCs、HAMSCs膜片、成软骨诱导HAMSCs膜片大体观察及细胞形态学观察

图2 流式细胞术检测第3代HAMSCs表型分子及纯度
2.3 HAMSCs波形蛋白和CK-19的检测
取第3 代HAMSCs 进行波形蛋白和CK-19 免疫荧光检测,结果显示:HAMSCs 高表达间充质干细胞标志物波形蛋白,不表达上皮细胞标志物CK-19(图3)。

图3 免疫荧光法检测第3代HAMSCs波形蛋白、CK-19表达(×100)
2.4 HAMSCs增殖活性检测
取第3代HAMSCs进行增殖活性检测,CCK-8检测结果显示:细胞生长呈S 型曲线,传代培养的HAMSCs第1 天增殖速度较慢,增殖能力较弱。随着时间的增加,增殖活性不断增强,接种后第3 天可达对数生长期,第7天即可以达到平台期,之后增殖速率保持较稳定(图4)。
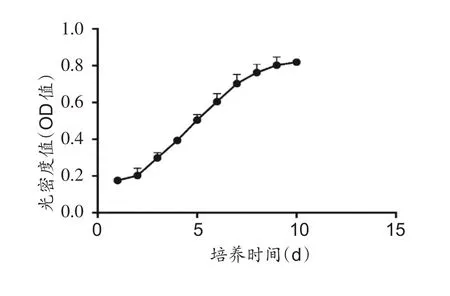
图4 第3代人羊膜间充质干细胞增殖曲线
2.5 HAMSCs膜片细胞形态学观察、SEM检测以及流式细胞术检测
HAMSCs成膜片诱导15天后,6孔板底部可见一层厚薄较为均匀的白色细胞膜片,倒置相差显微镜下观察见长梭形细胞紧密排列,分布均匀(图1B1、B2、B3)。SEM观察显示膜片呈复层结构,长梭形细胞纵横交错,细胞镶嵌于自身分泌的细胞外基质中,胞外基质相互融合(图5)。流式细胞术检测结果示:HAMSCs成膜片诱导15 天后干细胞分子CD44、CD73、CD90、CD105 仍高表达,CD34、CD11B、CD19、CD45、HLA-DR表达阴性(图6)。

图5 HAMSCs膜片扫描电镜检测
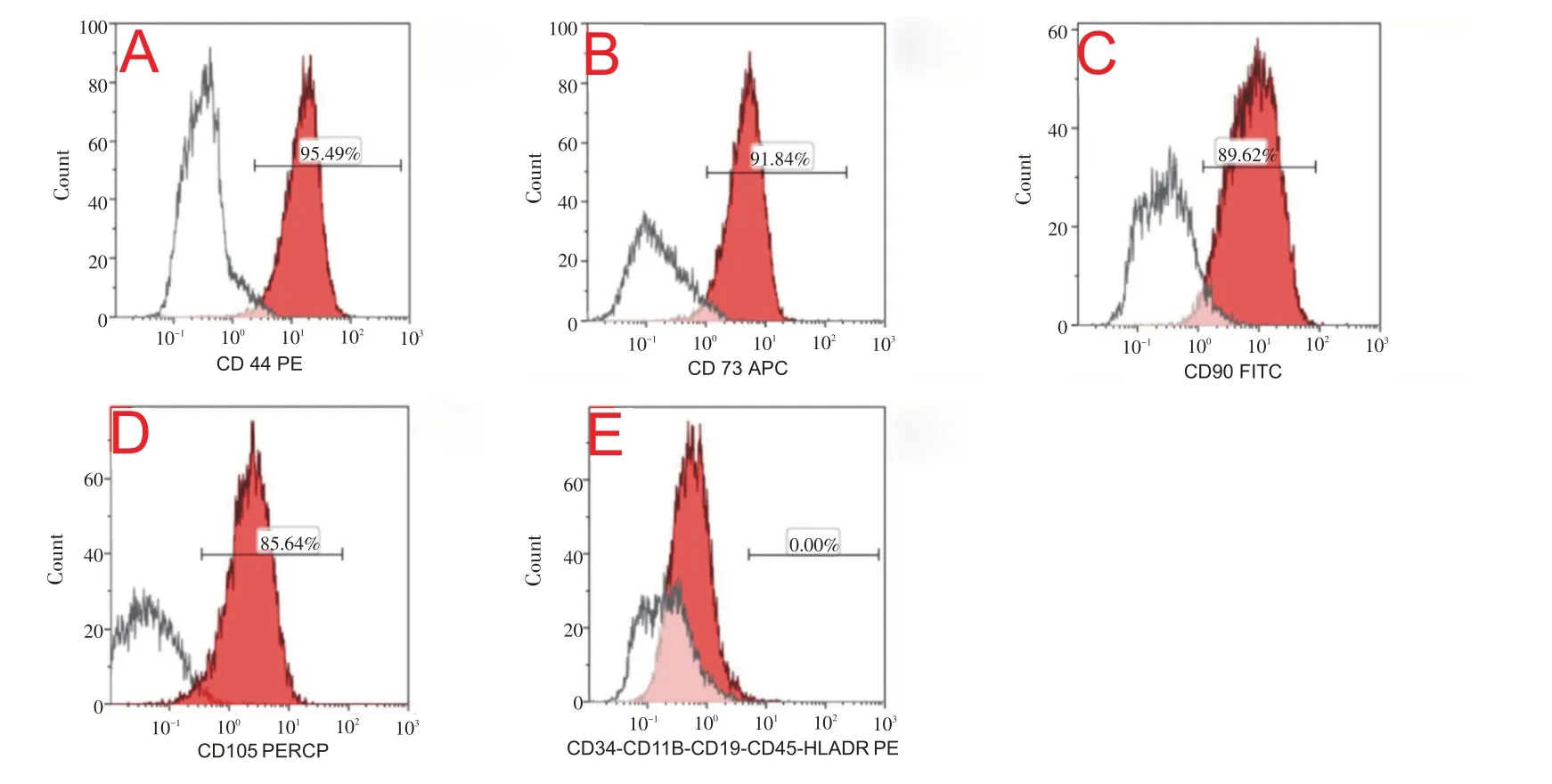
图6 流式细胞术检测HAMSCs膜片细胞表型分子的表达
2.6 成软骨诱导HAMSCs 膜片细胞形态学观察以及成软骨相关分子表达水平检测
HAMSCs膜片成软骨诱导15天,6孔板底部可见白色膜状物质形成,倒置相差显微镜下观察可见类圆形或椭圆形细胞紧密排列、分布均匀,呈“铺路石”样结构(图1C3)。RT-PCR 结果示:与HAMSCs 膜片组相比,成软骨诱导的膜片组Ⅱ型胶原、蛋白聚糖、SOX9 表达量显著增高,差异有统计学意义(P<0.05)(图7)。
2.7 成软骨诱导HAMSCs 膜片HE、甲苯胺蓝、番红、免疫组化检测
HAMSCs膜片成软骨诱导14天后,HE染色可见大量的类圆形细胞紧密排列;甲苯胺蓝染色可见细胞外基质呈均匀蓝色,细胞成铺路石样;番红染色可见细胞外基质呈均匀红色,表明细胞外基质中有大量的蛋白聚糖分泌;II 型胶原免疫组化结果显示细胞外基质呈均匀的棕黄色,表明胞外有大量II型胶原分泌(图8)。
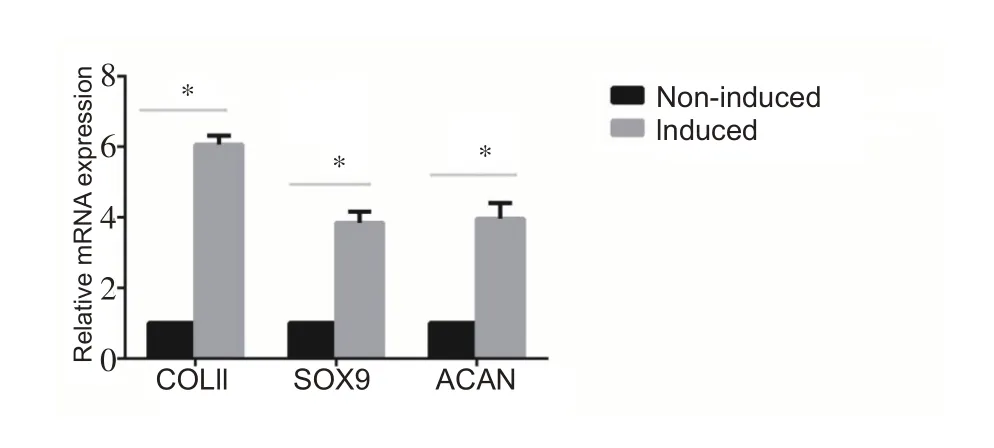
图7 HAMSCs膜片诱导后成软骨相关基因mRNA的表达

图8 成软骨诱导HAMSCs膜片HE、甲苯胺蓝、番红、免疫组化检测
3 讨论
本研究通过酶消化法获得了纯度高、活力好的HAMSCs,CCK-8 检测结果显示:HAMSCs 在培养6~7天后增殖速度达到高峰,以后保持较为稳定的增殖速度,增殖活力强。流式细胞术检测示:HAMSCs 高表达干细胞表面分子CD44、CD73、CD90、CD105,不表达CD34、CD11B、CD19、CD45、HLA-DR。免疫荧光检测示:HAMSCs 高表达间充质干细胞表面分子波形蛋白,不表达上皮细胞表面分子CK-19。CD44 为软骨细胞外基质成分透明质酸的受体,可以减轻炎症反应和促进胶原的合成[11],本研究流式细胞术结果显示HAMSCs CD44 阳性率为99.99%。Parolini 等[12]报道了HAMSCs 低表达主要组织相容性I 类抗原(HLA-A、HLA-B、HLA-C),同时也低表达共刺激分子(CD80、CD83、CD86 等)。本研究也证明HAMSCs 低表达免疫因子CD11B、CD19 及主要组织相容性II 类抗原HLADR,说明HAMSCs 具有低免疫原性,在异体移植中可能会具有免疫豁免特性。
1993年日本学者Okano 提出了细胞膜片技术,该技术利用温敏型聚合物-聚N异丙基丙烯酰胺(PolyNisopropylacrylamide,PIPAAm)对培养皿进行涂层处理,不需要用胰蛋白酶对细胞进行消化即可获得完整的细胞膜片,从而用于组织工程的构建。该聚合物涂层的培养皿至少需要30 分钟、20℃的低温条件才能获得完整膜片,然而,低温条件会导致细胞膜片的活性降低[13]。也有文献报道应用温敏培养皿制备的细胞膜片可能会影响细胞的聚合、分化[14-15]。近年来有文献报道了其他制作细胞膜片的方法,并取得了一定的效果,其中主要有电反应系统、磁反应系统、光反应系统、PH 系统。但以上方法均存在一定局限性,电反应系统涂层材料会影响细胞粘附生长[16-17],磁反应系统只能形成多层膜片的复合结构[18],光反应系统细胞膜片分离困难[19-20],PH 系统细胞容易受损,膜片难以分离[21-22]。本实验通过将HAMSCs接种在6孔板中去构建膜片,体外培养15天,可以见到在6孔板底部有白色的膜状结构,SEM观察可以见到膜片呈复层结构,细胞纵横交错、紧密排列,胞外大量基质分泌并融合,细胞镶嵌于基质中。该膜片的获取不需要特殊的材料,保留了细胞分泌的天然细胞外基质,保留了外基质中的转化生长因子β(TGF-β)、WNT 相关因子、成纤维细胞生长因子(FGF)、骨形成蛋白(BMP)等细胞因子。有研究显示:FGF 信号通路[23]、TGF-β和BMP 信号通路[24-25]、WNT 信号通路[26]的激活会促进软骨损伤的修复和细胞外基质的合成。Ye等[27]报道了间充质干细胞高密度接种培养时会导致细胞的干细胞特性降低以及加速细胞老化。本研究在诱导HAMSCs成膜片时加入了浓度为50 μg/ml 的抗坏血酸诱导细胞外基质大量产生,为细胞的大量增殖提供了充足的生长空间;在HAMSCs 成膜片诱导15天后,流式细胞术检测结果显示干细胞特性分子CD44、CD73、CD90、CD105仍高表达。
目前,细胞膜片技术广泛用于组织工程的研究,其中应用细胞膜片技术修复角膜、食道的缺损已进入临床研究阶段。2011年,日本已经批准应用细胞膜片技术修复关节软骨缺损的临床研究[28]。本实验成功构建了HAMSCs 膜片,但是获取的HAMSCs 膜片是否具有成软骨细胞分化的潜能,对于组织工程软骨的构建至关重要。本实验利用诱导培养基培养HAMSCs 膜片,培养15天后,RT-PCR结果显示:成软骨诱导的膜片组高表达成软骨相关基因,Ⅱ型胶原、蛋白聚糖、SOX9 mRNA 的表达量显著高于HAMSCs 膜片组,差异有统计学意义(P<0.05)。软骨特异性染色(甲苯胺蓝、番红)及Ⅱ型胶原免疫组化检测结果显示:经诱导的HAMSCs 细胞形态由长梭形变为类圆形,呈“铺路石”样紧密排列;软骨细胞外基质特异性染色阳性;Ⅱ型胶原免疫组化结果显示细胞外基质有大量的II型胶原分泌,表明诱导的膜片具有良好的成软骨特性。
4 结论
HAMSCs 具有间充质干细胞的表型和特点,具有低免疫原性和多向分化潜能,可以作为软骨组织工程优良的种子细胞。本研究应用一种简单的方法成功构建了HAMSCs 膜片,并且该膜片具有一定的可操作性。体外实验结果证实HAMSCs膜片具有良好的成软骨性能,为HAMSCs 膜片应用于软骨损伤修复奠定了理论基础,为今后组织工程软骨的构建提供一种新思路。本研究侧重于观察HAMSCs膜片成软骨诱导的体外实验效果,未来还要在体内实验中观察HAMSCs 膜片对于软骨损伤的修复效果。

