门脉高压性胃病临床研究进展
王文生 综述,陈东风,文良志 审校
作者单位:400042重庆市 陆军军医大学大坪医院消化内科
PHG的发病率在不同的研究报道中差异较大,总体来说呈高发态势。肝硬化人群并发PHG百分比从20%到98%不等[4],而在门脉高压人群中发病率在10%到80%[5],这种差异可能与人群的选择和缺乏统一的内镜诊断标准等相关。
1 发病机制
1.1 门静脉高压 门静脉高压的发生是PHG发病的始动环节,但门静脉高压患者并不都存在PHG[6]。肝静脉压力梯度(hepatic venous pressure gradient,HVPG)是目前公认的反映门静脉压力的客观指标。有研究发现当HVPG≥12mmHg时,PHG发病明显增加,并且重度PHG的患者比轻度患者HVPG更高。尽管有小样本研究指出,PHG发生与HVPG、肝功能Child分级之间无确定的相关性,但大多数研究支持门静脉压力越高,PHG发生率越高,黏膜病变越严重[7]。Bang et al[8]研究随访了587名肝硬化患者,发现PHG发生率高达91.5%,与 HVPG、Child分级、MELD(Model for End-stage Liver Disease)评分以及生存期等指标密切相关,且发生PHG的肝硬化患者预后更差,进而提出PHG出现可作为肝硬化的预后评估因素。
有许多研究发现反映门静脉压力的HVPG、食管静脉曲张与PHG的发病密切相关。并且通过药物、经颈静脉肝内门体静脉分流术(transjugular intrahepatic portosystemic shunt,TIPS)或肝移植降低门静脉压力后,PHG得到了改善,进一步佐证了门静脉高压在PHG发生发展中起到重要作用。Sarin[9]和Chaves[10]团队均研究发现肝硬化导致门静脉高压的PHG发生率显著高于非肝硬化导致门静脉高压患者,提示门静脉高压的病因也会影响PHG的发病,可能与肝硬化患者更容易发生门静脉高压有关。另外还有研究发现,食管胃静脉曲张患者经过内镜下注射硬化剂(endoscopic variceal sclerotherapy,EVS)或套扎(endoscopic variceal ligation,EVL)治疗后,PHG会加重,这与血流重新分布导致门静脉血流增加、压力升高有关[11]。
1.2 血流动力学异常 分析254例肝硬化患者,其中并发PHG患者心脏指数、心输出量更高,但体循环血管阻力及肺循环血管阻力较低,提示PHG可能只是肝硬化和门脉高压导致的广泛血管病变在胃的局部表现[12]。食管静脉曲张治疗后,PHG发病率及严重度均明显增高,可能是由于曲张静脉血流量减少后,胃黏膜血流增多瘀滞加重了PHG[7]。PHG患者血中TNF-α增高,刺激NO和前列环素的大量释放,使胃部血管愈加扩张,进一步加重高动力性充血,形成恶性循环[7]。43例肝硬化PHG患者血清胰高血糖素水平较正常对照组明显升高[13]。
1.3 黏膜屏障损害 门静脉高压等血流动力学改变会导致胃黏膜高动力性充血,激活细胞因子、生长因子、激素等,进一步导致胃黏膜局部微环境发生变化。同时,这种高动力充血会损伤胃黏膜防御机制,介导促炎因子释放,降低胃黏膜修复再生能力。许多研究证实PHG患者胃黏膜下层动静脉通路开放,黏膜下层血流量增加,而黏膜层灌注减少引起缺氧。进而诱发氧自由基、NO、TNF-α、内皮素-1(ET-1)等因子过表达,破坏胃黏膜上皮细胞的完整性[4]。
胃黏膜充血瘀滞引起的低灌注和缺血缺氧,导致胃黏液-HCO3-屏障功能下降,黏膜对乙醇、胆盐、非甾体抗炎药(NSAIDs)及肠道内毒素抵抗力下降。PHG大鼠胃黏膜组织学显示TNF-α浓集,提示黏膜细胞凋亡活跃[11]。发现PUMA(p53正向凋亡调控因子)通过内质网应激依赖的凋亡途径使PHG患者和小鼠模型胃黏膜细胞凋亡增加[14]。
有学者认为Hp(Helicobacter pylori)感染通过改变胃黏膜微环境在某种程度上也会增加PHG患病风险,但目前研究未发现Hp与PHG相关性的有力证据[11]。
2 临床表现
PHG患者还会表现为慢性消化道出血引起的缺铁性贫血(iron deficiency anemia,IDA),较少患者会有急性消化道出血[15]。学者们认为患者血红蛋白(Hb)在半年内下降了20g/L,同时未应用过NSAIDs,则表明存在慢性出血。针对PHG患者仅用Hb下降标准来判断有无慢性失血可能会造成过度诊断。因为慢性肝病病人即使没有消化道出血,由于常合并肾功能不全、脾亢、骨髓抑制也会表现为一定程度贫血。PHG急性出血较少见,在肝硬化患者急性上消化道出血中有2%~12%是PHG引起,大多为重度PHG患者(90%~95%)[4]。Gostout et al[16]对1496位急性上消化道出血患者统计分析,仅12人(0.8%)是由PHG引起,在非静脉曲张出血中占8%。一般情况下,PHG引起的急性出血较轻,致死性出血非常罕见,需要输血时,1或2个单位红细胞悬液即可达到较好效果[7]。
针对丝黑穗病而言,如果要妥善加以防控则需要将农作物种子拌于粉锈宁(25%)的药剂中,确保掺入5%左右的药剂来完成相应的拌种处理。在某些情形下,技术人员如果察觉到黑穗病表现为蔓延趋向,那么针对整个植株都要予以拔除处理,最好能够就地焚烧。及时察觉并且妥善处理黑穗病的举措有助于防控黑穗病的后期扩散。
3 诊断
3.1 内镜 PHG是一个内镜下诊断术语,通常在内镜检查评估静脉曲张情况时发现。内镜下特征为胃黏膜充血形成弥漫小红斑,伴有白色边界分割呈网格样分布,如蛇皮样改变、马赛克征等。红斑常位于胃体和胃底,胃窦部罕见,其大小和颜色取决于PHG严重程度,轻症患者常呈细小粉红色斑点如蛇皮状或马赛克,重症患者多为聚集性猩红热样红斑[7]。内镜下对PHG严重程度分级有助于评估患者出血风险。目前存在多种内镜下分类方法,各有优势。临床常用的有3种:McCormack 2分法、NIEC(the New Italian Endoscopic Classification)2分法、BavenoⅡ共识 2分法。1985年,McCormack et al[2]根据红斑情况将内镜下观测到水肿胃黏膜上分布有细小白色网状结构,形如蛇皮状,皱襞部斑纹状表现的粉红色斑点归为轻度;红斑弥散分布,呈弥漫性出血的归为重度。1992年,NIEC[17]达成共识:将PHG黏膜基本病变分为四种。分别为马赛克样改变指伴有黄白色边界的多形性小病变区;红斑指约1mm的小且平的红色点状病变;粉红斑指2mm左右的红色稍圆状隆起病变;黑褐斑指经内镜冲洗后仍有黏膜内出血的不规则黑或褐色病变。出现马赛克征者为轻度;一旦有红斑、粉红斑或黑褐斑出现归为重度。BavenoⅡ共识采用积分方式将PHG分为轻度(≤3分)、重度(≥4分)。该评分系统引入了胃窦血管扩张症(gastric antral vascular ectasia,GAVE),计分方法为:轻度黏膜马赛克型=1分,严重黏膜马赛克型=2分,红斑分离=1分,红斑融合=2分,并存GAVE=2分。Stewart et al[18]对该评分系统进行了评估分析,其重复性较好,能较准确反应PHG相关出血风险。
2013年,De Macedo GF et al[19]对临床常用的PHG内镜分类方法的可靠性进行了研究分析(表1)。结果提示内镜下马赛克征、红斑样变、樱桃红样斑对PHG诊断的特异性准确性较高。
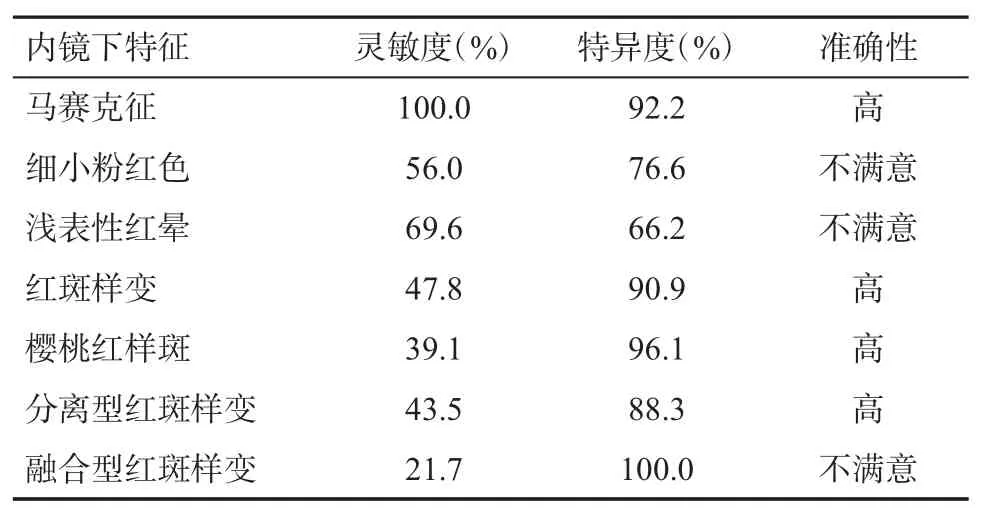
表1 内镜下征象诊断PHG可靠性
近期有研究[20]分析评估了PHG内镜分类方法在观察者之间的一致性。纳入了74例患者,结果显示Tanoue和McCormack分类标准在观察者间的一致性较低。
胶囊内镜(Capsule endoscopy,CE)对PHG的诊断亦有一定价值。有研究[21]指出CE诊断PHG与胃镜的一致性高达90.6%,可作为一项非侵入性选择,但研究样本较小,需要进一步扩大样本确证。另一项随机对照试验[11]发现,CE与金标准即上消化道内镜相比,CE的总体敏感度为69%,但受病变部位的影响较大,胃体部敏感度达到100%,而胃底部仅48%。
当前,新的内镜技术如窄带成像(NBI)、电子染色(i-scan)、富士智能色素内镜(FICE)的广泛应用,通过改善图像质量使诊断准确性进一步提升。Achim et al[22]进行了一项评估i-scan系统对PHG诊断价值的前瞻性研究,纳入了50位肝硬化患者,白光内镜下39人被诊断为PHG,行电子染色后增加了6人,且马赛克征、红斑样变及黏膜下血管系统等更为清晰。说明i-scan系统对PHG诊断敏感性更高,更易发现PHG的特征性黏膜病变。
PHG有时需要与GAVE相鉴别,通常通过内镜下表现不难鉴别。GAVE患者病变常位于胃窦,表现为线性黏膜红斑,但无马赛克征,称为“西瓜胃”。偶尔内镜下鉴别困难时,需借助活检或组织学证据。GAVE组织学特征为黏膜毛细血管扩张同时,常伴有纤维蛋白血栓形成及固有层梭形细胞或纤维肌性增生。而PHG组织学上往往不伴炎症或微血栓形成。通过组织病理学上发现微血栓或纤维肌性增生能将二者有效区分开来[6]。
3.2 影像学 虽然上消化道内镜检查是PHG的金标准,但其侵入性的操作有时会受到限制,需要采用非侵入性诊断方法。动态CT对PHG的诊断价值研究发现,以出现瞬态胃灌注缺陷征为诊断标准,结果显示敏感度、特异度、阳性预测值、阴性预测值分别为75%、88.6%、90%、72.1%,需要进一步的前瞻性试验来验证这种诊断模式[23]。亦有研究[24,25]探讨了CT灌注成像对PHG的诊断价值,将其与胃镜比对分析发现CT灌注成像能够早期发现血流动力学的变化,做出早期诊断,并能够做出量化评估,准确性及敏感性均优于胃镜。
超声造影(CEUS)对PHG诊断精确度为达到了70.4%,认为CEUS作为一种非侵入性诊断方法有巨大的潜在价值[25]。但该研究样本量较小,需大样本前瞻性试验进一步验证。
3.3 多变量模型 评估发现应用PSR(血小板计数与脾脏大小比值)、RLAR(肝右叶直径与白蛋白比值)对PHG诊断,准确度达到了74.7%、35.14%,纳入的样本量不多,仅111例,需要大样本多中心研究进一步探讨[15]。回顾分析232例慢性肝病患者,多变量分析显示脾脏体积多维指数(脾脏长度、宽度和厚度的乘积)、血小板、白蛋白与静脉曲张和PHG(varices and portal hypertensive gastropathy,VAP)密切相关。进一步建立VAP评分系统(=血小板(/mm3)×白蛋白(g/L)/脾脏体积多维指数(cm3),其受试者曲线下面积(AUROC)达到了0.85。该评分系统能较好预测慢性肝病患者食管胃静脉曲张及PHG发生。
4 治疗
PHG的治疗主要是通过药物降低门静脉压力,内镜下治疗、介入及手术分流术均有一定疗效。非选择性β受体阻滞剂(NSSB)是常用一线治疗药物,不仅能降低门静脉压力,对控制PHG引起的慢性消化道出血亦有一定疗效,急性出血患者出血控制后应用亦可从中获益。临床上有明确消化道出血病史的PHG患者应用NSSB后,其再发出血风险明显降低。Baveno IV共识会议建议将NSSB作为PHG患者慢性胃肠道出血的二级预防措施[6]。
4.1 药物治疗 当PHG慢性消化道出血时,会表现为IDA,此时应进行补铁治疗,口服或静脉均可。应用NSSB可控制此类慢性失血及有效预防复发。因此,补充铁剂同时,也可应用普萘洛尔(最大口服剂量160 mg,2/日或使心率降至50~55次/分的耐受剂量)[4]。
治疗PHG急性出血时,需内镜除外静脉曲张破裂出血。一般治疗措施包括容量复苏、预防性应用抗生素。必要时慎重输血,使Hb维持在8g/dl即可,过度输血反而会增加门静脉压力。但合并心肺疾病时,可使Hb维持在9~10 g/dl[7]。严重的PHG可引起致死性上消化道大出血,在保护气道及维持灌注前提下,应尽早应用血管收缩剂如特利加压素、生长抑素或生长抑素类似物。
4.2 内镜下治疗 急性出血时内镜下治疗通常效果不佳,但对于出血部位局限或门体分流有禁忌症时,可考虑应用内镜下热凝术如氩离子凝固术(argon plasma coagulation,APC)[4]。在一项小样本单中心研究发现APC对PHG出血控制有效率达到81%,且术后跟踪随访了22个月,患者未再发生出血事件[27]。另一项队列研究[28]纳入了188名严重PHG患者,均接受APC,同时常规应用普萘洛尔治疗。术后内镜随访1年,118人贫血和对输血需求完全改善,剩余70人也有部分改善,说明APC联合普萘洛尔治疗能有效控制PHG出血,并且普萘洛尔有禁忌时,仅接受APC治疗同样有效。
4.3 血管介入治疗 药物或者内镜下治疗仍不能有效控制PHG出血时,可采用血管介入方法,其中TIPS最常用。多项研究证实TIPS术后,部分PHG患者胃镜下表现得到明显改善[6]。对40例PHG患者在TIPS术后随访6个月时,发现75%严重患者内镜下改善,89%轻度患者得到改善[29,30]。另一种介入方法,经球囊导管逆行经静脉栓塞(balloon-occluded retrograde transvenous obliteration,BRTO),最初用于控制胃静脉曲张破裂出血,可能亦有一定作用,但缺乏与TIPS的对比研究[31]。经脾动脉栓塞术亦能改善PHG,有研究发现脾亢患者行经脾动脉栓塞术后PHG发生率较对照组明显下降[32]。
4.4 其他 近来有报道,一种止血纳米粉(Hemospray)遇水后能在出血点处快速形成机械屏障,对PHG引起的急性出血显示出良好的止血效果[33]。这种止血粉曾被成功应用于控制消化性溃疡、静脉曲张、胃肠道肿瘤引起出血。当然需要大样本前瞻性研究进一步证实其对PHG止血效果。
分流手术通过降低门静脉压力,能改善PHG病情,降低出血风险,甚至完全改善内镜下表现。由于创伤较大,目前已很少应用[7]。在49例经腹腔镜脾切术PHG患者,其中17例严重PHG中有16例得到改善,32例轻度PHG中有12例得到改善,说明腹腔镜脾切术亦能有效改善PHG病情。
肝移植可能是难治性PHG出血的最终治疗方案,需要进行综合评估。一般MELD评分≥15分,才考虑肝移植。理论上,PHG患者行肝移植后,病情会有明显改善[11]。回顾分析29例肝移植患者,发现其中合并PHG的19例行肝移植术后均得到好转。证实了肝移植对PHG的确切效果。

