复合酶提取绿茶茶多酚工艺及其抑菌性
李堆淑
(商洛学院生物医药与食品工程学院,陕西商洛 726000)
绿茶为山茶科植物茶(Camellia sinensis)的嫩叶,其最主要的成分是绿茶多酚,绿茶多酚主要成分为儿茶素,占总酚含量的60%~80%[1]。茶多酚具有防肿瘤、预防心血管疾病、防龋齿等药理与生理功能,还具有优异的抗氧化和清除自由基能力[2]、抗衰老作用[3-4]、抗癌治病[5]、抗辐射[6]、降低血糖血脂和胆固醇[7-8]、抗动脉粥样硬化及抗菌抑酶[9]等保健作用。常饮绿茶可以预防癌症,降低脂肪和减肥,还可减轻尼古丁对吸烟者的伤害。茶多酚提取工艺有水和有机溶剂提取法、超临界萃取法、金属离子盐沉淀法、树脂吸附法、超声波辅助提取法、微波提取法。但绿茶茶多酚提取工艺采用复合酶法提取的报道较少,尤其采用复合酶法,并结合响应面法优化绿茶茶多酚提取工艺未见报道。鉴于此,本文采用纤维素酶和果胶酶复合酶辅助提取绿茶中茶多酚,在单因素基础上,运用响应面法优化绿茶茶多酚的工艺,并研究绿茶茶多酚对金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)和大肠杆菌(Escherichia coli)等细菌的抑菌性。
1 材料与方法
1.1 材料
绿茶:市售成品绿茶(产自商洛市商南县)。
金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌:商洛学院生物医药与食品工程学院微生物实验室提供。
1.2 仪器及试剂
仪器:紫外-可见分光光度计(上海第三分析仪器厂,721型)、电热恒温水浴锅(郑州长城科工贸有限公司,HHS-11-2型)、循环水真空抽滤机(上海亚荣生化仪器厂,HZ-Ⅲ型)、电子天平(上海精科天平厂,FA1104型)。
试剂:果胶酶(酶活≥1.1 U/mg,Fluka),纤维素酶(酶活≥15 000 U/g,国药集团化学试剂有限公司)。酒石酸钾钠、硫酸亚铁、磷酸氢二钠、磷酸二氢钾、醋酸乙酯、无水乙醇均为化学分析纯。
1.3 方法
1.3.1 茶叶茶多酚的提取
将绿茶茶叶粉碎,过80目筛,准确称取绿茶茶叶末2.000 g于100 mL烧杯中,加入复合酶(纤维素酶和果胶酶质量比1∶1)6.0 mg和pH 4.8的NaAc-HAc缓冲液,再加入无水乙醇减压抽滤,得到滤液,避光,放冰箱备用。
1.3.2 茶多酚得率的检测
采用酒石酸亚铁分光光度法[10],准确称取50 mg(精确到0.000 1 g)茶多酚标准品,溶解定容到100 mL的容量瓶中,摇匀,然后分别取0、0.5、1.5、2.0、2.5、3.0 mL放入25 mL比色管中,以空白试剂作参照,在波长540 nm下,得到标准曲线y=9.210 6x+0.001 8,R2=0.999 7,检测茶多酚的得率。
1.3.3 抑菌性试验
将培养24 h的金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌分别接入无菌水,在37℃,130 r/min培养24 h后,将3种细菌悬浊液(菌数1×108cfu/mL)各取0.2 mL,分别接种于不同培养基,涂匀,然后将提取的绿茶茶多酚粗提液配成浓度为1×10-4、2× 10-4、5 × 10-4、1× 10-3、1× 10-2mg/mL,乙醇浓度50%为对照,将直径为15 mm的滤纸片浸泡于不同浓度的粗提液30 s后,用无菌的镊子接于培养基,每皿接3个滤纸片,重复3次。在37℃,培养1~2 d,观察抑菌圈直径大小。
抑菌率%=[(样品抑菌圈直径-空白抑菌圈直径)/样品抑菌圈直径]×100%
1.3.4 单因素试验
(1)酶添加量。准确称取2.000 g茶叶末,pH 4.8,酶解温度50℃,酶解时间90 min,乙醇浓度50%,考察酶添加量为1.0、1.5、2.0、2.5、3.0 mL对茶多酚得率的影响。
(2)酶解温度。准确称取2.000 g茶叶末,酶添加量2.5 mL,pH 4.8,酶解时间90 min,乙醇浓度50%,考察酶解温度分别为30、40、50、60、70℃对茶多酚得率的影响。
(3)pH值。准确称取2.000 g茶叶末,酶添加量2.5 mL,酶解温度50℃,酶解时间90 min,乙醇浓度50%,考察酶解pH值分别为3.2、4.0、4.8、5.6、6.4对茶多酚得率的影响。
(4)乙醇浓度。准确称取2.000 g茶叶末,酶添加量2.5 mL,pH 4.8,酶解温度50℃,酶解时间90 min,考察乙醇浓度分别为30%、40%、50%、60%、70%对茶多酚得率的影响。
1.3.5 响应面试验
根据单因素的试验结果,选取酶添加量、酶解温度、pH值、乙醇浓度4个因素,以茶多酚得率为响应值,试验因素水平编码(表1)。
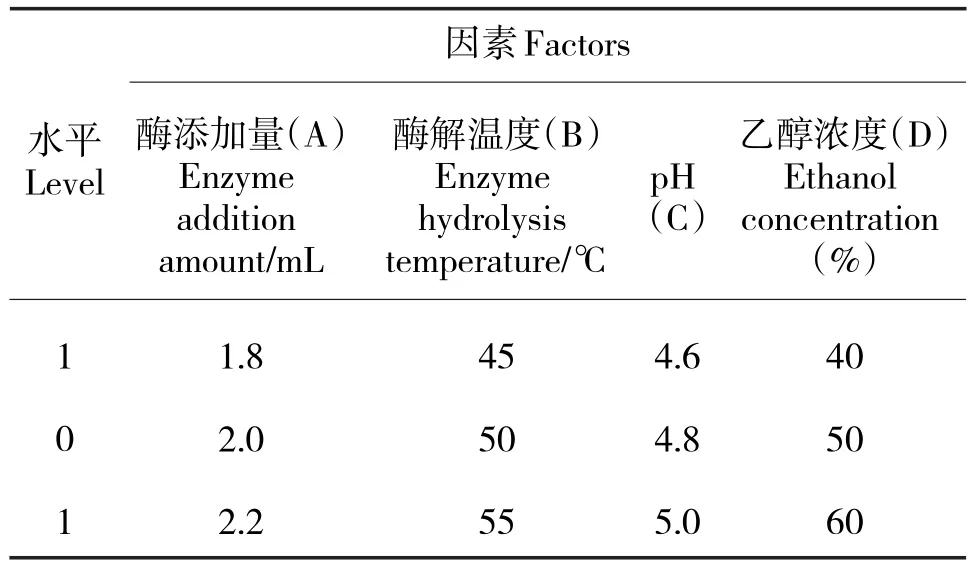
表1 响应面分析因素与水平Tab.1 Factors and levels of response surface analysis
2 结果与分析
2.1 单因素试验结果
2.1.1 酶添加量对绿茶茶多酚得率的影响
当酶添加量不断增加时,绿茶茶多酚得率呈先增加后下降趋势(图1)。其原因为茶多酚等细胞内物质在酶的催化下快速扩散溶解[11],当酶添加量增加到2.0 mL时,绿茶茶多酚得率达到最高峰(19.06%),随后再增加酶添加量,绿茶茶多酚逐渐降低,其原因为酶添加量继续增加而底物浓度保持不变导致酶不再饱和,使酶解反应被抑制。因此,最佳酶添加量为2.0 mL。

图1 酶添加量对绿茶茶多酚得率的影响Fig.1 Effect of enzyme addition amount on yield of green tea polyphenols
2.1.2 酶解温度对绿茶茶多酚得率的影响
当酶解温度逐渐升高时,绿茶茶多酚得率也随着提高,当酶解温度升到50℃时,绿茶茶多酚得率达到最高峰(17.00%),之后再增加酶解温度,茶多酚得率逐渐下降(图2)。其原因为酶蛋白受热变性,酶开始逐渐失活,从而抑制了酶解作用[12]。因此,酶解的最佳温度为50℃。

图2 酶解温度对茶多酚提取效果的影响Fig.2 Effect of enzymatic hydrolysis temperature on yield of green tea polyphenols
2.1.3 pH值对绿茶茶多酚得率的影响
pH不断升高绿茶茶多酚得率也不断增加,当pH升高到4.8时,绿茶茶多酚得率达到最高峰(17.26%),随后pH值再升高,绿茶茶多酚得率逐渐降低(图3)。酶的活性不仅受温度影响还受pH影响,酶都有相应的最适pH值,当酶在反应中达到其最适pH值时,此时的酶解反应效率最高。pH过高会导致酶的活性发生变化,同时使细胞内扩散出来的茶多酚发生解离。因此,最佳酶解pH为4.8。
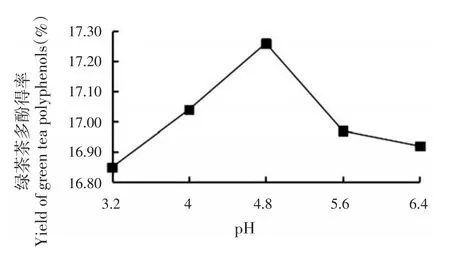
图3 pH对茶多酚提取效果的影响Fig.3 Effect of pH on yield of green tea polyphenols
2.1.4 乙醇浓度对绿茶茶多酚得率的影响
随着乙醇浓度的增加,绿茶茶多酚得率逐渐增加,当乙醇浓度增加到50%时,绿茶茶多酚得率达到最高峰(20.06%),之后再增加乙醇浓度,绿茶茶多酚得率逐渐降低,乙醇浓度过高会导致茶叶中某些蛋白质发生变性,降低颗粒的渗透性,因此茶多酚得率下降[13]。所以,最佳乙醇浓度为50%。
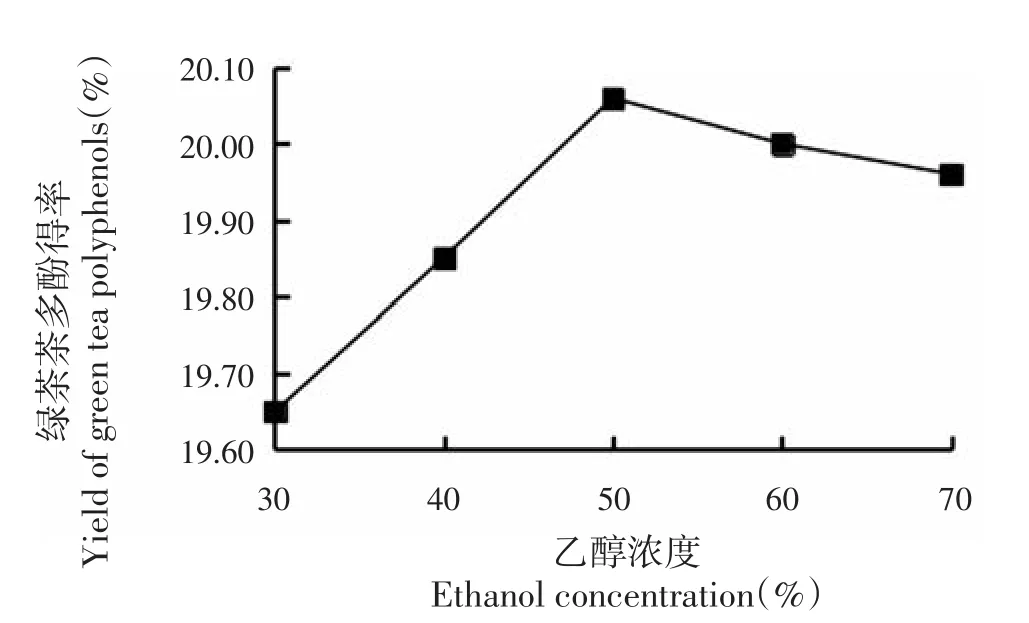
图4 乙醇浓度对茶多酚提取效果影响Fig.4 Effect of ethanol concentration on yield of green tea polyphenols
2.2 响应面法优化绿茶茶多酚提取条件
2.2.1 响应曲面结果及模型方案的方差分析
通过Design-Expert 8.0.6软件,对响应面回归过程进行分析,建立响应面的回归方程:绿茶茶多酚得率(%)=-1 548.62+472.85A-5.68B+248.31C+25.31D-0.75AB-37.06AC+0.29AD+3.29BC+0.08BD+1.43CD-66.68A2-0.13B2-42.28C2-0.36D2(表2)。

表2 绿茶茶多酚提取响应面试验设计及结果Tab.2 Response surface design and results of green tea polyphenols extraction
该模型的P<0.000 1,呈极显著性,模型失拟项差异不显著(P>0.05),决定系数R2=0.920>0.900,可见,该模型的拟合度良好(表3)。影响绿茶茶多酚优化条件的因素顺序为酶添加量>酶解温度>pH>乙醇浓度,说明酶添加量对绿茶茶多酚得率的影响最为显著。酶添加量和pH交互作用对绿茶茶多酚得率呈显著性影响,酶解温度和pH交互作用对绿茶茶多酚得率呈极显著影响。
2.2.2 响应面分析
因素的交互作用可以从响应曲面坡度变化得到反映,响应面坡度越陡峭,因素的交互作用对绿茶茶多酚得率的影响越显著(图5~10)。同样响应面在底面倒影的等高线图形状能反映各因素交互作用的强弱,等高线图是椭圆形,说明因素交互作用对绿茶茶多酚得率的影响比较显著,椭圆形越扁,说明因素交互作用对绿茶茶多酚得率的影响越显著;等高线图越接近圆形,说明因素交互作用对绿茶茶多酚得率的影响越不显著。可见,同样得到酶添加量和pH交互作用对绿茶茶多酚得率的影响呈显著性、酶解温度和pH交互作用对绿茶茶多酚得率的影响呈极显著,其他因素交互作用对绿茶茶多酚得率影响不显著。
2.3 最佳工艺条件的确定与验证
由Design-Expert分析软件得到的最佳提取绿茶茶多酚得率的工艺条件:酶添加量2.06 mL、酶解温度48.72℃、pH 4.77、乙醇浓度50.02%,在该条件下绿茶茶多酚得率为24.68%。为了试验方便操作,修正后的提取工艺条件:酶添加量2.0 mL、酶解温度50℃、pH值4.8、乙醇浓度50%,再进行3次重复试验,实测绿茶茶多酚平均得率为24.59%,与预测值相差较小,说明此方程模型所得的工艺参数准确可靠。
2.4 绿茶茶多酚的抑菌性
对照为乙醇浓度50%,发现也有抑菌圈(表4),其原因为乙醇本身就具有抑菌作用。但是,这并不影响抑菌试验的整体效果。绿茶茶多酚的浓度与抑菌效果成正相关。在绿茶茶多酚浓度为1×10-2mg/mL时,其对枯草芽孢杆菌和大肠杆菌的抑菌性最为敏感,抑菌率分别为46.01%和45.77%。从整体来看,绿茶茶多酚对枯草芽孢杆菌和大肠杆菌的抑制效果比较显著,而对金黄色葡萄球菌抑制效果较小。

表3 绿茶茶多酚提取响应面试验结果的方差分析Tab.3 ANOVA of response surface of extraction of green tea polyphenols
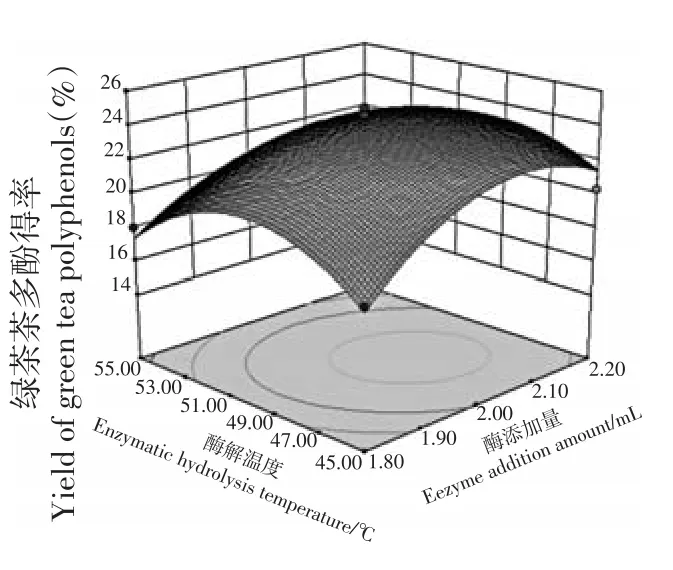
图5 酶添加量和酶解温度交互对绿茶茶多酚得率影响的响应面Fig.5 Response surface of effects of interation between enzyme addition amount and enzymatic hydrolysis temperature on yield of green tea polyphenols

图6 酶添加量和pH交互对绿茶茶多酚得率影响的响应面Fig.6 Response surface of effects of interaction between enzyme addition amount and pH on yield of green tea polyphenols
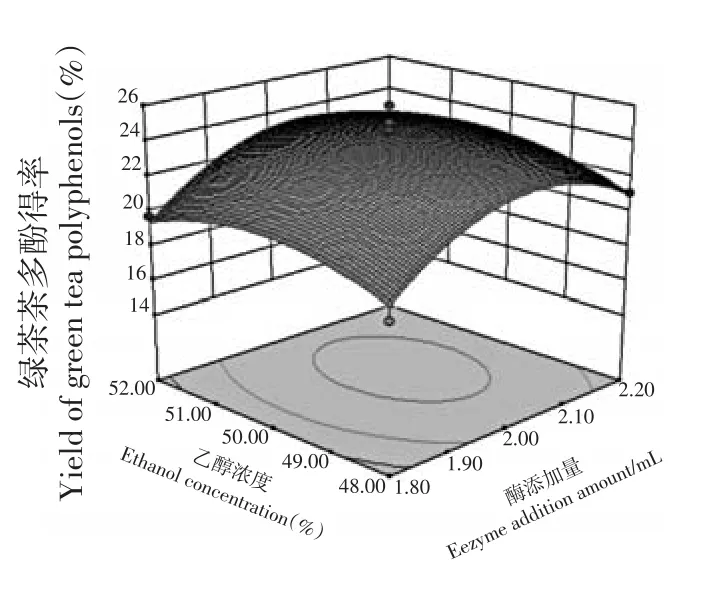
图7 酶添加量和乙醇浓度交互对绿茶茶多酚得率影响的响应面Fig.7 Response surface of effects of interaction between enzyme addition amount and ethanol concentration on yield of green tea polyphenols

图8 酶解温度和pH交互对绿茶茶多酚得率影响的响应面Fig.8 Response surface of effects of interaction between enzymatic hydrolysis temperature and pH on yield of green tea polyphenols

图9 酶解温度和乙醇浓度交互对绿茶茶多酚得率影响的响应面Fig.9 Response surface of effects of interaction between enzymatic hydrolysis temperature and ethanol concentration on yield of green tea polyphenols

图10 pH和乙醇浓度交互对绿茶茶多酚得率影响的响应面Fig.10 Response surface of effects of interaction between pH and ethanol concentration on yield of green tea polyphenols
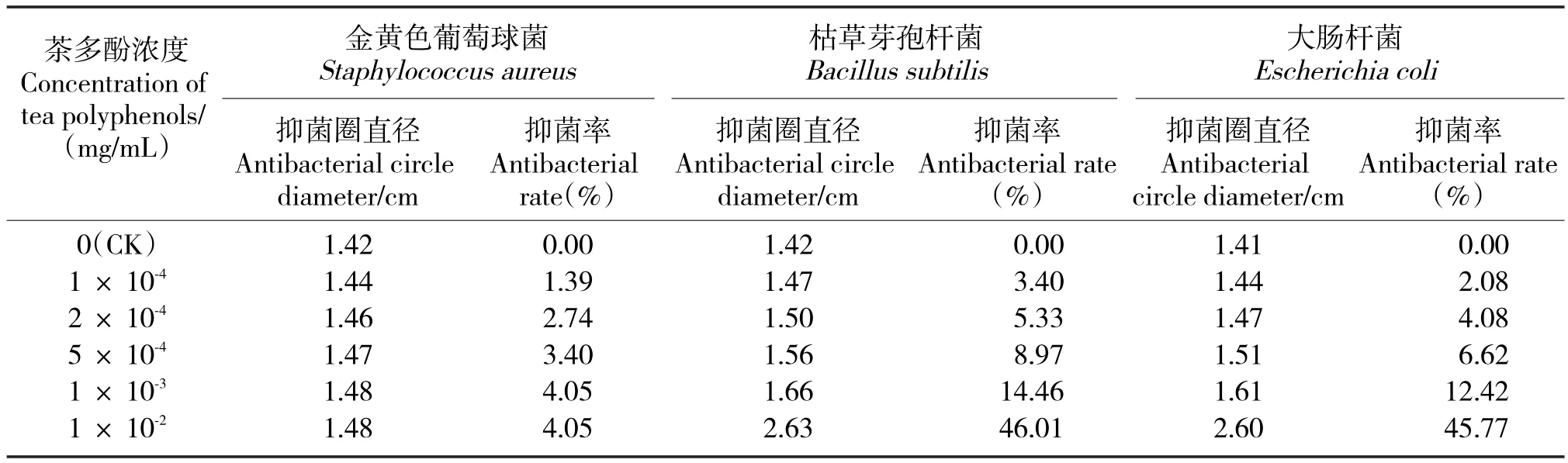
表4 不同浓度绿茶茶多酚的抑菌率Tab.4 Inhibition rates of green tea polyphenols with different concentrations
3 结论
本研究以提取绿茶茶多酚得率为考察目标,在单因素的基础上,利用响应面分析法优化绿茶茶多酚的提取工艺,最终得到绿茶茶多酚提取最佳工艺参数为酶添加量2.0 mL、酶解温度50℃、pH 4.8、乙醇浓度50%,此条件下的茶多酚得率为24.59%,接近预测值24.68%,说明此模型可靠。并且得到影响绿茶茶多酚优化条件的因素顺序为酶添加量>酶解温度>pH>乙醇浓度。通过绿茶茶多酚的抑菌试验发现,绿茶茶多酚浓度与抑菌效果成正相关,从整体来看,绿茶茶多酚对枯草芽孢杆菌和大肠杆菌的抑制效果比较显著,而对金黄色葡萄球菌抑制效果不显著。

