转录因子WRKY6和PR1在拟南芥胁迫记忆中的表达模式
李 爽 熊 樱 RALF Müller-Xing 邢 倩
(东北林业大学生命科学学院,哈尔滨 150040)
在自然条件下,植物不能像动物一样可以通过迁移来趋利避害[1],常常会遇到病原菌、寒冷、干旱等其它不利因素的影响,这些因素会阻碍植物的生长发育。由于环境的不利影响可能会重复发生,植物能够记住过去发生的事情,并利用这些记忆“memory”应对再次的胁迫环境,记忆系统中最为人所熟知的就是防御启动“Defense Priming”[2]。在防御启动系统中,启动的标志是胁迫应答基因的表达增强,且与第一次伤害相比,植物在第二次被病原体侵害时会表现出更快、更强的反应,来增加生存的几率,这种防御启动也在各种非生物胁迫中存在[3~4]。以简单的干旱胁迫为例,植物经历了一段时间的干旱,在脱水胁迫下枯萎,之后进行补水,在第二次干旱胁迫时,植物能记住过去的干旱经历,从而更好的抵抗脱水,提高存活率[4]。所以植物需要拥有一系列快速而有效的防御机制来保护自己免受外界的伤害。因此,研究植物在逆境胁迫中的响应机制十分重要。
在PR(PATHOGENESIS RELATED)蛋白家族中,PR1是一类重要的蛋白,最早在烟草中发现。PR1是一类可经病原菌和SA(Salicylic Acid)诱导表达的蛋白,同时被证实具有抗病毒扩散、限制真菌入侵和保护植物抵御逆境胁迫等功能[5~6]。将SA注射到烟草叶片中,发现PR蛋白能在注射的叶片中积累,并增强对烟草花叶病毒的抗性,病斑数目大幅度降低[7~8]。已有研究表明,在植物体中水杨酸大量积累可以使植物防御病原菌侵染的能力增强,PR基因的表达量会大幅度的增加[9~10]。植物在局部受到病原体感染时会产生系统性防御反应SAR(Systemic Acquire Resistance)[11],SAR的发生通常被认为是PR基因表达量上升引起的,其中PR1(PATHOGENESISRELATED1)(AT2G14610)是SAR抗病机制反应中重要的分子标记[12]。SAR是植物主动防御机制,从发生到植物系统抗性的产生,需要一系列信号的转导[13~15]。研究表明,使用水杨酸类似物BTH(S-甲基苯并[1,2,3]噻二唑-7-硫代甲酸酯)可诱导PR基因表达量的上升,BTH也可以通过激活水杨酸信号通路保护植物免受伤害[16],BTH是SAR的诱导剂[17],更重要的是BTH的理化性质更稳定不像水杨酸具有较高的生物毒性[18]。此外,BTH在粮食作物和经济作物中都有广泛应用,它对多种植物不同种病害都可以产生抗性。
WRKY转录因子是植物体内特有的一类转录因子家族,它参与了植物生长发育,并且WRKY转录因子在植物抗病过程中的重要作用已不断被证明。WRKY转录因子在调控PR基因表达的过程中扮演重要的角色,WRKY转录因子特异性识别PR1基因在其启动子区域的W-box元件。WRKY6(AT1G62300)参与许多生长发育和逆境响应过程,WRKY6最早被报道的功能是参与植物病原体防御和衰老过程,在衰老的叶片和细菌侵染时WRKY6的表达显著升高,WRKY6能正向激活PR1启动子[19~20]。WRKY6被归类为一类不需要从头合成蛋白激活酶的直接早期型基因[21],因此,WRKY6功能最有可能参与调控这些过程的某些早期步骤[20]。Robatzek和Somssich研究发现WRKY6的异位过表达通过正向调节转录因子NPR1进而影响PR1的启动子活性,说明在普遍的胁迫响应途径中,WRKY6在NPR1和PR1的上游起作用[19]。PR1和WRKY6的转录调控反应存在一定的相似性,例如在持续的β氨基丁酸(BABA)诱导后再使用水杨酸处理,WRKY6和PR1都表现出增强的反应[22],说明植物激素可以直接或间接的调节WRKY转录因子和PR蛋白的表达,进一步表明二者在植物抗病反应中的重要作用。
由于拟南芥eFP数据库能够直观的显示22 000个基因的基因表达数据[23],因此本文利用这个数据库提供的数据进行生物信息学分析,同时以经过生物胁迫和非生物胁迫处理后的植物叶片作为实验材料,通过实时荧光定量PCR分析胁迫应答基因WRKY6和PR1的表达水平。为深入研究胁迫应答基因的信号转导,阐明植物响应生物及非生物胁迫机理,以及植物抗病的分子机制提供思路。
1 材料与方法
1.1 植物材料
野生型拟南芥(Arabidopsisthaliana)Columbia生态型(Col-0),土培方法培养,土配比为,土∶蛭石=3∶1。短日照培养,光照10 h,黑暗14 h,温度21℃。丁香假单胞菌Pseudomonassyringae(DC3000)菌种(上述材料均由本实验保存)。
1.2 实验试剂
Trizol提取RNA的试剂均购于Invitrogen公司(#15596018);LightCycler480® SYBR Green I Master购于Roche公司;S-甲基苯并[1,2,3]噻二唑-7-硫代甲酸酯(BTH)购于Sigma公司(#BCBS9477V);DMSO购于纳川公司(#NC0231-100);cDNA合成试剂盒Thermo Scientific RevertAid Reverse Transcriptase购于Thermo fisher公司(#EP0442);六水氯化镁购于Vetec公司,利福平购于纳川公司(#NC105455-1)。
1.3 实验方法
1.3.1 植物培养
将适量的拟南芥野生型(Col-0)种子倒入1.5 mL离心管中,在超净工作台中用70%的乙醇进行3次消毒处理,均匀播种在1/2MS平板中,将平板放于4℃冰箱中春化3天,3天后转到短日照中培养,这一天记作0 DAG(Days after germination),10天后将平板上的幼苗转入充分湿润的培养土中(土∶蛭石=3∶1)。35 DAG时,对幼苗进行胁迫处理。
1.3.2 丁香假单胞菌Pseudomonassyringae(DC3000)的培养以及菌液稀释
从-80℃冰箱中取出储存好的菌种(本实验室保存)在超净工作台中用无菌涂布棒在含有利福平抗性的KB(Kings B)固体培养基上划线培养,倒置在28℃培养箱避光培养17 h。次日,将平板中生长出来的单菌落挑出置于含利福平(50 mg·mL-1)抗性的KB液体培养基的摇瓶中。置于28℃的摇床中180 r·min-1震荡过夜培养得到OD600=1.0的菌液。最后,将过夜震荡培养的摇瓶置于超净工作台中,用10 mmol·L-1氯化镁溶液,稀释重悬,得到(OD600=0.002)的菌液,用来注射叶片。
1.3.3 BTH处理
将生长到35 DAG的拟南芥幼苗用300 μmol·L-1BTH进行喷施(整株植物),作为第一次胁迫处理,不处理作为对照。8 h后用镊子收取一株植物的3片莲座叶,作为一个样本,重复收取3次,收集于2 mL离心管中迅速置于液氮中,-80℃储存。随后进行RNA提取、反转录合成和RT-PCR。3天后,用5 mL不带针头的注射器,从叶子背面注射无菌水作为第二次胁迫处理,3 h后用镊子收取第二次处理上部一轮的植物的3片莲座叶,作为一个样本,重复收取3次,收集于2 mL离心管中迅速置于液氮中,-80℃储存。随后RNA提取、反转录合成(方法详见1.4)以及实时荧光定量PCR。并检测相关胁迫应答基因PR1和WRKY6的表达水平。
1.3.4 丁香假单胞菌处理
用5 mL不带针头的注射器将准备好的菌液(OD600=0.002),注射到35 DAG的拟南芥叶片中,选择同一轮的3片莲座叶从背面注入,待菌液浸湿全部叶片。设定注射时间点,分别为0(未处理的对照)、3、6和24 h。同样,在注射以上时间点后用镊子收取3片注射叶作为一个实验样本,重复收取3次,收集于2 mL离心管中迅速置于液氮中,-80℃储存。随后进行RNA提取、反转录合成(方法详见1.4)以及实时荧光定量PCR。并检测相关胁迫应答基因PR1和WRKY6的表达水平。
1.4 总RNA提取及cDNA合成
利用Trizol方法提取拟南芥植物叶片总RNA。利用Thermo Scientific RevertAid Reverse Transcriptase试剂盒进行cDNA合成,实验操作在冰上进行,并分为两步进行,第一步见表1,第二步见表2。65℃,孵育5 min,然后立即放在冰上2 min。

表1 cDNA合成第一步

表2 cDNA合成第二步

表3 实时定量PCR加样体系
表4WRKY6和PR1 Real-time PCR分析所用引物
Table 4 Primers used inWRKY6 andPR1 genes Real-time PCR analysis

引物Primers正向引物序列Forward primer sequence(5'→3')反向引物序列Reverse primer sequences(5'→3')WRKY6GAGACGATAGTACCAAGGCATCCATCGCTTATCATCGGAGPR1GGCTAACTACAACTACGCTGGGCTTCTCGTTCACATAATTCCEIF4AGGCTAACTACAACTACGCTGGGCTTCTCGTTCACATAATTCC
温和混匀后,瞬时低速离心,放入PCR仪中,42℃,60 min;70℃,10 min。程序结束后,按照2 μg的RNA浓度计算,将cDNA原液进行10倍稀释,即20 μL原液加入180 μL ddH2O,总体积为200 μL。稀释后的cDNA每管各取20 μL收集在一个离心管中,记为STD 100,将STD 100稀释10倍记为STD 10-1,将STD 10-1再次稀释10倍记为STD 10-2,以cDNA样品作为模板,用Perl Primer软件设计Real-time PCR引物,以EIF4基因作为内参基因。引物见(表3),按照20 μL反应体系进行加样。
加样完成后,1 500 r·min-1室温,离心3 min,置于Roche 480荧光定量PCR仪中。反应条件:95℃预变性10 min;95℃变性15 s;60℃退火20 s;72℃延伸25 s;共40个循环;95℃终延伸1 min;55℃保存30 s。分析数据采用2-ΔΔCt法(ΔΔCt=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组)[24]。
1.5 生物信息学分析
本研究以拟南芥eFP Browser(http://bar.utoronto.ca/efp/cgi-bin/efpWeb.cgi)数据库中WRKY6和PR1基因的基因表达数据为基础,进行生物信息学分析。该数据库根据图像及颜色深浅,显示不同组织器官中基因的表达水平[25]。首先,我们将图片数据数据拷贝到SketchBook绘图软件中(下载地址:https://www.sketchbook.com/),用控制调节色盘、明度和纯度的黑色圆圈画笔选择线性填充功能,填充一个矩形,随后SketchBook绘图软件通过基因表达数据库提供的颜色模式,生成代表基因表达水平绝对值的热图。该热图中黄色到红色代表基因表达水平从低到高。按照以上步骤将得到的所有数据进行处理,最后将以上步骤得到的所有数据进行拼接处理(图1)。
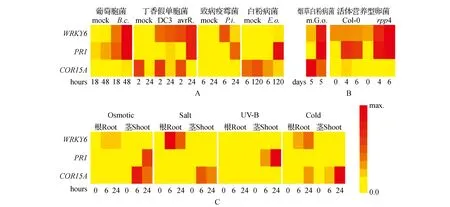
图1 拟南芥eFP公共数据库数据显示的胁迫处理引发的基因的表达模式 A.Mock,对照(B.c..葡萄胞菌;DC3和avrR.丁香假单胞菌;P.i.致病疫霉菌;E.o.白粉病菌);B.G.o.烟草白粉病菌,活体营养型卵菌(野生型Col-0和rpp4突变体);C.渗透胁迫(300 mmol·L-1甘露醇),盐胁迫(150 mmol·L-1氯化钠),紫外线胁迫(15 min),冷胁迫(4℃)[27] 在热图中,WRKY6、PR1、COR15A表达水平的最大绝对值是不相同的,图A中WRKY6 PR1 COR15A的值分别是(443.6;2920.5;4369.1;),图B中WRKY6 PR1 COR15A的值分别是(85.5;3215.1;917.2;),图C中WRKY6 PR1 COR15A的值分别是(1501.2;855.9;7290.5;) COR15A不受生物胁迫诱导,甚至COR15A基因的动态表达是下降的。Fig.1 Stress triggered expression pattern with the data from the Arabidopsis eFP Browser public database A.Botrytis cinerea,Pseudomonas syringae(Infiltration),Phytophthora infestans,Erysiphe orontii; B.Golovinomyces orontii,Hyaloperonospora arabidopsidis(Col-0 and rpp4 mutants); C.Osmotic(300 mmol·L-1 Mannitol), Salt(150 mmol·L-1 NaCl), UV-B(15 min),cold(4℃)[27] Note that the maximal(max.) absolute values of figure A WRKY6 PR1 COR15A is(443.6; 2920.5; 4369.1;),figure B WRKY6 PR1 COR15A is (85.5; 3215.1; 917.2;),figure C WRKY6 PR1 COR15A is(1501.2; 855.9; 7290.5;)are not identical COR15A is not induced by biological stress or even show declining expression dynamics.
2 结果与分析
2.1 WRKY6和PR1的生物信息学析
WRKY6和PR1基因进行生物信息学分析得到以下结果:图1A中,拟南芥在葡萄胞菌(Botrytis. Cinereal)、丁香假单胞菌(Pseudomonassyringae)、致病疫霉菌(Phytophthorainfestans)白粉病菌(Erysipheorontii)处理后,WRKY6和PR1基因都响应这些病原菌,只是程度不同。并且在葡萄胞菌处理48 h和丁香假单胞菌处理24 h,WRKY6和PR1基因的表达水平都达到最高。WRKY6在致病疫霉菌处理6 h时有轻微的表达,而PR1在致病疫霉菌和白粉病菌中具有高水平的表达。图1B中,拟南芥在烟草白粉病菌(Golovinomycesorontii)处理5天后,WRKY6和PR1基因依然保持高水平的表达。Biezen等人研究发现RPP4(RECOGNITIONOFPERONOSPORAPARASITICA4)基因在抵抗霜霉病菌(Peronosporaparasitica)侵染时具有重要功能[26]。通过对比野生型Col-0和突变体rpp4发现,在野生型中WRKY6的表达水平并没有变化,PR1的表达水平在处理后第4天升高以及在第六天微弱的降低。然而在rpp4突变体中,在霜霉病菌处理4天后WRKY6和PR1基因的表达水平都有明显的升高。以上数据表明,经过不同病原菌处理后WRKY6和PR1表现出相似的表达模式。
图1C中,在渗透胁迫和UV-B处理后,WRKY6在根中的表达强度高于茎中,而PR1在茎中的表达强度高于根中。在盐胁迫和冷处理条件下,WRKY6在根中都存在高表达,不同的是在盐胁迫时,表达强度随时间的增加而逐渐降低,在冷处理时,表达强度随时间的增加而缓慢增加,在茎中都表现出低水平的表达。PR1基因在根中低表达,在茎中随着时间的增加表达强度逐渐下降。上述结果表明,在不同的非生物胁迫处理下WRKY6和PR1在植物根、茎组织中表现出相对独立的作用。
综上所述,病原菌处理后RKY6和PR1基因具有相似的表达模式。与“可启动”的胁迫响应基因COLD-REGULATED15A(COR15A)呈相反的趋势。经过非生物胁迫处理后,WRKY6和PR1基因的表达模式却又完全相反,并与COR15A有部分的重叠。
2.2 生物胁迫病原菌处理对WRKY6和PR1表达模式的影响
通过荧光定量PCR检测了拟南芥野生型在接种丁香假单胞菌后胁迫应答基因WRKY6和PR1的表达情况(图2)。丁香假单胞菌处理后的时间进程中发现WRKY6的表达快速升高,并随着时间的增长WRKY6的升高变得缓慢。PR1的表达水平在处理6 h后显著增长,24 h达到最高。尽管WRKY6和PR1在不同时间响应病原菌的处理,但它们都表现出一定的上升趋势。以上结果说明,WRKY6和PR1具有相似的表达模式。

图2 拟南芥野生型Col-0病原菌侵染后WRKY6和PR1基因的表达水平(*P<0.05)Fig.2 WRKY6 and PR1 gene expression level after pathogens injection in WT(*P<0.05)
2.3 非生物胁迫处理对WRKY6和PR1表达模式的影响
通过荧光定量PCR检测了拟南芥野生型BTH处理8 h后,胁迫应答基因WRKY6和PR1的表达情况(图3)。短暂的BTH处理,WRKY6的表达水平没有显著变化,PR1的表达水平却显著升高,说明WRKY6短时间内不响应的BTH诱导,与此同时BTH作为水杨酸的功能类似物,能够短暂诱导PR1的高表达。

图3 拟南芥野生型Col-0 BTH处理8 h后,WRKY6和PR1基因表达水平(*P<0.05) 用300 μmol·L-1 BTH处理植物8 h,不处理作为对照。Fig.3 WRKY6 and PR1 gene expression level after BTH treatment 8 h in WT Plant were treated with 300 μmol·L-1 BTH 8 hours or control.*Significant difference in comparison to non-treated plants

图4 拟南芥野生型Col-0 WRKY6和PR1基因表达水平(*P<0.05) 用300 μmol·L-1 BTH处理植物,不处理作为对照,72 h后,一半的植物进行水注射处理,3 h后收取处理上层的叶片,进行RNA提取。Fig.4 WRKY6 and PR1 gene expression level in WTPlants were treated with 300 μmol·L-1 BTH or control. After 72 h,half of the plants were stressed by infiltrating water into their leaves. After 3 h,leaves were collected RNA were isolated.(A-B)Transcript abundance as determined by RT-qPCR. *Significant difference in comparison to non-treated plants
为了进一步研究WRKY6和PR1基因对胁迫记忆的应答,在第一次处理后的72 h进行了第二次胁迫处理。并通过荧光定量PCR检测了WRKY6和PR1的表达情况(图4)。图4A显示未处理时,WRKY6几乎不表达,BTH处理时WRKY6少量表达,水处理时WRKY6的表达水平明显升高,与不处理相比,BTH处理后的水胁迫显著增强了WRKY6的表达水平。图4B显示未处理时,PR1少量表达;BTH处理时,PR1的表达水平少量升高,水处理时PR1的表达水平少量下降,BTH和水共同处理时,PR1的表达水平有所升高但并不显著。
以上数据说明当第一次BTH处理后,植物产生了短暂的记忆,第二次水处理时,WRKY6表现出高水平的表达,说明WRKY6在转录水平上可能产生了胁迫记忆。PR1的表达趋势说明,水处理以及BTH和水共同处理并不能引发PR1的高表达。综上所述,WRKY6和PR1在响应胁迫记忆应答过程中是相互独立的。
3 讨论
近年来,随着植物信号转导和基因调控领域研究的迅速发展,WRKY转录因子在生物胁迫和非生物胁迫反应中的重要功能逐渐被发现[28]。AtWRKY25、AtWRKY38、AtWRKY62在植物防御机制中起负调控作用,它们的过表达株系都显著抑制抗病基因PR1的表达[29~30]。最新的研究发现,在种子萌发过程中,AtWRKY6的转录水平受到了明显的抑制,并且外源ABA对AtWRKY6的转录水平也有明显的诱导作用[31]。
目前,对WRKY转录因子的研究,已不再局限在模式植物拟南芥中,已有研究表明在大豆中,经过INA或BABA处理后,再经病原菌二次处理时PvWRKY6和PvPR1也存在这种既相似又不同的表达模式[32],但目前,PR1转录因子作为防御启动基因在非生物胁迫处理及胁迫记忆的研究中还知之甚少,本文对WRKY家族成员中的WRKY6和SAR抗病信号通路中标志性基因PR1进行了初步研究。
定量数据表明,经过生物和非生物胁迫处理后,胁迫应答基因WRKY6和PR1呈现出相似又不同的表达模式。WRKY6同时对多种胁迫因子产生反应,表明其在植物胁迫反应中的调控功能具有多样性。WRKY转录因子能够在抗病早期防卫应答调节中起作用,所以在病原菌处理时,WRKY6会快速应答并且表达水平呈上升趋势。BTH处理8小时后WRKY6并没有明显的变化,或许是因为BTH诱导启动状态的发生,增强细胞防御反应要严格依赖较长的预潜伏期[33]。在SAR实验中将拟南芥局部接种病原菌启动了WRKY6的防御记忆[34],WRKY6作为防御启动基因,在响应非生物胁迫记忆应答时,胁迫刺激下表达增强。研究发现,PR1在丁香假单胞菌DC3000处理后,PR1被启动并表现出表达增强的现象[35]。本研究中在丁香假单胞菌处理后,PR1基因的表达呈现增强的趋势,只是在处理6 h后才响应,可能是因为PR1需要积累大量的水杨酸才能被诱导。在BTH处理8 h后,PR1的表达水平短时间内显著升高,很有可能是水杨酸的短暂积累导致PR1的显著升高。但PR1在响应胁迫记忆的应答时,PR1的表达水平却只是轻微上调并不显著,可能是3天的时间使BTH的处理并不能长久的持续保持PR1高表达,在重复胁迫条件下应答基因的转录行为不同于初始胁迫处理时,暗示着胁迫记忆是多种信号通路协调反应的表现[4]。
先前的研究表明[19],PR1启动子的上调与WRKY6的持续性表达可能是由于SAR的瞬时扰乱,似乎不太可能是SAR信号通路中关键因子的直接互相作用。注射水作为机械胁迫处理而获得的PR1基因的表达水平与SAR实验中普通的氯化镁处理时的情况一样,并不会引发PR1的高表达。这才可能导致PR1的基因表达水平在特殊情况下并不产生记忆。基于目前的结果,PR1或许不是防御启动基因。但是,上述推测有待进一步深入研究和验证。本研究对植物“防御启动”进行了初步探索,为今后深入研究胁迫应答基因的信号转导,阐明胁迫应答基因表达调控与提高植株抗逆境性关系,为植物抗病的分子机制提供了研究思路。

