不同天然居群小蓬竹的遗传多样性
管睿婷 刘济明 王 敏 陈敬忠 武梦瑶 童炳丽
(贵州大学林学院,贵阳 550025)
小蓬竹(Petrocalamusluodianensis(Yi et R.S.Wang) Z.P.Wang et W.Y.Zhang)禾本科(Gramineae)竹亚科(Bambusoideae)岩竹属(Petrocalamus)[1~2];竹竿低部位较直且中心空隙很小,高部位藤状垂挂,合轴丛生,主干粗壮而侧枝极细,箨鞘较晚掉落,箨片披针形,没有箨耳;中国特有、贵州省特有物种,现悉仅分布于贵州省罗甸县、平塘县、长顺县、紫云县、贞丰县、册亨县、望谟县、安龙县、惠水县等喀斯特区域600~1 000 m海拔高度的石灰岩出露山地,在《中国物种红色名录》、《IUCN红色名录》里均属极危种[3]。
小蓬竹具有极高的经济价值、社会价值和生态价值。其材质柔韧,极适于编织农具、凉椅等,竹秆适做棚架和篱笆等;形态优美,是良好的园林绿化竹种,城市及公路边坡绿化美化中也可用作观赏植物;小蓬竹的竹浆质优,是造纸的上好材料。据刘超等[4]对小蓬竹水土保持效应的研究,小蓬竹林冠能截留大量降水,枯落物有助于土壤理化性质改善,能有效增强土壤的固土、保水、保肥能力。另外,洛畅等[5]发现空气相对湿度、叶片温度与明气孔导度等生态因子操控着小蓬竹水分利用率的日变化,李丽霞等[6]研究发现移栽小蓬竹与野生植株最大净光合速率无显著差异,李鹏等[7]研究表明小蓬竹根际土壤中微生物极为丰富。池馨等[8]研究证明若环境资源有限,小蓬竹与生态位相似性高的植物间竞争激烈,其建群种地位将备受威胁,故引种需尽量避免同女贞、榆树、云实、黄连木、椤木石楠等植物共植。孟勇等[9]研究了小蓬竹的生长发育规律,蒙朝阳对小蓬竹进行了扦插、埋秆埋节、连续分株、压条等试验,发现小蓬竹育苗的成活率受到插条年龄、生长素类型及其浓度的影响,其最优扦插条件下成活率仅50%左右。微观领域马玉栋等[10]用石蜡切片法研究了小蓬竹根、茎、叶结构,Zhou等[11]在研究转座子特性时使用小蓬竹作为试验材料。
过去对小蓬竹的研究主要集中于生态学与发育繁殖生理等方面,而对于小蓬竹的遗传特性及不同居群间的遗传变异研究未见报道。故该研究可为我国特有、极危物种小蓬竹的保护和后续开发利用及相关研究提供一定的参考。
1 材料与方法
1.1 实验材料
多次在贵州省内进行小蓬竹野外分布调查的同时进行采样,共采集到16个居群(表1),每个群体各取3株个体的新鲜叶片,用变色硅胶快速干燥。具体操作为:采集幼嫩、新鲜叶片约10 g置于塑封袋中,加入100 g变色硅胶,摇动袋子使叶片充分接触硅胶,保证叶片在12 h内干燥。随时注意观察硅胶颜色,一旦由蓝色变为粉红色,便随即更换处理。
1.2 主要仪器和试剂
1.2.1 主要仪器
(1)MJ Mini Personal Thermal Cycler PTC-1148(美国BIO-RAD);
(2)Centrifuge 5418小型台式离心机(德国Eppendorf);
(3)DYY-6C双稳定时电泳仪电源(北京市六一仪器厂);
(4)DYCP-31E琼脂糖水平电泳槽(北京市六一仪器厂);
(5)HH-4数显恒温水浴锅(常州澳华仪器有限公司);
(6)SE202F电子天平(奥豪斯仪器(上海)有限公司);
(7)移液枪一套(德国Eppendorf);
(8)UV VIS 8500紫外分光光度计(美国BIO-RAD);
(9)凝胶成像仪器(美国BIO-RAD);
(10)自动蒸汽灭菌锅(常州澳华仪器有限公司)。
1.2.2 主要试剂
CTAB提取液:CTAB提取液CTAB 2%,PVP(MW 40000)2%,NaCl 1.4 mol·L-1,EDTA pH8.0 20 mmol·L-1,TrisHCl pH8.0,100 mmol·L-1;
5×TBE电泳缓冲液:54 g Tris碱,27.5 g硼酸,20 mL 0.5 mol·L-1EDTA(pH7.9),加ddH2O定容至1 000 mL,使用的时候稀释5倍;
TE buffer:10 mmol·L-1Tris-HCl,1 mmol·L-1M EDTA,pH8.0;
100 bp Plus DNA Ladder(Thermo Scientific上海);6×Loading buffer,Taq DNA酶,dNTP,4S Green无毒型核酸染色剂,RAPD随机引物购自上海生工。
1.3 试验方法
1.3.1 小蓬竹基因组DNA的提取与检测
DNA的提取:在Doyle J J和Doyle J L经典的CTAB法[12]基础上进行改良,从硅胶干燥的小蓬竹叶片中提取小蓬竹基因组DNA,具体操作步骤为:
(1)取0.05 g干燥叶片置于灭菌预冷的研钵中,加适量的液氮快速研磨至粉末,研磨过程中注意添加液氮,在完成研磨前不能让研钵中的液氮完全挥发,以防止DNA褐化和降解。将研磨好的组织粉末迅速分装至2.0 mL灭菌冷冻的离心管中。
(2)加入800 μL 65℃预热的2×CTAB提取液,10 μL的β-巯基乙醇,剧烈震荡以充分混匀,置于65℃水浴约1 h,每10 min颠倒摇匀1次。
(3)加800 μL的氯仿∶异戊醇(24∶1),缓慢颠倒摇晃10 min。
(4)10 000 rcf,低温离心10 min。
(5)取上清液到一支新的离心管,加入0.7体积预冷的异丙醇,150 μL醋酸钠(pH5.2),充分混匀,-20℃放置30 min。
(6)10 000 rcf,低温离心10 min。
(7)弃上清,用70%酒精清洗沉淀1次。
(8)弃去酒精,在空气中晾干沉淀,加入50 μL 65℃预热的TE buffer溶解沉淀,-20℃放置备用。
模板DNA的检测:
马克思人的解放理论,不仅为我们深刻理解和把握美好生活的内涵提供了理论坐标,而且也为我们探寻美好生活的实现路径提供了根据遵循。依据该理论,我们认为,美好生活的生成蕴含着以下三重逻辑。
(1)琼脂糖电泳检测模板DNA
按照0.08%浓度称取琼脂糖粉末于TBE buffer中,微波炉加热溶解,待冷却至60℃时加入10%的核酸染液Green 4S混匀后,倒胶。
取6 μL模板DNA和3 μL 6×loading buffer混匀,在浓度0.08%琼脂糖凝胶上电泳,电泳液为1×TBE,电压100 V。待溴酚蓝跑至离点样孔2/3处时停止电泳。在凝胶成像系统下观察结果并拍照,据此确定DNA的浓度、片段大小、有无降解、RNA和蛋白质的污染情况等等。以确定所提取DNA的浓度和纯度。
(2)模板DNA的紫外吸收检测
用紫外分光光度计检测DNA。用ddH2O对待测样品DNA稀释至3 mL,以ddH2O作为参比液进行调零,在紫外分光光度仪上分别测定波长230,260和280 nm处的OD值。
核酸在260 nm处有最大吸收峰,蛋白质在280 nm处吸收峰最大,盐和小分子的最大吸收峰在230 nm处。260 nm处的读数来计算待测核酸的浓度,A260/A280比值大小说明样品中残存蛋白质的多少,A260/A230比值说明样品中残存核苷酸、氨基酸、酚、盐等小分子杂质。根据A260/A280和A260/A230来判断DNA的纯度,根据A260计算DNA的浓度和得率,公式为:
DNA浓度(ng·μL-1)=50×A260×稀释倍数
DNA得率(ng·g-1)=DNA浓度×叶片量(g)
1.3.2 引物筛选
1.3.3 RAPD扩增
运用优化的RAPD-PCR最佳反应体系[13]和所筛选的引物,对所有小蓬竹居群的样品DNA进行RAPD扩增。RAPD-PCR扩增产物于2%琼脂糖凝胶上进行电泳,电泳液为1×TBE,电压100 V,待溴酚蓝跑至距离点样孔2/3处时停止电泳,在凝胶成像系统下观察结果并拍照记录。

表2 RAPD引物编号及序列
1.3.4 数据统计分析
RAPD是显性标记,同一引物的扩增产物中电泳迁移率相同的条带被认为具有同源性,属于同一位点的产物,按照有带为1,无带为0来记录电泳谱带。将每个位点视为等位基因M和m,数据“1”代表基因型MM或Mm,数据“0”代表基因型mm,并且假定居群内基因频率处于Hardy-Weinberg平衡状态,用POPGENE32[14]软件计算下列遗传参数:
(1)多态位点比例(percentage of polymorphic loci,PPL)
PPL=(具有多态的位点/检测到的位点数)×100%
(1)
(2)观测等位基因数(observed number of alleles,Na)
(3)有效等位基因数(effective number of alleles,Ne)
(2)
式中:ne为单个位点上的有效单位基因数;Pi为单个位点上第i个等位基因频率;n为测定位点总数;Ne与基因的频率大小联系起来,更能反应群体的真实情况。
(4)Shannon’s多样性指数(Shannon’s Information index,I)
I=-∑Pilog2Pi
(3)
式中:Pi是一条扩增产物存在的频率;I为表型多样性指数。
I可以计算两种水平的多样性:Hpop和Hsp。Hpop是群体内遗传多样度,Hsp是种内遗传多样性,Hpop/Hsp则是群体内多样性所占的比例,群体间多样性所占比例则为(Hpop-Hsp)/Hsp。
(5)Nei’s基因多样性(Nei’s gene diversity,H)
(6)群体总基因多样性(Ht)和群体内基因多样性(Hs);
(7)基因分化系数(coefficient of gene differentiation,Gst)
Gst=(Ht-Hs)/Ht
(4)
(8)基因流(gene flow,Nm)
Nm=(1-Gst)/2Gst
(5)
(9)遗传相似性系数(genetic identity)
(6)
又表示两群体间的遗传相似程度,式中:JX、JY和JXY分别是所有位点上JX、JY和JXY算术平均数。这里JX=∑Xi,JY=∑Yi,JXY=∑XiYi,Xi、Yi分别是X、Y群体中第i个等位基因。
(10)Nei’s遗传距离(D)(genetic distance)
D=-lnI
(7)
用NTSYSpc Version 2.10e软件利用UPGMA(非加权算术平均法,unweighted pair group with arithmetic average)进行聚类分析,并建立聚类图。
2 结果与分析
2.1 DNA的提取与检测
采用改良CTAB方法提取到较高纯度的小蓬竹基因组DNA,0.08%琼脂糖凝胶电泳检测结果显示(图1)所提取的基因组DNA主带清晰,略有拖尾现象但不影响RAPD分析。所提取的小蓬竹基因组DNA的A260/A280比值在1.75~1.79,纯度较高;干燥叶片的DNA得率在2.17~5.27 μg·g-1,已经达到RAPD分析下游试验的要求。

图1 部分小蓬竹样品DNA电泳结果Fig.1 The DNA electrophoresis result of P.luodianensis
2.2 随机引物筛选
选取质量比较好的基因组DNA样品为模板筛选引物,从上海生工购买的80条随机引物中筛选出扩增条带清晰、多态性高,稳定性好的8条随机引物用于小蓬竹RAPD分析(表3)。部分引物筛选的琼脂糖凝胶电泳图谱见图2。
表3 用于小蓬竹RAPD分析的随机引物序列和编号
Table 3 Sequences and codes of RAPD primes forP.luodianensis

引物编号Primers’ number序列(5'—3')Sequence引物编号Primers’ number序列(5'—3')SequenceS5TGCGCCCTTCS101GGTCGGAGAAS43GTCGCCGTCAS123CCTGATCACCS60ACCCGGTCACS130GGAAGCTTGGS94GGATGAGACCS431TCGCCGCAAA

图2 部分引物筛选琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of some primers’ selection

表4 小蓬竹RAPD扩增结果
2.3 小蓬竹物种和居群水平的遗传多样性
本试验从80个引物中筛选出8个RAPD随机引物,对16个小蓬竹居群的48个DNA样品进行了PCR扩增,共扩增出105清晰、重复性高的条带,分子量约为200~3 000 bp,其中多态性条带有97条,多态性位点百分率(PPL)为92.38%。平均每个引物可扩增出12.25条多态性条带,其中引物S5、S43、S431扩增的条带数最多(16条),S123扩增条带数最少(7条);S43、S101、S431扩增条带多态性位点百分率达100%(表4,图3)。Shannon’s多样性指数(I)为0.458 6,Nei’s基因多样性指数(H)为0.300 5,有效等位基因数(Na)为1.494 2,由此可见,小蓬竹物种水平遗传多样性较为丰富。
从居群水平上分析,落湾(ZY1)居群多态位点百分率(PPL)最高(60.95%),桃坡(PT1)居群的多态位点百分率最低(44.76%),多态位点百分率(PPL)平均值为57.00%(表5)。按多态位点比率(PPL)排序,各个居群遗传多样性高低的顺序为:落湾(ZY1)>兴活(WM2)>格我(HS1)>八坎(AL1)>冗雷(CS1)>董架(LD1)>天生桥(HS2)>上坝(HS3)>山花(WM1)>杨柳树(ZF1)>打拥(LD2)>冗染(ZF2)>沙坝(CH2)>马熊湾(CH1)>冗渡(CH3)>桃坡(PT1)。
Shannon’s多样性指数(I)最高的是落湾(ZY1)居群为0.345 1,最低的是桃坡(PT1)居群为0.252 3,平均值为0.301 4(表5)。16个居群排序为落湾(ZY1)>兴活(WM2)>格我(HS1)>冗雷(CS1)>天生桥(HS2)>八坎(AL1)>山花(WM1)>董架(LD1)>上坝(HS3)>杨柳树(ZF1)>打拥(LD2)>冗渡(CH3)>冗染(ZF2)>马熊湾(CH1)>沙坝(CH2)>桃坡(PT1)。

图3 引物S5、S43、S431扩增小蓬竹16个居群的RAPD指纹图谱Fig.3 RAPD fingerprintings from S5、S43、S431 primers PCR amplification of 16 populations of P.luodianensis
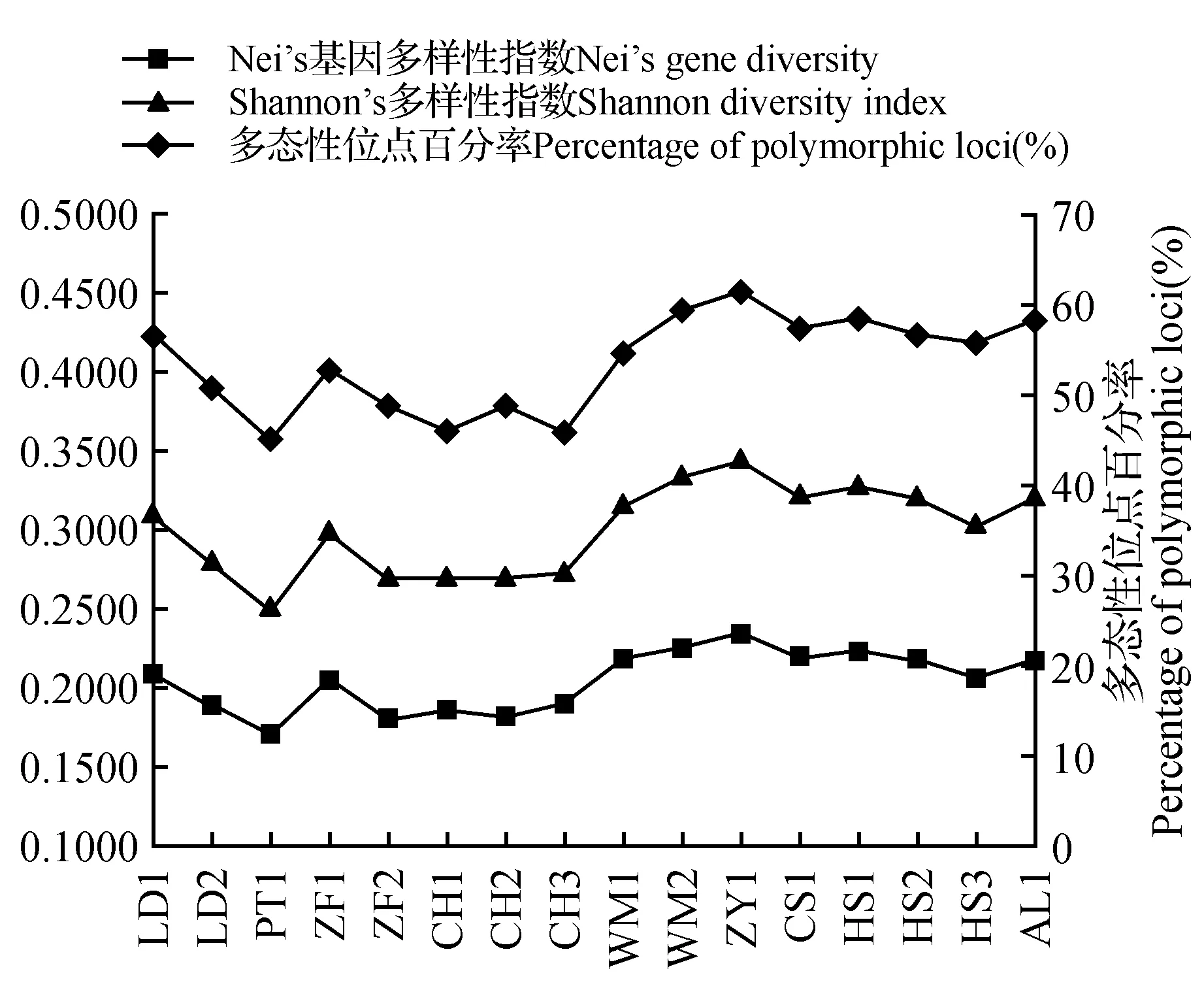
图4 16个居群小蓬竹的遗传变异指数统计Fig.4 The genetic variation indices of 16 P.luodianensis populations
Nei’s基因多样性(H)最高的是落湾(ZY1)居群为0.232 9,最低的是桃坡(PT1)居群为0.170 0,平均值0.203 4(表5)。以Nei’s基因多样性指数(H)(表5)为指标,则16个小蓬竹居群遗传多样性顺序为:落湾(ZY1)>兴活(WM2)>格我(HS1)>天生桥(HS2)>冗雷(CS1)>山花(WM1)>八坎(AL1)>董架(LD1)>杨柳树(ZF1)>上坝(HS3)>冗渡(CH3)>打拥(LD2)>马熊湾(CH1)>冗染(ZF2)>沙坝(CH2)>桃坡(PT1)。
分别以居群多态位点百分率(PPL)、Shannon’s多样性指数(I)、Nei’s基因多样性(H)为指标评价的各个居群遗传多样性变化趋势相似(图4)。
2.4 小蓬竹居群的遗传分化
根据Nei’s基因多样性指数估算的小蓬竹16个小蓬竹居群间的基因分化系数(Gst)为0.323 1(表6),即居群间变异占总的遗传变异的32.31%,居群内变异占的比例为67.69%。使用Shannon’s多样性指数分析的居群间遗传多样性所占比例[(HSP-HPOP)/HSP]为0.342 9,即居群间变异占总的遗传变异的34.29%,居群内变异占的比例为65.71%。Shannon’s多样性指数分析的居群间遗传多样性所占比例略大于Gst估算的遗传分化系数,但是,两类指数估算的小蓬竹居群遗传分化结果是一致的,都是以居群内遗传变异为主。
2.5 小蓬竹居群间的遗传距离和聚类分析
基因分化系数只能评估居群间的分化程度,不能定量分析居群间的遗传分化,因此计算出居群间的遗传相似性(I)和遗传距离(D)(表7),这两者是评价居群内和居群间遗传变异水平的重要指标。居群间遗传相似系数(I)在0.816 0~1.034 7,说明居群间的亲缘关系很近。16个小蓬竹的遗传距离都不够高,遗传距离最大的为沙坝(CH2)和八坎(AL1)两居群间,也只有0.203 3;冗雷(CS1)和(HS1)格我两个居群间遗传距离为负值(-0.034 1),进一步说明居群间的遗传变异程度较低。

表5 小蓬竹16个居群遗传多样性

表6 小蓬竹居群的遗传分化

图5 基于RAPD标记的16个小蓬竹天然居群UPGMA聚类图Fig.5 UPGMA dendrogram for 16 natural populations of P.luodianensis based on RAPD markers
Table 7 Nei’s unbiased measures of genetic identity(above diagonal) and genetic distance(below diagonal) among 16P.luodianensispopulations

种群PopulationsLD1LD2PT1ZF1ZF2CH1CH2CH3WM1WM2ZY1CS1HS1HS2HS3AL1LD1****0.97360.97850.86780.89380.88080.86120.90920.94330.98890.98900.99730.99470.98490.97350.9501LD20.0268****0.92360.89180.91240.86730.89780.88150.88290.94810.92740.92840.94280.91820.92110.9031PT10.02170.0795****0.86260.85930.89020.85150.91230.94530.97180.94960.95140.95350.94860.94740.8978ZF10.14180.11450.1478****0.96810.91860.87560.94360.88000.88330.86990.86290.88630.87000.85880.8689ZF20.11230.09160.15160.0325****0.91620.91080.92790.86970.88470.87430.87030.88420.86430.86470.8638CH10.12690.14230.11630.08490.0876****0.87660.92440.86880.89450.87400.87070.88920.85640.86870.8384CH20.14940.10780.16080.13290.09350.1317****0.89640.86010.84460.82420.81950.84140.83010.84170.8160CH30.09520.12620.09180.05810.07490.07860.1093****0.90410.90940.89840.89280.92000.90370.90520.8801WM10.05840.12460.05620.12780.13970.14060.15070.1008****0.98580.96010.94690.94090.95380.95820.8803WM20.01110.05330.02860.12410.12250.11150.16900.09500.0144****1.00900.98430.98390.97341.01140.9140ZY10.01110.07540.05170.13930.13430.13470.19330.10710.0408-0.0089****1.03021.02701.01561.00120.9290CS10.00270.07430.04980.14750.13890.13840.19900.11340.05450.0158-0.0298****1.03471.00400.99270.9309HS10.00530.05890.04760.12070.12300.11750.17260.08340.06090.0163-0.0267-0.0341****1.01450.99160.9504HS20.01530.08540.05270.13920.14580.15500.18620.10130.04730.0270-0.0155-0.0040-0.0144****0.97290.9585HS30.02680.08210.05410.15220.14540.14070.17240.09960.0427-0.0113-0.00120.00730.00850.0275****0.9109AL10.05120.10200.10790.14050.14640.17630.20330.12780.12750.09000.07360.07160.05080.04240.0933****
根据Nei’s相似性和遗传距离使用NTSYSpc V2.10e软件利用UPGMA法构建了居群遗传关系的聚类图。由图5分析,居群ZF1(杨柳树)和ZF2(冗染)相聚后再先后与居群CH3(冗渡)、居群CH1(马熊湾)相聚,然后与居群CH2(沙坝)相聚,这5个居群形成一个分支;居群CS1(冗雷)与HS1(格我)相聚后与居群ZY1(落湾)相聚,然后一起再先后与居群HS2(天生桥)及LD1(董架)相聚,然后与已经相聚的居群WM2(兴活)和HS3(上坝)相聚,再先后与居群PT1(桃坡)、WM1(山花)、LD2(打拥)、AL1(八坎)相聚成另一个分支。聚为一类者亲缘关系较近。
3 讨论
3.1 小蓬竹基因组DNA的提取
植物基因组DNA的提取方法,除了经典CTAB法[15]和SDS法[16]外,近些年又发展出一些简化、快速的制备方法,如SDS一步法制备PCR模板、微量提取法[17]等。目前用于竹类植物基因组DNA提取的方法主要以CTAB法和SDS法为基础。蒋瑶等[18]使用改良SDS法提取了撑篙竹(Bambusapervariabilis)和梁山慈竹(Dendrocalamusfarinosus)基因组DNA;杨清用CTAB裂解—硅珠吸附法提取了篌竹(Phyllostachysnidularia)和版纳甜龙竹(Dendrocalamushamiltonii)的DNA。
通常在提取植物基因组DNA时应尽量采用新鲜材料,以便于维持DNA的结构完整和生理活性状态,超低温冷冻是最好的保持组织成分的有效方法。但在野外采集样品时,要及时冷冻和运输大量新鲜材料是一件很困难的事情。所以,本研究中采用的硅胶快速干燥植物叶片的方式采集和保存植物材料,用干燥的植物叶片提取DNA。硅胶干燥植物叶片的方法是由Chase & Hills[19]提出的,该方法实现了野外大规模采样。本试验在提取小蓬竹基因组DNA的过程中验证:从干燥叶片与新鲜叶片中提取DNA的效果完全一致。
本研究选用的RAPD标记技术对DNA质量要求不高,但小蓬竹叶片中蛋白质和多糖含量较高,对DNA提取影响极大,因此本研究选择在经典CTAB法基础上进行改良,最后得到适合提取小蓬竹基因组DNA的方法。本试验还进行了两点加强的步骤,一是研磨前用剪刀将叶片剪碎,去除叶柄和叶主脉部分;二是研磨完成前不能让研磨钵中的液氮完全挥发,要保持叶片在液氮的冷冻保护中。
3.2 小蓬竹的遗传多样性与遗传分化
诸多研究发现,一些特有和濒危物种具有较高的遗传多样性[20],比如濒危竹类筇竹(Chimonobambusatumidissinoda,PPL=70.08%)、大叶筇竹(Chimonobambusamacrophylla,PPL=76.40%)、溪岸方竹(Chimonobambusarivularis,PPL=57.20%)、珍稀濒危观赏竹筇竹(QiongzhueatumidinodaPPL=76.38%)[21];濒危特有种掌叶木(Handeliodendronbodinieri)的多态性信息指数I=0.962[22];孑遗濒危植物蒙古沙冬青(AmmopiptanthusmongolicusPPL=73%)[23]。本研究表明,小蓬竹物种水平PPL为92.38%,Shannon’s信息指数I为0.458 6,Nei’s遗传多样性H为0.300 5,大于单子叶植物的平均值(0.190 9),说明极危物种小蓬竹也具有较高的遗传多样性。
植物的遗传多样性受许多因素影响,如起源早晚、进化历史、分类位置、生活型、地理分布、繁育系统等[24]。遗传变异高的植物通常是寿命长、地理分布广、异交为主、风媒授粉、结实率高且存在于演替阶段末期的物种。有研究表明无性繁殖的植物也具有与有性繁殖植物同样的高的遗传变异水平,比如无性繁殖植物沙鞭(Psammochloavillosa)具有91.67%特异性基因型,其居群间遗传分化系数Gst为62.16,居群间具有很高的遗传变异[25]。小蓬竹系无性繁殖为主,本研究认为它表现出丰富的遗传多样性的原因可能是:一,在进化过程中保留了广泛的遗传基础,或在后期的自然选择中产生了丰富的遗传变异;二,体细胞突变,体细胞突变是无性繁殖为主的植物遗传变异的一个持续来源,以体细胞突变的高发生率补偿重组的缺失,从而适应环境的变化。
从单个居群来看,基于PPL、Nei’s基因多样性H、Shannon’s多样性指数分析的居群遗传多样性结果是一致的,即落湾(ZY1)居群的遗传多样性水平最高(PPL=60.95%,H=0.232 9),桃坡(PT1)居群遗传多样性水平最低(PPL=44.76%,H=0.170 0)。作者实地考察发现,所有居群都受到不同程度的自然或人为的破坏。在遗传多样性较高的落湾居群,小蓬竹曾经大片分布,生长状况良好。但在本试验组到落湾采样的前一年,当地遭遇了大旱,成片小蓬竹缺水致死,已由过去的满山分布变成现在的斑点分布。若不及时维护,其种群数量可能越来越小;相反,遗传多样性最低的桃坡居群是在平塘景区内且邻水,生境条件相对优越。生境恶劣的居群遗传多样性高,生境优越的居群遗传多样性低,这种情况可能是小蓬竹主要进行无性繁殖造成的。小蓬竹为一次性开花竹种,主要进行无性繁殖,只有环境极端时才会开花。但是生境若得不到及时改善,即使形成种子也难以恢复被破坏的种群。
遗传分化系数是居群间的遗传变异与总遗传变异的比值,是判断遗传变异的主要来源。小蓬竹基于Nei’s多样性指数的基因分化系数Gst为0.323 1,略低于基于Shannon’s多样性指数估计的分化系数0.342 9,但均说明:小蓬竹居群内的遗传多样性比居群间的遗传多样性高。同时由于地理隔离,小蓬竹居群间存在一定的遗传分化。
基因流是影响居群内部和居群间遗传变异程度的重要因素[26],一般,较大基因流能够阻止居群间的遗传分化,即基因流大的物种,居群间的遗传分化就小,而小基因流的物种,种群间的遗传分化就大。当Nm>1时,说明种群间存在一定的基因流动[27]。本试验结果分析显示,小蓬竹居群水平上的基因流(Nm)为1.047 8>1,说明小蓬竹居群间存在基因流动,居群间的遗传分化较小,这与实验所得居群间、居群内的遗传多样性和遗传分化系数分析结果相一致。而本实验所用小蓬竹材料为小蓬竹野外天然林,表明小蓬竹存在自然的有性繁殖现象,且小蓬竹主要分布在喀斯特高山山区,花粉可借助风力远距离传播,以实现小蓬竹居群间一定程度的基因交流,这也是小蓬竹居群间遗传分化小于种群内的一个重要原因。

