MLN4924对索拉非尼耐药肝细胞癌细胞中neddylation修饰的抑制作用
孙 杰,刘 淦,李因茵,陆荫英
肝癌是世界发病率第六位高的癌症,肝癌患者病死率在所有癌症中位居第二,肝细胞癌(hepatocellular carcinoma, HCC)是发病数最高的肝癌亚型,约占80%~90%。目前HCC的治疗主要依赖于外科手术,局部区域和系统性治疗方法[1-2]。在HCC早期阶段,主要运用外科手术对肝脏进行切除和移植;在中期阶段,主要采用消融疗法以及肝动脉化疗栓塞术等局部区域治疗,这些方法既能够与外科手术相互结合,也能够用于不适合手术的病例;在HCC的晚期阶段,对于不可进行肝切除或具有转移性HCC的患者,索拉非尼是惟一的一线系统性靶向药物。索拉非尼是口服的多靶点、多激酶抑制剂,于2007年被美国FDA批准用于HCC的治疗[3]。尽管HCC具有很多治疗手段,但患者的预后水平整体较差,仅有10%的HCC患者生存期超过5年。肿瘤复发是患者肝切除后5年内面临的一个巨大问题,而索拉非尼仅能延长约3个月的生命,对晚期HCC的治疗作用十分有限[4-5]。因此,综合与深入的研究HCC的发生、发展机制,开发新型有效的治疗手段,对于HCC患者的治疗和预后具有重要意义。
类泛素化修饰neddylation是一种蛋白质的翻译后修饰,能够调控细胞周期、细胞代谢和细胞内信号转导。蛋白质的neddylation修饰异常与肿瘤的发生、发展密切相关[6-7]。neddylation是由泛素激活酶E1,泛素偶联酶E2和泛素连接酶E3所介导的三步酶联反应组成。首先,神经前体细胞表达的发育性下调蛋白8(neuronal precursor cellexpressed developmentally down-regulated protein 8, NEDD8)通过其C端的甘氨酸与泛素激活酶NAE的半胱氨酸活性位点形成一个高能硫酯键。其中,泛素激活酶NAE是由泛素样修饰酶激活酶 3(ubiquitin like modifier activating enzyme 3,UBA3)与淀粉样前体蛋白结合蛋白1(amyloid precursor protein-binding protein 1, APPBP1) 组 成的异源二聚体。随后,经过转硫醇活化反应,活化的NEDD8被转移至泛素结合酶UBC12(ubiquitinconjugating enzyme E2M)上。最后,泛素连接酶E3将NED88转移到底物蛋白上完成对特异蛋白的neddylation 修饰[8]。
MLN4924是近年来发现的一种neddylation小分子蛋白抑制剂,能够抑制癌细胞的增殖和迁移,在临床前研究中具有显著的抗癌功效,目前已经进入了部分实体肿瘤和恶性血液病的Ⅰ期临床试验[9-13]。MLN4924能够通过与泛素激活酶NAE的结合产生共价化合物,从而抑制其活性,导致底物积累,进而引发DNA损伤反应,细胞周期停滞,细胞凋亡,以及细胞的自噬和衰老,抑制肿瘤细胞的生长[10,14]。但neddylation在HCC发生、发展中的作用,以及MLN4924在治疗HCC中的功效目前并不完全清楚。因此,本课题组对MLN4924在具有索拉非尼耐药性HCC细胞中的抗癌效果和机制进行研究。
1 材料与方法
1.1 材料 HepG2和Huh-7细胞系购自美国ATCC细胞库。抗NEDD8,APPBP1和Actin抗体购自Abcam公司。抗UBA3抗体购自GeneTex。抗UBC12抗体购自于Cell signaling。CCK试剂盒购自碧云天生物技术有限公司。索拉非尼和MLN4924抑制剂购自Selleckchem公司。
1.2 方法
1.2.1 细胞的培养 HepG2和Huh-7细胞培养条件为含10%胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素的DMEM培养基,细胞培养在37 ℃,5 %CO2培养箱中。
1.2.2 CCK检测细胞增殖 取对数生长期 HepG2或Huh-7 细胞,以每孔 2000个细胞接种于 96孔板,每孔加150 μl培养基,细胞接种24 h后,按照实验设计的浓度梯度(0/0.25/0.50/1.00 μM)加入抑制剂MLN4924,培养后每孔加入 CCK-8 溶液 10 μl,继续培养 1~2 h;在酶标仪上测量各孔吸光度值,测定波长450 nm,记录结果并绘制细胞增殖曲线。
1.2.3 蛋白印迹实验 将HepG2和Huh-7细胞裂解后进行蛋白 SDS-PAGE,将胶浸泡于电转液中(Tris 25 mM,甘氨酸 190 mM,20% 甲醇),电泳结束后将蛋白转移至硝酸纤维素膜上,加入10%牛奶封闭1 h,加入封闭液稀释(抗体稀释倍数为1∶1000)的一抗后4 ℃过夜。用TBST(50 mM Tris-HCl,150 mM NaCl,1% 吐温 20) 洗涤 3 次,加入封闭液稀释的二抗,37 ℃孵育1 h,洗涤3次,最后用ECL显色。
1.2.4 索拉非尼耐药细胞的建立 在HepG2 和Huh-7细胞培养基中添加终浓度为0.25 μM的索拉非尼,初期每周更换1次培养基,中后期根据细胞汇合浓度提高换液频率。在建立初期,以48 h作为细胞传代周期;筛选4周后,培养皿中仅存活少量耐药细胞,将存活的耐药细胞消化并转移至规格适宜的培养皿中,以避免细胞密度过低影响生长状态;继续保持索拉非尼药物压力进行持续培养,并在细胞汇合度到达70%~80%时进行传代。经过6~7个月的培养,获得具有在终浓度为0.25 μM的索拉非尼压力下生存、传代能力的耐药细胞,我们在文中称之为HepG2-Sora和Huh-7-Sora[15]。
2 结 果
2.1 耐药HCC细胞的NEDD8修饰通路高度活化 用索拉非尼刺激HepG2和Huh-7 HCC细胞,检测野生型细胞与索拉非尼耐药细胞中NEDD8的表达量变化。结果显示,与野生型HepG2和Huh-7细胞相比,索拉非尼耐药的HepG2-Sora和Huh-7-Sora细胞中NEDD8的蛋白表达量明显升高(图1A)。同时我们检测了与neddylation修饰相关的多个蛋白的表达变化。结果显示APPBP1、UBA3 和UBC12的表达在耐药细胞株中都有明显上调(图1B)。以上结果提示,与野生型细胞相比,索拉非尼耐药HCC细胞中NEDD8修饰通路活化。
2.2 MLN4924抑制细胞增殖的剂量依赖性 为了检测neddylation通路活化对索拉非尼耐药细胞增殖的影响。我们用不同浓度的索拉非尼(0~4 μM)处理HepG2和Huh-7野生型与耐药型细胞株,然后再用不同浓度的NEDD8活化激酶抑制剂MLN4924处理细胞。通过检测细胞增殖情况,我们发现在索拉非尼处理细胞之后,再加入不同浓度的MLN4924 能够进一步抑制细胞的增殖,并且抑制作用随着MLN4924抑制剂浓度的增加而增强(图2)。提示MLN4924能够抑制索拉非尼耐药细胞的增殖。
2.3 MLN4924抑制细胞增殖的时间依赖性 分别检测用2 μM索拉非尼处理后的耐药细胞HepG2-Sora和Huh-7-Sora,再经MLN4924处理24 h、48 h、72 h和96 h后细胞的增殖情况。结果显示,Huh-7-Sora受MLN4924处理后细胞增殖明显减弱,且随着时间增加抑制效果增强(图3)。HepG2-Sora在MLN4924处理后24 h,细胞增殖就明显减弱,随着时间的延长抑制作用变化不明显(图3)。
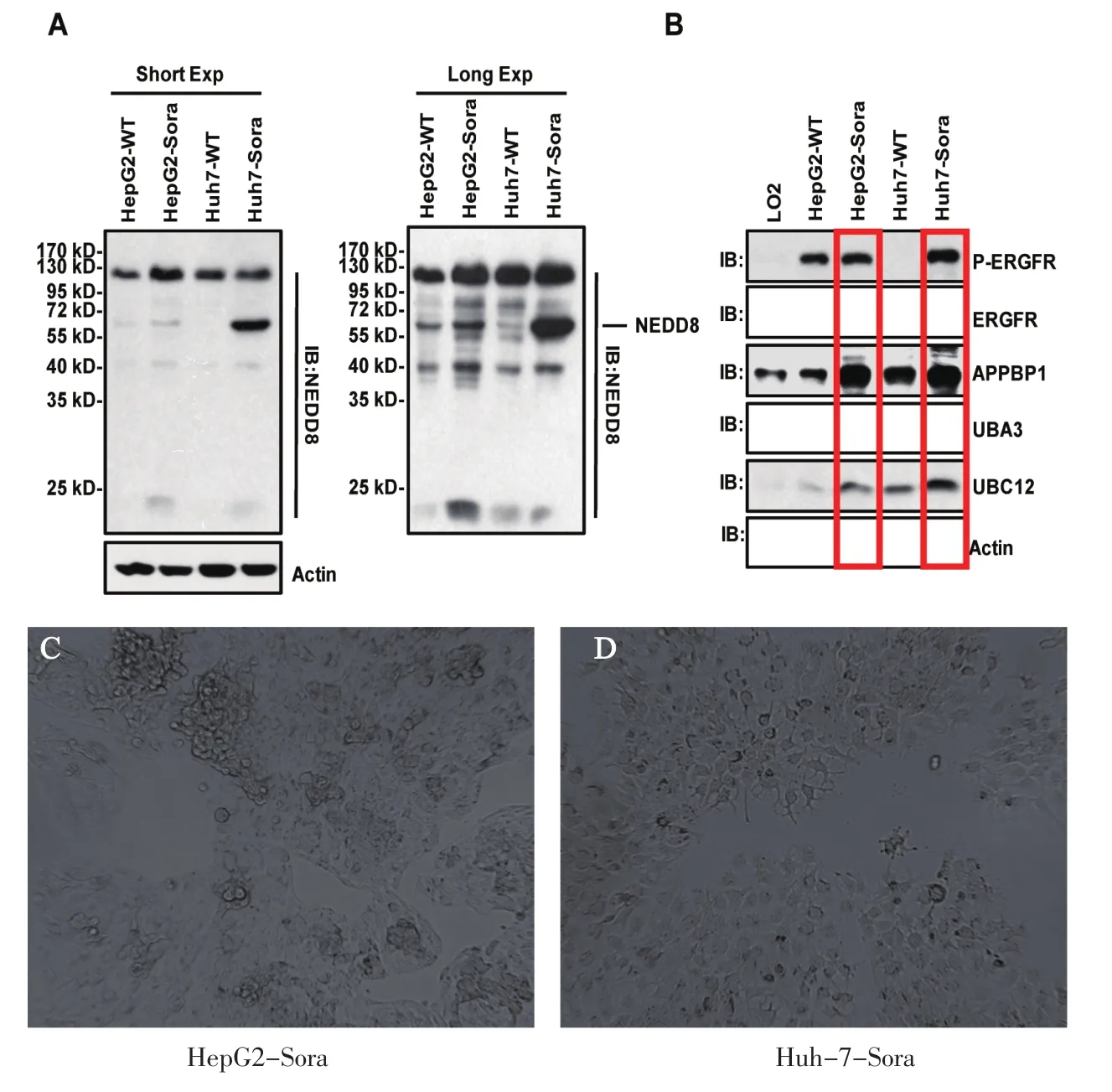
图1 耐药HCC细胞的NEDD8修饰上调Short Exp.索拉非尼短期刺激(8 h);Long Exp.索拉非尼长期刺激(48 h);HepG2-WT.野生型HepG2;HohT-WT.野生型HohT-7Figure 1 NEDD8 modification is upregulated in sorafinib-resistant HCC cells
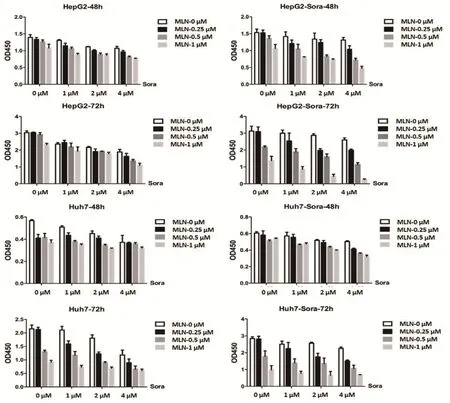
图2 MLN4924抑制索拉非尼耐药细胞的增殖Figure 2 MLN4924 inhibits the proliferation of sorafinib-resistant cells
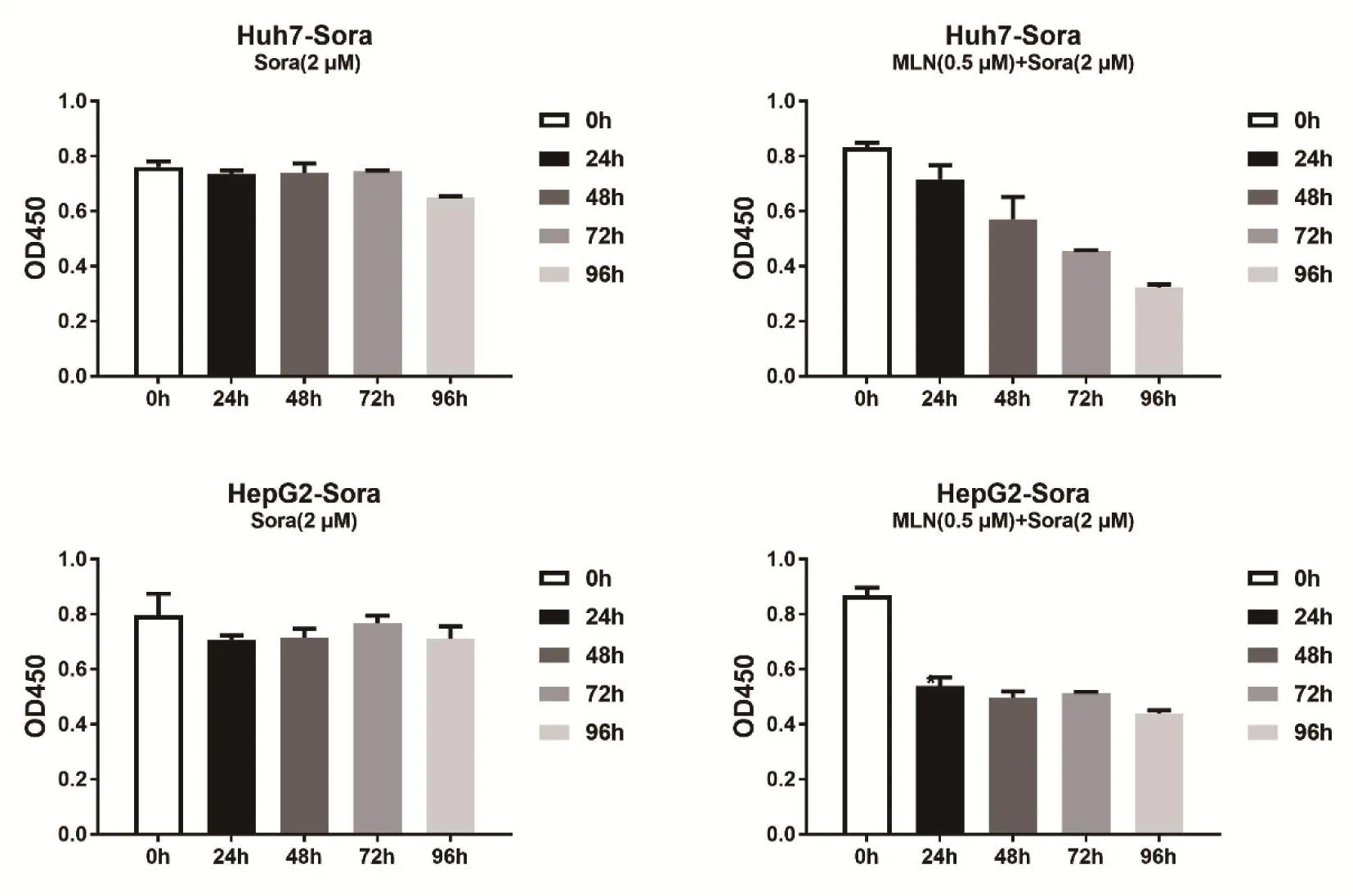
图3 MLN4924抑制细胞增殖的时间依赖性Figure 3 Time-dependent manner of MLN4924 inhibiting cell proliferation
2.4 MLN4924抑制耐药HCC细胞的neddylation修饰 考虑到MLN4924对索拉非尼耐药细胞增殖的抑制作用,我们接下来检测了经MLN4924处理后索拉非尼耐药细胞中neddylation修饰的变化情况。通过蛋白印迹实验,发现MLN4924处理后的索拉非尼耐药细胞中NEDD8的表达量显著减少,并且随着MLN4924浓度的增强NEDD8表达减弱的更加明显(图4)。综上,MLN4924能够抑制索拉非尼引起的neddylation通路的活化,进而抑制HCC细胞的增殖。
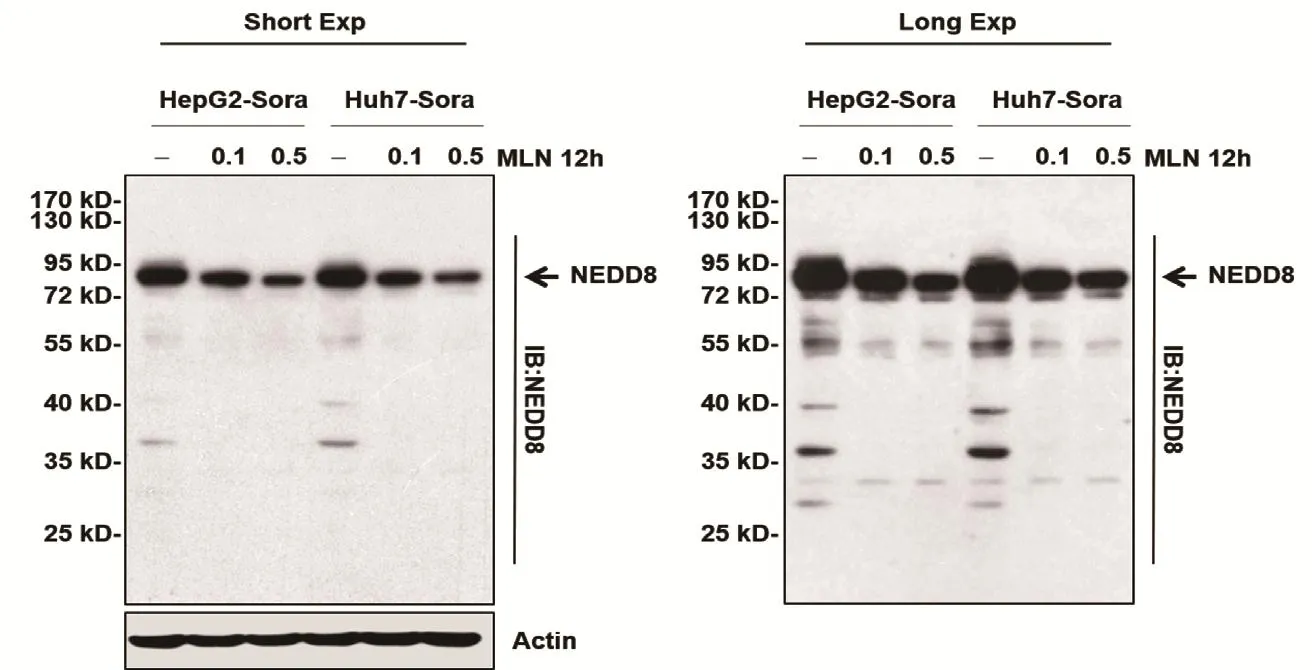
图4 MLN4924抑制索拉菲尼耐药HCC细胞的neddylation修饰Short Exp.索拉非尼短期刺激(8 h);Long Exp.索拉非尼长期刺激(48 h)Figure 4 MLN4924 inhibits neddylation modification in sorafinib-resistant HCC cells
3 讨 论
全球每年HCC新发病例数约80万人,死亡人数约78万,我国HCC统计数据约占全球统计数据的55%[16]。索拉非尼作为惟一的一线靶向治疗药物,主要通过两种方式发挥作用:一方面能够抑制血管内皮生长因子受体和血小板源性生长因子受体,阻碍肿瘤新生血管的生成,减少肿瘤生长所依赖的氧气、能量的供给;另一方面,能够阻断肿瘤细胞中重要信号通路的转导,抑制肿瘤细胞增殖[17]。然而,索拉非尼对晚期HCC的治疗作用十分有限,其在HCC中的反应率还有待提高[18]。主要原因在于HCC具有高度异质性,HCC的发生、发展与多个信号通路的激活相关,对癌细胞内单一信号通路的调控不足以达到良好的治疗效果;因此,开发新型有效的治疗手段刻不容缓。
细胞内neddylation的失调可导致癌症的发生,MLN4924作为一种neddylation小分子蛋白抑制剂,其在癌症治疗中的作用受到广泛关注。有研究报道,MLN4924能够抑制HepG2和Huh-7细胞系中mTOR信号通路的活性,诱导HCC细胞的自噬和凋亡[19];并且在人HCC异种移植小鼠模型中,MLN4924表现出了显著的抗癌效果[19]。我们的研究发现,索拉非尼耐药HCC细胞HepG2-Sora和Huh-7-Sora的NEDD8修饰通路高度活化,MLN4924能够通过抑制耐药细胞株的neddylation,从而抑制其细胞增殖。MLN4924对索拉非尼耐药细胞株HepG2-Sora的生长抑制效果具有剂量和时间依赖性;而对Huh-7-Sora的抑制效果仅具有剂量依赖性,没有显著的时间依赖性。MLN4924的单独用药,以及与索拉非尼的联合用药均为HCC治疗提供新思路。
其他种类癌症的相关研究表明,MLN4924能够阻碍胃癌与肾癌细胞的生长和迁移,这主要是通过抑制细胞中Clluin1的neddylation,使Cullin-RING连接酶失活,引发下游多种底物的积累,造成DNA损伤以及细胞周期阻滞[20-21];MLN4924也能够抑制人食管鳞状细胞癌,MLN4924处理导致G2细胞周期阻滞,并增强Wee1样蛋白激酶,周期素依赖性激酶抑制剂1A/B和p27的蛋白稳定性[22];在针对复发性淋巴瘤和多发性骨髓瘤的Ⅰ期临床试验中,MLN4924表现出了预期的药效和安全性[23]。
综上,MLN4924通过抑制细胞内neddylation的修饰,减少了索拉非尼耐受HCC细胞系的生长增殖。我们的研究为HCC细胞的耐药性及MLN4924的作用机制提供了理论依据,为未来HCC治疗手段和策略的开发提供了新的思路。

