Hp感染对非酒精性脂肪肝患者血管内皮功能及颈动脉粥样硬化的影响*
范存芳,刘振东
非酒精性脂肪性肝病 (nonalcoholic fatty liver disease,NAFLD)是指除外乙醇和其他明确损肝因素所致的、以弥漫性肝细胞大泡性脂肪病变为主要特征的临床病理综合征。目前我国NAFLDA患病率已达26%[1],已经成为慢性肝病的主要原因。幽门螺杆菌(Helicobacter pylori,Hp)是一种定置于胃黏膜的革兰阴性菌,研究发现,Hp感染与动脉粥样硬化(atherosclerosis,AS)的产生具有相关性[2],可促进颈动脉硬化的发生与发展[3]。该研究旨在通过分析Hp感染与AS相关危险因子之间的关系,评估Hp感染对NAFLD患者血管内皮功能及颈动脉粥样硬化的影响,探讨Hp感染在NAFLD患者动脉硬化进程中的影响及其作用机制,为NAFLD的综合防治提供新的理论依据。
1 资料与方法
1.1 一般资料选择2017年6月—2018年5月在笔者所在医院体检中心体检的NAFLD患者共248例,其中男 156例,女 92例;平均年龄(49.17±9.67)岁。其中13C-UBT阳性者为感染组,男80例,女48例;平均年龄(48.71±9.95)岁。13C-UBT阴性者为非感染组,男 76例,女 44例;平均年龄(48.63±9.48)岁。两组间一般资料无显著性差异。NAFLD诊断标准:所有NAFLD患者的诊断均符合中华医学会肝脏病学分会2010年修订的 《非酒精性脂肪性肝病诊疗指南》标准[4]。以上人群均测量血压、身高、体重、腹部彩超、空腹血糖、血脂、高敏C-反应蛋白(hs-CRP)、同型半胱氨酸(Hcy)、一氧化氮(N0)和内皮素-1(ET-1)检查。 排除标准:(1)酒精性肝病、慢性病毒性肝炎、自身免疫性肝病、肝豆状变性、甲状腺功能减退、外周血管疾病、饮酒(折合乙醇量男性每周≥140 g,女性每周≥70 g)、近一周服用影响血管舒缩功能药物;(2)6个月内已明确消化性溃疡病史、胃炎病史、消化道出血病史、近期患感染性疾病及慢性炎症性疾病;(3)有肝脏手术史、胃部分或全部切除史;(4)患恶性肿瘤,严重心、肺、肝、肾功能衰竭患者;(5)不能提供知情同意书者。该研究通过医院伦理委员会同意和批准。
1.2 Hp感染检测利用13C-UBT检测Hp,受试者需空腹或禁食2 h以上,维持正常呼气,上午8:00~9:00时先收集0 min呼气,用80~100 ml凉水服用一粒尿素胶囊(含13C 75 mg),按要求收集服药后30 min的呼气,进行13C-UBT测定,结果超基准值(DOB)≥4为Hp感染阳性。
1.3 肱动脉内皮功能检测采用GE LOGIQ E9彩色多普勒超声诊断仪,线阵探头,频率7~12 MHz。受试者保持空腹状态,禁茶、咖啡等1 d,正在使用ACEI,CCB,β受体阻滞剂者至少停药1 d。受试者至少休息10 min后,取仰卧位,测右侧肘上2~5 cm的肱动脉血管舒张末期内径,在心电图示R波对应处连续测量4个心动周期,取平均值为肱动脉基础内径(D0),然后用血压计袖带充气加压于右上臂至收缩压后再加压约50 mmHg,持续5 min后放气,60 s内测量肱动脉内径(D1);受试者休息5 min后,舌下含服0.5 mg硝酸甘油,4~5 min后测定肱动脉内径(D2)。计算内皮依赖性舒张功能(FMD)及非内皮依赖性舒张功能(NMD)。计算公式分别为:FMD=(D1-D0)/D0×100%,NMD=(D2-D0)/D0×100%。 所有超声测量均由同一超声副主任医师操作。
1.4 颈动脉IMT测定受检者取仰卧位,头部偏向非检查侧,充分暴露颈部,沿胸锁乳突肌外缘,采用纵横两个切面对颈动脉逐段进行扫查,在左心室舒张末期固定颈动脉窦以下10 mm处的图像,每侧测试3个心动周期,颈总动脉后壁表现为由相对较低回声分隔的2条平行亮线,取其间垂直距离,计算左右两侧颈动脉测量的6次平均值即为IMT。并依次探查颈总动脉、颈外动脉、颈内动脉有无斑块及钙化,以及斑块的数量。若发生局部隆起增厚,并突向管腔且 IMT≥1.5 mm即诊断为颈动脉斑块形成。
1.5 实验室检查所有受试者均需过夜禁食水8~12 h,取其晨起空腹肘静脉血5 ml,分离出血清,采用瑞士罗氏MODULARP800全自动生化分析仪检测三酰甘油(TG)、总胆固醇(CH)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、空腹血糖(BS)、hs-CRP、Hcy;采用酶联免疫吸附法检测ET-1,采用硝酸还原酶法检测NO。
1.6 统计学方法采用SPSS 16.0统计软件,计量资料用(±s)表示,计数资料用(%)表示。 两组间计量资料比较采用t检验,计数资料比较采用χ2检验。取P<0.05为差异有统计学意义。
2 结果
2.1 两组患者合并症情况比较两组间合并高血压、高脂血症、脑卒中、糖尿病、吸烟、肥胖、服用他汀类降脂药的临床基本资料比较差异均无统计学意义(P>0.05),具有可比性。 见表 1。
2.2 两组患者血压、体质量指数(BMI)及生化指标比较感染组 TG、CH、LDL-C、BS、Hcy、hs-CRP 高于非感染组,差异具有统计学意义(P<0.05);两组血压、BMI、HDL-C 差异无统计学意义(P>0.05)。见表 2。

表1 两组患者合并症情况比较[例(%)]
2.3 两组患者内皮功能及动脉硬化指标比较感染组的血N0、肱动脉FMD、NMD显著低于非感染组,差异具有统计学意义(P<0.05);与非感染组比较,感染组血ET-1水平显著升高,IMT显著增厚,感染组的斑块检出率 (37.5%)高于非感染组(25.0%),差异具有统计学意义(P<0.05)。 见表 3。
表2 两组患者BMI、血压及临床生化指标比较(±s)
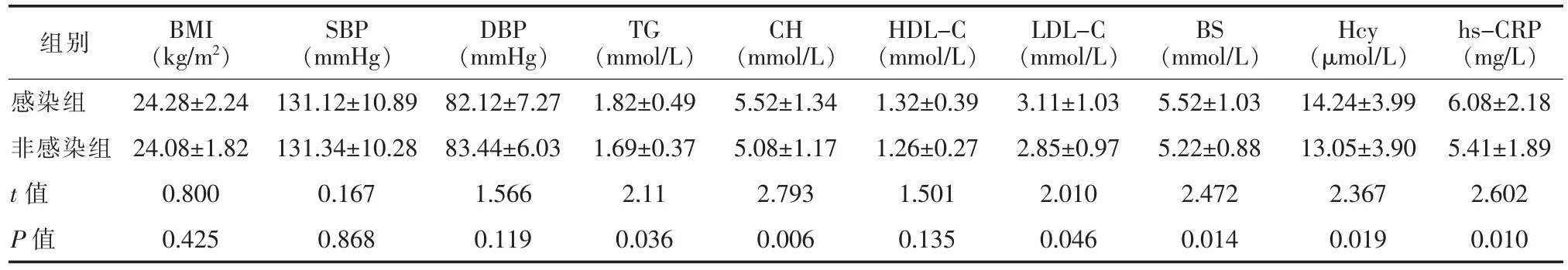
表2 两组患者BMI、血压及临床生化指标比较(±s)
注:SBP:收缩压;DBP:舒张压。
hs-CRP(mg/L)感染组 24.28±2.24 131.12±10.89 82.12±7.27 1.82±0.49 5.52±1.34 1.32±0.39 3.11±1.03 5.52±1.03 14.24±3.99 6.08±2.18非感染组 24.08±1.82 131.34±10.28 83.44±6.03 1.69±0.37 5.08±1.17 1.26±0.27 2.85±0.97 5.22±0.88 13.05±3.90 5.41±1.89 t值 0.800 0.167 1.566 2.11 2.793 1.501 2.010 2.472 2.367 2.602 P值 0.425 0.868 0.119 0.036 0.006 0.135 0.046 0.014 0.019 0.010组别 BMI(kg/m2)SBP(mmHg)DBP(mmHg)TG(mmol/L)CH(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)BS(mmol/L)Hcy(μmol/L)
表3 两组患者内皮功能及动脉硬化指标比较(±s)
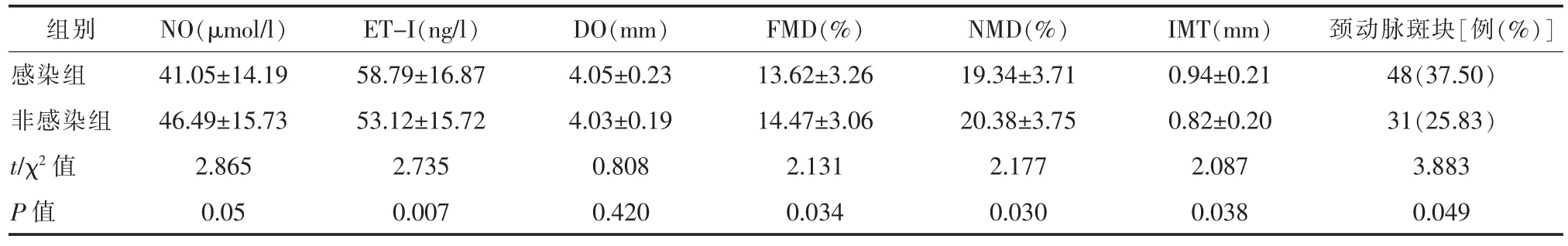
表3 两组患者内皮功能及动脉硬化指标比较(±s)
组别 NO(μmol/l)ET-I(ng/l)DO(mm)FMD(%)NMD(%)IMT(mm)颈动脉斑块[例(%)]感染组 41.05±14.19 58.79±16.87 4.05±0.23 13.62±3.26 19.34±3.71 0.94±0.21 48(37.50)非感染组 46.49±15.73 53.12±15.72 4.03±0.19 14.47±3.06 20.38±3.75 0.82±0.20 31(25.83)t/χ2值 2.865 2.735 0.808 2.131 2.177 2.087 3.883 P值 0.05 0.007 0.420 0.034 0.030 0.038 0.049
3 讨论
NAFLD与代谢综合征 (metabolic syndrome,MS)各组密切相关[5],是 MS 在肝脏的一种临床表现。越来越多的证据表明,NAFLD的临床负担并不局限于肝脏相关的发病率和病死率,心血管疾病是其主要的死亡原因[6]。Hp感染可能通过引起MS加重从而影响到NAFLD的发展[7]。MS最重要影响的靶器官是心脏和血管,分别促进冠心病和动脉硬化的发生与发展。最近,越来越多的研究提示,Hp感染与颈动脉粥样硬化的发生关系密切。Hp感染者发生颈动脉粥样硬化狭窄的危险性更大[8]。
颈动脉硬化是多种危险因素相互作用引起的,目前已经证实,年龄、吸烟、高血压、高血脂、糖尿病、高Hcy血症等都是引起AS的危险因素。该研究中感染组血清TG、CH、LDL-C水平均显著高于非感染组,提示Hp感染可加剧血脂代谢紊乱,可能是一个通过调整脂质代谢模式促进AS的易感因素。Hcy是一种反映血管损伤的氨基酸,高Hcy血症参与AS等血管损伤的早期发病,是AS性疾病的独立危险因子与预测因素[9]。其水平越高,心血管疾病的危险性也越大[10]。该研究中感染组Hcy水平显著高于非感染组,其原因可能是Hp感染相关消化系统疾病可能导致叶酸和B族维生素吸收障碍,而叶酸和B族维生素在半胱氨酸的代谢中发挥重要作用,其缺乏致使血液中Hcy滞留堆积,造成高Hcy血症,引起血管内皮细胞损伤,导致血管内皮细胞功能减退,同时刺激血管平滑肌细胞异常增殖和迁移,促进脂质代谢紊乱,诱导氧化应激及炎症反应,最终导致颈动脉粥样硬化病变的产生[11]。
AS是众多危险因子损伤血管内皮而引起的一系列慢性炎症反应的产物。Hs-CRP是由肝脏生成的血浆蛋白,是临床炎症反应相关疾病诊断敏感指标之一,也是AS早期形成生物学标志之一[12],可用于预测心血管危险事件[13],现代医学认为它参与AS发生、发展过程。该研究中Hp感染组的hs-CRP水平高于非感染组,表明Hp感染与炎症反应存在关联。机体感染Hp后处于一种慢性、持续、低水平的炎症状态,通过刺激释放炎症因子如白细胞介素、肿瘤坏死因子(TNF)等,从而诱发全身非特异性反应明显增强,加重血管内皮受损,进而加速AS的发生[14]。
AS是一种全身性弥漫性病变,可同时累及冠状动脉、颈动脉及其他动脉,通过了解外周动脉粥样硬化病变状态可在一定范围内反映并预测冠状动脉粥样硬化病变及其严重程度。研究表明血管内皮功能受损和外周动脉内中膜厚度增加,是AS形成的早期标志,是促进AS发生和发展的重要始动因素[15];颈动脉斑块形成则是 AS 的标志[16]。 内皮细胞具有重要的内分泌和生理功能,通过代谢、生成、激活和释放多种血管活性物质(如血管收缩性介质ET、血管舒张性介质NO),参与局部和全身血管功能的调节,在心血管系统稳态调节中发挥重要作用。目前血NO和ET-1是实验室评价血管内皮功能常用的指标。该研究中发现:感染组血NO低于非感染组,ET-1的水平明显高于非感染组,表明Hp感染造成血管内皮损伤、功能障碍、分泌失衡。NO、ET-1等的失衡使血管通透性增大、张力增加、收缩异常、血小板黏附和聚集、凝血活性增强、血栓形成、平滑肌细胞增生、血管壁粗糙及内中膜增厚,AS发生发展加剧。
应用超声通过检测肱动脉FMD、NMD来评价全身性血管内皮功能状态的方法已成为现今国际上通用的检测血管内皮功能的方法。外周血管内皮功能可反应全身动脉内皮功能,具有潜在的诊断“窗口”作用。该研究中感染组的FMD、NMD均显著低于对照组,表明Hp感染促进了NAFLD患者血管内皮的损伤,引起了血管内皮功能障碍,增加了NAFLD患者发生心脑血管病的风险。颈动脉病变作为全身动脉粥样硬化的一部分,是冠状动脉病变和心脑血管终点事件的有效预测因子[17],该研究中感染组颈动脉IMT较非感染组显著增厚,斑块检出率也明显高于非感染组,提示NAFLD患者AS的发生与Hp感染有关,Hp感染促进动脉粥样硬化的发生发展,与近年的一些研究结果一致[18]。
综上所述,Hp感染会进一步加重NAFLD患者内皮功能的损伤和AS的程度,增加了发生心脑血管事件的风险。目前Hp感染与NAFLD相互作用的具体机制未明确,有研究认为Hp感染可能通过增加胰岛素抵抗(IR)、介导炎性因子、影响脂质代谢、改变肠道通透性等影响NAFLD的发生与发展[19]。我国 Hp 的感染率高达 23%~63%[20],NAFLD 患者中Hp感染率更高[21],因此,除了关注肥胖、高血压、糖脂代谢紊乱外,还应关注NAFLD患者Hp感染情况,Hp感染是一种可治愈性疾病,为NAFLD的治疗及降低NAFLD患者未来心血管事件的发生提供了一种可能的手段。

