GB/T 16886.5—2017中体外细胞毒性试验的比较与分析
徐玉茵,韩 颖,田林奇,周 静,魏 聪,张丹丹
(河南省医疗器械检验所,河南省医疗器械检验检测工程技术研究中心,郑州 450000)
0 引言
医疗器械在进入临床试验或获得监管审批前必须要经过非临床安全评估(包括生物相容性评价),以确保其安全性。医疗器械生物相容性评价通常根据产品特性、预期用途以及与机体接触的类型和持续时间进行试验项目的选择,包括细胞毒性、刺激和致敏等试验,试验结果与产品的机械和理化性质一起用于评价材料与机体接触时的生物学反应。一般而言,我国医疗器械非临床安全性评估的生物相容性评价试验的选择通常依据GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》[1]。
体外细胞毒性试验是医疗器械生物学评价体系中最重要的检测项目之一,通过使用体外细胞培养系统检测医疗器械或其浸提液可能造成的细胞生长抑制、细胞代谢障碍和细胞形态异常等。GB/T16886.5—2017《医疗器械生物学评价 第5部分:体外细胞毒性试验》是目前国内评价医疗器械细胞毒性的通用标准,其描述了评定医疗器械体外细胞毒性的试验方法[2]。由于标准中推荐的体外细胞毒性方法均为标准化试验方案,其试验结果具有可比性,且能在进行体内试验前快速识别潜在有害物质。此外,与动物试验相比,体外细胞毒性试验由于细胞直接与被测样品或其浸提液接触,因而具有较高的灵敏度[3]。体外细胞毒性试验提供了一种快速、灵敏、经济和标准化的方法来评价材料是否具有潜在的生物危害性。
由于GB/T 16886.5—2017中涉及的几种试验的试验方法各不相同,同一种器械的细胞毒性结果可能会因试验方法选择的不同而略有差别。此外,被测器械的类型具有多样性,从固体到气体、从单一材料到复合材料、从单独使用到组合使用等,因此试验样品的制备也会对试验结果产生影响。本文通对GB/T 16886.5—2017涉及的各试验方法中关于样品制备、试验方法和结果判定的差异进行探讨,为医疗器械生物学评价的试验选择提供参考。
1 样品制备
GB 16886系列标准中推荐对医疗器械上存在的可浸提或可沥滤化学物质进行检测、鉴定、定量和风险评估。试验通常选择最终产品或取自最终产品中有代表性的部分进行检测,以评估所有可浸提或可沥滤的物质。对于医疗器械而言,试验样品可以是器械或器械的浸提液。样品的制备应根据GB/T 16886.12—2017《医疗器械生物学评价 第12部分:样品制备与参照材料》[4]。浸提应模拟或加严使用条件,在条件允许的情况下,液体浸提液应在制备后24 h内使用,以防止吸附或结合到浸提容器上,或成分发生其他变化。浸提时可以使用表面积/体积浸提,也可以使用质量/体积浸提[4]。同时,处置试验样品时应谨防污染,当试验样品需要分割后使用时,应考虑原先没有暴露的表面(如内腔或切面)的影响。对于多组件器械,应主要考虑其与患者接触的部分以及试验组件部分是否能反映最终产品的特征[4]。
1.1 固体样品的制备
对于固体样品,其潜在的细胞毒性可以通过间接接触、直接接触和浸提液试验来测定。间接接触试验即琼脂扩散试验,通过将试验样品置于被琼脂层覆盖的哺乳动物细胞层上来进行。在直接接触试验方法中,试验样品直接放置在细胞层上,因而可能会对细胞产生机械性损伤。在浸提液试验方法中,固体样品的浸提介质通常使用含血清的培养基,因为含血清的培养基有支持试验体系中细胞生长的必须介质[3]。在明确要浸提极性物质(例如离子化合物)时,除了含血清培养基,也可以采用无血清培养基[水或二甲基亚砜(DMSO)]。通常,有机溶剂体积分数不应超过1%,含水溶剂(盐水或水)体积分数在最终处理介质中不应超过10%[5]。DMSO具有细胞毒性,其最终使用体积分数不易超过0.5%[6]。因此,与含血清培养基浸提液相比,由于DMSO浸提液稀释度大,可浸提物的细胞接触浓度可能比较低。
1.2 液体样品的制备
根据GB/T 16886.5—2017标准规定,液体试验样品可以通过放置在生物惰性吸水性基质上进行试验[3]。通常,液体试验样品(例如溶于水或生理盐水中)可以以体积分数高达10%的最终浓度添加到试验体系中,但高于该值的浓度会稀释培养基并抑制正常细胞的增长[7]。如果试验样品由非水液体组成或者体积分数超过10%,则需要检查其对细胞正常生长的影响。
2 试验方法及结果判定
根据GB/T 16886.5—2017标准规定,医疗器械体外细胞毒性试验分为定性试验和定量试验2种,详见表1。

表1 GB/T 16886.5—2017规定的试验方法
2.1 定性试验
根据GB/T 16886.5—2017标准规定,有3种试验方法可用于医疗器械细胞毒性的定性评价,分别为浸提液试验、直接接触试验和间接接触试验[3],详见表2。这些方法通过样品的浸提液或琼脂扩散后与细胞间接接触的样品浸提液/可沥滤物或试验样品直接接触细胞,来评估样品的潜在细胞毒性。在选择试验方法时,应尽量模拟临床使用条件,使试验样品中的可浸提物/沥滤物能得到最大程度的释放。例如,如果医疗器械与组织长期接触,则通常选择直接接触法评价其细胞毒性[8]。对于可在浸提中易失活的浸出物或与组织直接接触的器械(例如眼部接触),也推荐使用直接接触法[9]。尽管3种定性方法中样品制备、接触方式、培养时间和染色方法均不同,但所有定性方法通常情况下均使用以下判定标准:(1)细胞形态学改变,如形成空泡、脱落、细胞溶解和胞膜完整性等。当观察到超过50%的细胞呈圆缩、无胞浆内颗粒、有大范围细胞溶解,或超过50%的细胞出现生长抑制现象时,可以认为试验样品有细胞毒性作用。(2)褪色区域面积的大小。当褪色区域超出试验样品下方范围时,可以认为试验样品有细胞毒性作用。(3)细胞毒性反应分级,一般分为0~4级。如果分级小于或等于2级(轻度),则试验样品被认为是无细胞毒性作用[3]。
2.1.1 浸提液试验
浸提液试验使用试验样品浸提液来测定细胞毒性,因此不能用于评价固体样品的潜在机械或物理效应。通常根据临床使用条件选择样品浸提介质和浸提时间,试验时不仅可选用浸提原液,也可以使用以培养基作稀释剂的系列稀释液(通常为12.5%~100%)。通过观察细胞形态变化(如细胞的形态变化或结构的破坏)来评价浸提液的细胞毒性。

表2 GB/T 16886.5—2017规定的定性试验方法
2.1.2 琼脂扩散试验
定性琼脂扩散试验适用于高密度器械和液体器械。通过在近汇合的L929细胞层上覆盖含营养成分的琼脂,并将试验样品(固体样品或置于滤纸片上的样品浸提液)置于琼脂层上。孵育24 h后检查细胞的毒性反应,并用中性红染料染色以区分活细胞和死细胞。琼脂层可保护L929细胞免受试验样品位移造成的机械损伤,且有细胞毒性的沥滤物可通过琼脂层扩散到细胞层中。琼脂扩散测定方法的缺点是一些可沥滤物可能与琼脂结合或不能通过琼脂层扩散,从而导致细胞未完全暴露于测试样品中。
2.1.3 直接接触试验
低密度器械(如隐形眼镜)适合选择直接接触试验,以便更好地模拟临床应用。在该方法中,将试验样品直接置于近汇合的L929细胞层上。在孵育期间,试验样品中的可浸出化学物质扩散到培养基中并直接接触细胞层。孵育结束后,通过观察样品周围细胞形态的改变来判断样品潜在的细胞毒性。因为细胞直接接触试验样品,所以可以用来评估样品潜在的机械损伤作用。直接接触试验的缺点是试验样品在培养容器内的移动不好控制,因此限定的接触区域可能不明显。此外,试验样品与细胞直接接触,会影响细胞对营养成分和氧气/二氧化碳的吸收。
2.2 定量试验
随着检验技术的不断发展,细胞毒性检测逐渐从定性评价演变为定量评价,而定量评价能更灵敏、更精确地反映样品毒性[10]。定量评价可以用客观的方法对细胞数量、蛋白总量、酶的释放、活体染料的还原和其他可测定参数进行定量测试。GB/T 16886.5—2017中概述了MTT/XTT试验、中性红摄取(neutral red uptake,NRU)试验和集落形成(clone forming assay,CFA)试验的方法,详见表3。液体样品或固体样品的浸提液可以用于所有的定量试验,使用以培养基作稀释剂的系列样品浸提稀释液可以用来计算IC50[3]。3种定量试验通常都使用相对于空白对照组的30%变化作为判定标准。
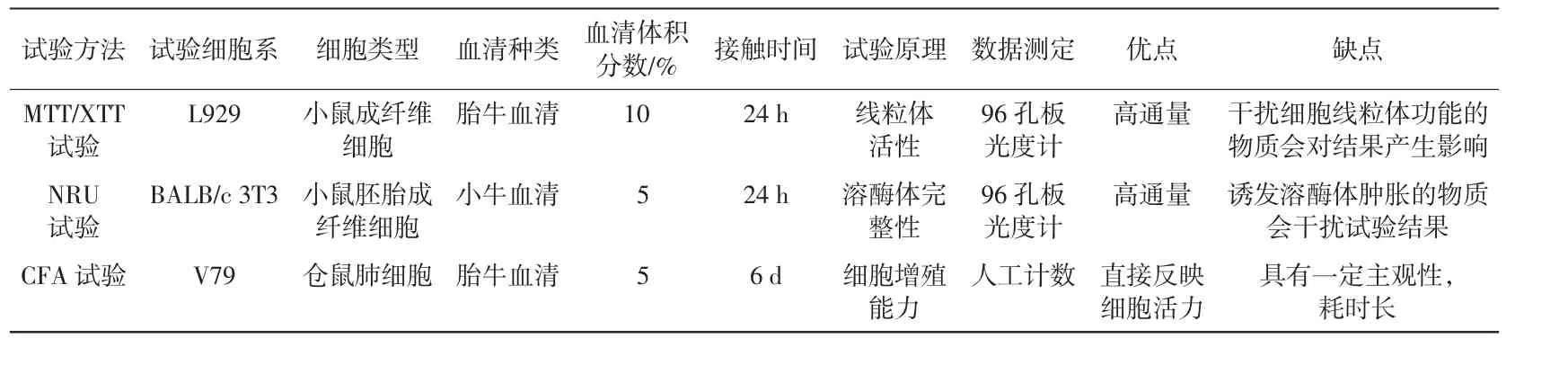
表3 GB/T 16886.5—2017规定的定量试验方法
MTT/XTT试验需要有代谢活性的细胞将底物转化为有色产物,二者的区别在于MTT产生的是不溶性产物,因此需要裂解细胞以溶解甲臜用于定量,而XTT不需要细胞裂解[11]。NRU试验需要细胞具有完整的溶酶体膜,以便外源性染料能被吸收、储存其中[12]。MTT/XTT试验和NRU试验都是使用间接方法测量细胞生长抑制情况,反映的是细胞基本功能(如线粒体、质膜完整性等)受到影响后而导致的细胞损伤或死亡。而CFA试验直接监测细胞与样品接触后产生集落的能力[13]。该试验不受细胞生长抑制或死亡的影响,只要样品影响细胞的增殖,就能检测试验材料的细胞毒性作用[14]。与MTT/XTT试验和NRU试验相比,CFA试验的缺点是培养周期长,需要多个细胞复制周期来检测细胞毒性反应,且使用人工计数集落,结果带有一定的主观性。
2.2.1 MTT试验
MTT试验是一个高通量筛选细胞活力测定方法[15]。试验方法是将L929细胞接种至96孔板,维持培养24 h至形成半汇合单层,然后与以培养基作稀释剂的系列样品浸提稀释液接触,24 h后测定每一试验浓度中是否有甲臜形成,并与对照组细胞的甲臜形成进行比较。如果L929细胞的存活率下降到小于空白对照组的70%,则认为该样品具有潜在的细胞毒性。GB/T 16886.5—2017标准规定,每个96孔板的左、右2列的空白平均值与全部空白平均值的相差小于15%时,试验成立。但这可能导致出现假阳性/阴性的结果,因为如果空白对照组存在15%的变异,则判定细胞毒性标准可能为(30±15)%。
2.2.2 NRU试验
中性红是一种弱阳离子染料,通过溶酶体内非离子扩散穿透细胞膜,从而累积在细胞内。当溶酶体受损时,吸收和结合中性红的能力降低,渗入活细胞内的中性红浓度与活细胞数量成正比。因此,溶酶体完整性是检测细胞活力的一个灵敏指标,可以根据细胞溶酶体渗入染料的能力来区分活细胞、受损细胞或死细胞[12]。试验方法是将BALB/c 3T3细胞接种到96孔板中并持续培养24 h,直至形成半汇合单层,再与以培养基作稀释剂系列样品浸提稀释液接触24 h后,加入NRU培养基孵育。活细胞能摄取NRU,且渗入细胞中的NRU与具有完整溶酶体膜的细胞数量成正比。当样品组吸光度值减少至小于空白对照组的70%时,则认为样品具有潜在的细胞毒性。但一些能够诱导溶酶体肿胀的物质,常会导致假阴性的结果[16]。
2.2.3 CFA试验
CFA试验是检测细胞增殖能力的有效方法之一,其原理是单个活细胞在体外连续增殖6代以上,从而形成集落(>50个细胞),而死细胞或不能再分裂的细胞则丧失增殖能力[17]。CFA试验通过计算集落形成率,来测定细胞的增殖能力。CFA试验主要包括制备单细胞悬液和平板接种、与以培养基作稀释剂的系列样品浸提稀释液接触6 d、在孵育后使用Giemsa染色集落3个步骤。当样品的平板效率减少至小于空白对照组的70%时,则认为样品具有潜在的细胞毒性。与其他定量试验相比,CFA试验耗时较长,且在显微镜下手动计数集落数时难以保证其客观性。此外,GB/T 16886.5—2017标准中没有区分集落大小,只规定了计数超过50个细胞的集落数目,因而可能忽略了暴露于样品后产生的相对较小的集落所反映的细胞毒性。
3 结语
与体内试验相比,医疗器械的体外细胞毒性评价具有在短时间内快速筛选材料潜在毒性、节约试验成本等优点,主要包括3种定性方法(浸提液试验、琼脂扩散试验和直接接触试验)和3种定量方法(MTT/XTT试验、NRU试验和CFA试验)。虽然定量方法不易受到试验者主观因素的影响且具有高度灵敏性,但需要结合体内试验来控制假阳性/阴性细胞毒性结果。因为在多数情况下,体外细胞毒性中使用的接触浓度与实际在体内达到的最大浓度几乎没有关系。因此,应谨慎将体外细胞毒性结果外推[18]。
综上,选择合适的体外细胞毒性试验对于正确评价样品的潜在毒性至关重要。本文通过比较GB/T 16886.5—2017标准规定的细胞毒性检测方法,为试验的选择提供参考。虽然需要重视体外细胞毒性反应,但它只代表对局部器官或组织的潜在毒性,且单纯的细胞毒性数据不能用于判定器械是否适合临床应用。因此,应将体外细胞毒性试验的结果与其他生物相容性试验的结果结合,以获得对医疗器械更准确的生物风险评估。

