心肌灌注显像联合CT冠状动脉造影在冠心病患者中的预后诊断价值
汪 娇,李剑明
(泰达国际心血管病医院,天津医科大学心血管病临床学院,天津 300457)
0 引言
冠心病是威胁现代人类生命健康的头号杀手,在全球范围内具有较高的发病率和死亡率。侵入性冠状动脉血管造影(coronary angiography,CAG)被认为是诊断冠心病的“金”标准[1]。然而,CAG所示的冠状动脉解剖狭窄严重程度一般很难直接预测其相关血流动力学[2]。虽然传统的冠状动脉狭窄达到50%以上被认为有血流动力学意义,但研究[3-5]证实其中很大比例的狭窄没有造成血流动力学改变,而管腔狭窄小于50%的病变也可能引起心肌缺血。国外研究[6-7]发现心肌缺血患者的CAG不存在明显的异常。因此,应用无创性影像技术同时从冠状动脉解剖和功能2个方面进行诊断和危险度分层,能为冠心病的后续处理提供科学、客观的依据。本研究的目的是探讨和明确SPECT心肌灌注显像(myocardial perfusion imaging,MPI)联合 CT 冠状动脉造影(CT coronary angiography,CTCA)在可疑或确诊冠心病患者中的预后诊断价值。
1 资料与方法
1.1 临床资料
回顾性分析2013年1月至2017年12月间在我院行MPI和/或CTCA随访资料完整的病例。纳入标准:可疑或确诊冠心病患者行MPI和/或CTCA检查,检查前未行介入或外科血管重建治疗,具备MPI和CTCA 2项资料者检查间隔期不超过1个月,期间未行血管重建治疗。排除标准:心率>65次/min、严重心律失常、肾功能损伤、碘造影剂过敏、糖尿病服用二甲双胍者(停用48 h以上者除外),有负荷试验禁忌证者,MPI结果为反向再分布者,CTCA结果为重度钙化导致管腔狭窄程度难以评估者。收入的病例分组:(1)MPI单独分组(不具备 CTCA):根据 MPI结果分组,正常或单纯心肌梗死归为无缺血组(阴性组),可逆性心肌缺血或梗死伴缺血归为缺血组(阳性组),最终纳入病例分成阴性组和阳性组。(2)CTCA单独分组(不具备MPI):根据CTCA狭窄程度分为阴性组(无狭窄)、轻度狭窄组(0<冠状动脉狭窄<50%)、中度狭窄组(50%≤冠状动脉狭窄<75%)和重度狭窄组(冠状动脉狭窄≥75%)。(3)根据CTCA不同狭窄程度联合MPI结果再次分组(具备同期的MPI和CTCA):将CTCA阴性组、轻度狭窄组、中度狭窄组和重度狭窄组的各组内分别再分成MPI无缺血亚组(阴性亚组)和MPI缺血亚组(阳性亚组)。对各组患者进行随访(检查后至40个月),记录主要心脏不良事件(major adverse cardiac events,MACE)发生率及阳性指标(包括死亡、非致死性心梗、再血管化治疗)。
1.2 检查方法
1.2.1 CTCA方法及图像分析
采用64排VCT进行检查。扫描前4h患者禁食、水,控制心率≤65次/min。扫描参数:管电压120 kV,管电流380~420 mA。使用高压注射器注入欧乃派克注射液(350 mgI/ml),注射剂量为 1.0 ml/kg,注射速率4ml/s。由2名有经验的CT专业医师在未知MPI结果情况下共同阅片、诊断并取得一致。重建图像按冠状动脉左主干、左前降支、左回旋支和右冠状动脉分别进行分析。
1.2.2 MPI方法及图像分析
采用两日法运动或三磷酸腺苷(adenosine triphosphate,ATP)药物负荷/静息99mTc-MIBI/tetrofsomin门控MPI。检查前24~48 h停服硝酸酯类、钙拮抗剂和β受体阻滞剂。运动负荷显像:采用脚踏车运动试验方案,运动高峰时注射显像剂925~1 110 MBq,然后继续运动30~60 s。ATP负荷:经静脉泵入ATP,在5 min内注入,输注的第3分钟高峰时注射显像剂。静息显像:安静状态下注射显像剂925~1110MBq,注射后1.5 h开始图像采集。显像设备为GE双探头SPECT,采集条件:25~30 s/帧,每个心动周期分成8帧;采集图像矩阵为64×64。
MPI采用迭代法重建(2次迭代,8个子集),获得心肌灌注靶心图、左心室室壁运动电影和左心室射血分数。MPI图像由2名有3 a以上工作经验的核医学医师在未知患者CTCA结果情况下诊断并取得一致,诊断结果分成以下2种情况:(1)正常:负荷和静息显像灌注均正常;(2)异常:灌注缺损,分为可逆性、不可逆性和混合性灌注缺损。可逆性灌注缺损为负荷显像心肌出现节段性放射性稀疏或缺损,而静息显像完全恢复,其意义为心肌缺血;不可逆性灌注缺损为负荷和静息显像均表现为心肌相同节段固定性放射性稀疏或缺损,并结合室壁运动鉴别软组织衰减伪影,其意义为心肌梗死;混合性灌注缺损为负荷显像心肌节段性放射性稀疏或缺损,静息显像部分恢复,其意义为心肌梗死伴周围心肌缺血。
1.3 统计学分析
记录各组MCAE发生率,分析各组和亚组间MACE发生率差别的统计学意义(Fisher精确检验),以P<0.05为差异具有统计学意义。统计分析采用SPSS 19.0统计学软件处理。
2 结果
MPI单独分组,纳入60例行随访分析,其中阴性组[男 21 例、女 9 例,平均年龄(53.3±8.4)岁]、阳性组[男 25 例、女 5 例,平均年龄(56.9±9.0)岁]各 30例,随访患者MACE发生率分别为3.3%和56.7%。MPI阳性组MACE发生率较高,与阴性组相比,差异具有统计学意义(P<0.05),详见表1。
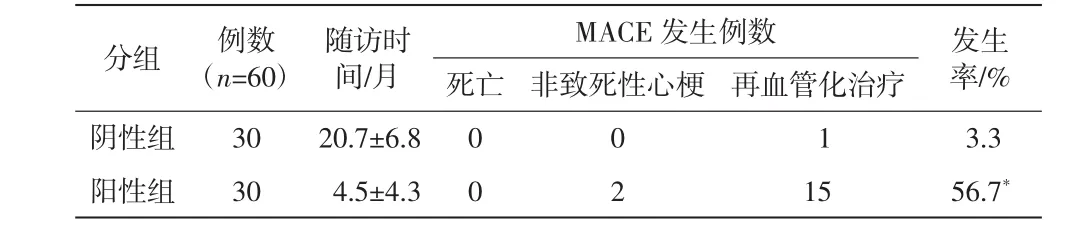
表1 MPI单独分组随访MACE发生率比较
CTCA单独分组,纳入130例行随访分析,其中CTCA阴性组40例[男28例、女12例,平均年龄(50.7±9.8)岁],轻度狭窄组 30 例[男 16 例、女 14 例,平均年龄(54.8±8.9)岁],中度狭窄组 30 例[男 22 例、女 8 例,平均年龄(57.6±9.8)岁],重度狭窄组 30 例[男 18 例、女 12 例,平均年龄(58.8±10.5)岁]。随访各组患者MACE发生率分别为0%、6.7%、23.3%、53.3%,总体上各组间MACE发生率的差异具有统计学意义(P<0.05),详见表 2。

表2 CTCA单独分组随访MACE发生率比较
CTCA联合MPI分组,纳入185例行随访分析。CTCA阴性组(45例):MPI阴性亚组30例[男16例、女 14例,平均年龄(48.1±7.8岁)]、MPI阳性亚组 15例[男9例、女6例,平均年龄(53.5±8.58)岁],MACE 发生率均为0;CTCA轻度狭窄组(47例):MPI阴性亚组30例[男23例、女7例,平均年龄(54.1±10.8)岁]、MPI阳性亚组17例[男14例、女3例,平均年龄(57.7±9.8)岁],MACE发生率分别为10.0%和5.9%;CTCA中度狭窄组(50例):MPI阴性亚组30例[男23例、女7例,平均年龄(57.7±7.9)岁]、MPI阳性亚组20 例[男 15 例、女 5 例,平均年龄(52.8±8.2)岁],MACE 发生率分别为 6.7%和30.0%;CTCA重度狭窄组(43例):MPI阴性亚组22 例[男 12 例、女 10 例,平均年龄(58.7±6.7)岁]、MPI阳性亚组21例[男14例、女7例,平均年龄(57.3±10.7)岁],MACE发生率分别为22.7%和85.7%。详见表3。各组间总体上MACE发生率的差异具有统计学意义(Fisher精确检验 χ2=78.4,P<0.05);各组两两比较卡方分割分析见表4。
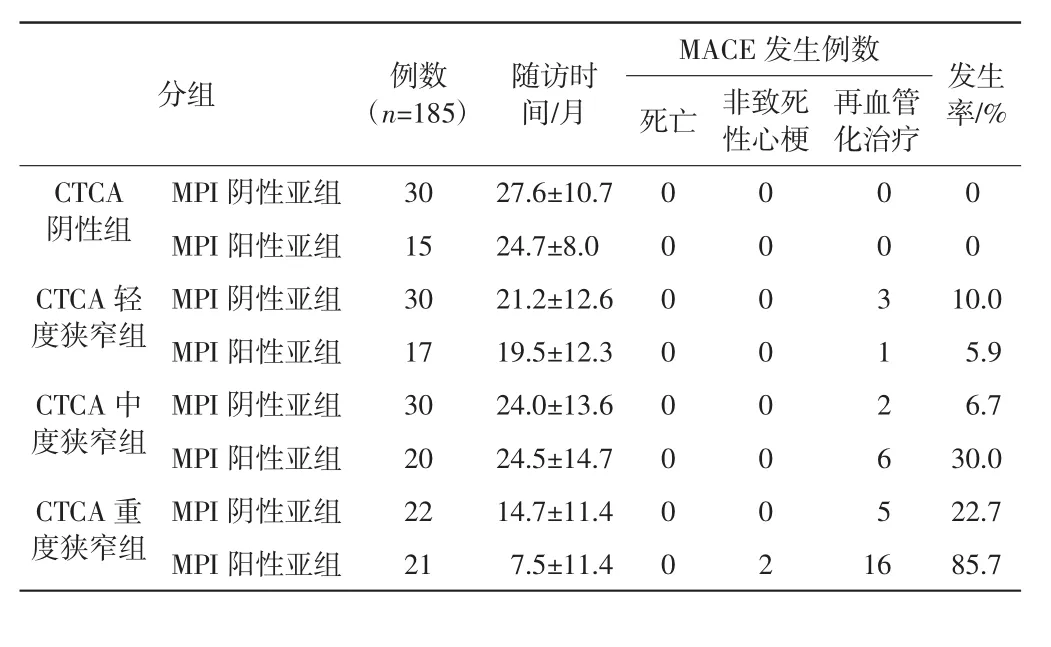
表3 CTCA与MPI联合分组随访MACE发生率比较
由各组分析可知,CTCA阴性具有较强的MACE阴性预测价值,而CTCA阳性(狭窄≥50%)时联合
MPI分析能有效评价MACE发生危险性,CTCA与MPI二者阳性匹配是MACE发生的较强预测因子。典型病例如图1所示。
3 讨论

表4 CTCA与MPI联合分组各亚组间MACE发生率两两比较
本研究结果发现,MPI单独分组中MPI阳性组MACE发生率相对较高,与阴性组相比差异有统计学意义;CTCA单独分组中各组间MACE发生率有统计学差异,随狭窄程度增加而升高;CTCA与MPI联合分组各组间MACE发生率有统计学差异,二者阳性或阴性匹配具有较强的预测价值。研究结果提示CTCA有明显狭窄同时伴有MPI血流动力学异常者是MACE发生的强烈预测因子。将CTCA与MPI结合,可为冠心病的危险性评价提供一种综合性的无创评估方法[8-10]。有多项研究[11-15]表明,冠状动脉解剖与核素心肌灌注融合成像及CTCA和MPI的并行分析对单一成像方式具有明确的增益诊断价值。

图1 CTCA与MPI阳性匹配典型病例图
无创性评价预后情况对冠心病患者的诊疗决策有重要指导价值。核素显像是根据心肌缺血有无及其程度评价患者危险程度。MPI结果阴性提示患者有较好的预后,其MACE的年发生率低于1%;MPI所显示的灌注缺损范围和严重性与MACE具有较强的相关性,负荷MPI所诱发的灌注缺损范围是一项确定药物治疗还是血管重建治疗的重要决定因素。相关研究[16]结果显示,负荷状态下心肌缺血是MACE的最佳预测因素。两项大型随机试验[17-18]显示,对已知的冠心病患者,若不通过缺血试验进行分层,则无法预测患者的预后。另一项前瞻性随机试验[19]表明,基于部分血流储备测量的缺血驱动的血管重建改善了预后。因此,欧洲心脏病学会指南建议在冠状动脉血管重建之前推荐行心肌缺血检测[20]。
Brown等[21]对包括16项相关研究共计3 500名确诊或者可疑冠心病患者的文献进行了复习,结果显示201TI负荷MPI结果正常者平均随访28个月后,其年发生MACE的概率不到1%。Steinberg等[22]对309名201TI负荷MPI正常者随访10 a,发现其年发生死亡的概率为0.1%,年发生急性心梗的概率为0.6%。Elhendy等[23]对218名99mTc-MIBI运动负荷MPI正常者随访7.4 a,结果显示其年发生MACE的概率为0.7%。Hachamovitch等[24]对10 627名接受了运动或腺苷MPI且先前没有心肌梗死或血运重建的患者进行了随访,发现诱导性缺血和心绞痛症状是最有力的预测因子,在无缺血或轻度缺血的情况下,接受内科治疗的患者比进行血运重建的患者更具有生存优势,而在存在中度到重度缺血的情况下,进行血运重建的患者比接受内科治疗的患者具有更大的生存优势。本研究结果与既往文献报道一致,结果显示MPI对判断患者的预后具有很好的增益价值,静息/负荷MPI提示为低危和中危的人群无需进一步的有创治疗,保守治疗可以使患者受益程度最大。
近年来,CTCA作为一种侵袭性小、成本低、显像便捷的诊断技术得到了迅速地推广[25]。CTCA能无创、直观地显示冠状动脉狭窄的部位、程度和斑块分布、数量及其成分情况,但该技术受心率、冠状动脉钙化程度的影响。虽然CTCA与CAG相比在探测阻塞性冠状动脉狭窄方面具有较高的灵敏度、特异性和准确性,但CTCA同CAG一样并不能直接提供冠状动脉狭窄的功能意义[26]。CTCA是一种能对冠状动脉进行形态学诊断的方法,它在低风险患者中没有改善未来MACE的发生率[27]。MPI和CTCA诊断冠心病的原理不同:前者通过直接观察心肌缺血的有无、范围和程度对冠心病诊断和评价,它不能显示冠状动脉解剖形态和斑块;而后者是通过直接观察冠状动脉管腔狭窄程度及斑块数量、分布和性质诊断,但不能直接反映心肌灌注血流动力学信息。在冠心病诊断和评价中,MPI与CTCA所提供的信息是相互补充而不是相互排斥的关系,相关研究[28-29]证实了这2种影像学方法联合应用在诊断冠心病方面的临床价值。本研究发现MPI联合CTCA能对可疑或确诊的冠心病患者进行预后评价,二者阳性匹配对MACE具有较强的预测价值。如美国心脏病介入治疗和核素显像指南指出:对于慢性稳定性心绞痛患者在实施血管重建治疗之前应进行无创的有关冠状动脉形态和功能2个方面的评价,当冠状动脉明显狭窄并伴有缺血证据时是行血管重建治疗的确切指征,而无狭窄无缺血或有狭窄无缺血则应采用药物保守治疗。MPI与CTCA联合诊断价值在于:(1)冠状动脉明显狭窄同时伴有血流动力学异常时,积极行血管重建治疗能有效改善患者预后;(2)冠状动脉有或无明显狭窄而不伴有明显血流动力学异常时,应积极控制危险因素和强化药物治疗,一般无需血管重建治疗;(3)冠状动脉既无狭窄又无血流动力学异常时,应加强预防和控制危险因素。本研究的局限性在于各组病例数相对有限,应进一步扩大各组(包括亚组)病例数并增加缺血定量化参数,延长随访时间、观察长期预后。
综上,本研究提示MPI与CTCA联合分析是冠心病危险度分层的有力工具,二者阴性或阳性匹配具有重要的临床预后评价作用。二者均为阴性的患者MACE发生率极低、预后较好,即提示临床无需进一步创伤性诊断或治疗;而二者均为阳性则提示患者MACE发生率较高、预后较差,应进行积极有效的临床干预。

