特异性免疫治疗对桦树花粉过敏小鼠Th17细胞的影响
谢枝隽,尹 佳,周俊雄
哮喘是一种慢性气道炎症,由一系列呼吸道症状定义,如喘息、呼吸短促、胸闷和咳嗽,以及可逆的呼气气流限制,严重影响患者的生活质量[1]。近年来,随着哮喘发病率的上升,造成了严重的经济负担[2]。花粉诱导的过敏性哮喘是哮喘常见的表现形式,桦树花粉(Betula platyphylla)是我国北方地区春季主要致敏花粉。在欧洲,70%的桦树花粉过敏患者,伴有食物过敏症状,表现为进食桦树花粉相关的食物(苹果,芹菜和榛子)时出现不同程度的口唇肿胀[3]。特异性免疫治疗是唯一能有效控制桦树花粉诱导的过敏性哮喘症状,减少吸入激素的用量,改变过敏性哮喘自然进程的方法。桦树花粉特异性免疫治疗能抑制交叉反应所导致的食物过敏,减少食物诱导的严重过敏反应发生[4]。特异性免疫治疗主要通过皮下注射过敏原,诱导机体产生耐受,从而缓解症状。过敏症状的缓解与Th2型免疫抑制有关,包括降低Th2相关细胞因子水平,如IL-4、IL-5、IL-13等[5-6]。此外,过敏症状的缓解还与IgG4相关,IgG4被认为是保护性抗体,与特异性IgE竞争,抑制肥大细胞脱颗粒。Th17细胞是机体免疫重要的调节细胞,在过敏性哮喘的发生、发展中有重要作用[7-8]。Th17细胞主要受转录因子Rorc调控,通过分泌IL-17A在哮喘中发挥作用[9-10]。推测特异性免疫治疗缓解过敏性症状,也会对Th17细胞有影响。本研究通过建立中国桦树花粉诱导的小鼠哮喘模型,观察特异性免疫治疗对Th17细胞的影响。
1 材料与方法
1.1 实验动物
BALB/c小鼠,体重18~20 g,由北京维通利华实验动物技术有限公司提供,在北京协和医院动物房饲养,饲养环境符合SPF级实验动物标准。实验过程中,给予实验动物人道关怀,并通过北京协和医院伦理委员会审批。
1.2 桦树花粉
桦树花粉提取物由北京协和医院变应原制剂室提供,花粉蛋白浓度检测使用BCA试剂盒(Thermo Fisher Scientific, Waltham, Mass)。
1.3 动物模型构建
BALB/c小鼠于第1、8、15天,颈后皮下注射100 μl的0.25 μg/μl桦树花粉溶液和100 μl氢氧化铝佐剂(Imject Alum,Thermo,USA),共计200 μl。第24~26天,采用雾化激发的方式,雾化吸入0.1%的桦树花粉溶液,连续3 d,每天30 min。第27天,行肺功能检测,24 h后取材(图1)。
对照组使用phosphate buffered saline(PBS)代替桦树花粉,其余操作如前(图1)。
特异性免疫治疗组:桦树花粉致敏激发小鼠,从第32天开始,颈后皮下注射150 μl桦树花粉溶液 (2 μg/μl),隔天一次,总计8次。第53~55天,雾化吸入0.1%的桦树花粉溶液,连续3 d,每天30 min。第56天行肺功能检查,24 h后取材(图1)。
1.4 气道高反应性测定
使用DSI公司的无创肺功能仪器NAM(Non-Invasive Airway Mechanics)进行小鼠肺功能检测。主要评价指标是比气道阻力(sRaw)值,为气道阻力与胸腔气量的乘积。将小鼠放入校正好的密闭肺功能测定腔内,让其适应环境5 min,分别雾化给予PBS,给予1.56、3.125、6.25、12.5、25、50 mg/ml的乙酰甲胆碱(Sigma,German)。每次给乙酰甲胆碱后,纪录sRaw值。
1.5 血清细胞因子检测
采用割尾法收集小鼠血于1.5 ml EP管中,4 ℃过夜;第2天,4 000 r/min,4 ℃离心10 min,吸取清亮上清于新的EP管中,-80 ℃冻存备用。使用高通量多因子检测平台Luminex 200TM,多因子试剂盒Milliplex Catalog ID.MCYTOMAG-70K-06.
Mouse Cytokine MAGNETIC Kit (Millipore, Billerica, USA)检测血清细胞因子IL-4和IL-17A水平。具体操作严格遵照说明书。
1.6 血清桦树花粉特异性免疫球蛋白测定
血清桦树花粉特异性免疫球蛋白(sIgE,sIgG1,sIgG2a)采用酶联免疫吸附法测定。碳酸盐缓冲液(pH9.6)作为包被液,稀释桦树花粉,包被96孔板(Thermo Fisher Scientific,Waltham,USA),100 μl/孔,4 ℃过夜。次日,使用PBST清洗96孔板3次,每孔加入200 μl封闭液(1% BSA-PBST),室温封闭2 h。小鼠血清用封闭液稀释,分别1∶200稀释用于IgG1检测,1∶200稀释用于IgG2a检测,1∶10稀释用于IgE检测。稀释后血清加入对应96孔板中,100 μl/孔,4 ℃过夜。PBST清洗后,二抗用封闭液按照1∶1 000稀释,100 μl/孔,室温孵育2 h。加入TMB显影剂后,用酶标仪在450 nm处读数,记录。实验重复3次。二抗分别是:Rat Anti-Mouse IgE (HRP) (ab99574, Abcam, Cambridge, UK), Goat Anti-Mouse IgG1 heavy chain (HRP) (ab97240, Abcam, Cambridge, UK)和Goat Anti-Mouse IgG2a heavy chain (HRP) (ab97245, Abcam, Cambridge, UK)。

图 1 动物模型构建
Fig 1 Animal model
1.7 脾脏Th17细胞检测
试剂PerCP/Cy5.5 anti-mouse IL-17A购自Biolegend公司(BioLegend, San Diego, USA);Anti-Mouse CD4 FITC 50 μg购自eBioscience公司(eBioscience, San Diego, USA)。将小鼠脾脏放入300目细胞过滤网袋,置于含10%胎牛血清(Hyclone, Logan, Utah)的RPMI 1640培养基中。在培养皿上,用注射器橡胶头轻轻研磨组织,使细胞渗出过滤网,进入培养基。收集单细胞悬液,离心弃上清。加入红细胞裂解液后室温放置10 min,离心弃上清。PBS洗涤后,用含刺激剂(PMA,Ionomycin和Golgistop)的培养基重悬细胞,在37 ℃,5% CO2的细胞箱内培养5 h。离心后加入CD4-FITC,室温避光孵育30 min。洗涤后加入固定打孔液,室温避光孵育30 min。使用打孔洗涤液洗涤细胞后,加入IL-17A抗体,室温避光孵育30 min。使用流式细胞仪FACS Canto plus (BD Biosciences, San Jose, USA)检测,检测结果以淋巴细胞%CD4+IL-17A+表示,FlowJo软件进行后续分析。
1.8 Transcription-quantitative polymerase chain reaction(RT-qPCR)检测
采用TRIzol法提取脾总RNA,Trizol试剂购自天根生化科技(北京)有限公司,型号DP405-02。采用 PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa,RR047B,日本)进行cDNA反转录,实验操作按产品说明书进行。SYBR Premix Ex Taq Ⅱ (TliRNase H Plus)和ROX plus(Takara Bio, Inc., Otsu, Japan)用于cDNA扩增。qPCR仪器为ABI 7500 Real-Time PCR system(Applied Biosystems; Thermo Fisher Scientific, Inc., Waltham, MA, USA)。目的基因引物序列在北京Invitrogen公司合成,上下游序列见表1。PCR扩增反应:95 ℃,30 s;40个PCR循环(95 ℃,5 s;60 ℃,40 s)。为了建立PCR产物的熔解曲线,扩增反应结束后,按(95 ℃,10 s;60 ℃,60 s;95 ℃,15 s),从60 ℃缓慢加热到99 ℃。结果用2-△△Ct进行分析。
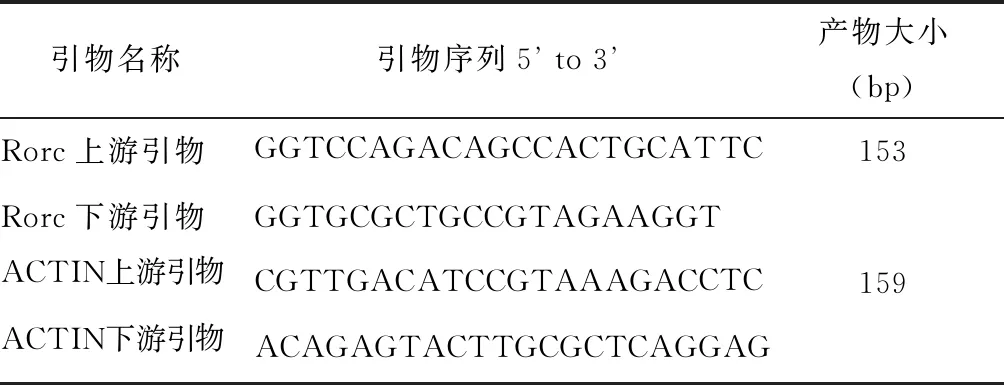
表1 引物序列Table 1 Primer sequence
1.9 肺组织病理
肺组织石蜡包埋后,将修整好的蜡块置于石蜡切片机上切片,片厚4 μm。行H&E染色和AB-PAS染色。H&E染色:石蜡切片脱蜡,苏木素染细胞核,伊红染细胞质;脱水封片,显微镜镜检。染色结果:细胞核蓝色,细胞质红色,用于评估气道周围炎症细胞的浸润。AB-PAS染色:石蜡切片脱蜡,阿利新蓝染色,高碘酸染液染色;切片入雪弗染液30 min,避光;脱水封片,显微镜镜检。酸性黏液物质染色呈蓝色,糖原和中性黏液物质染色呈紫红色。AB-PAS染色用于评估气道黏液产生的情况。
1.10 统计学处理
实验结果用(均数±标准差)表示,使用SPSS 19.0进行统计学分析,使用GraphPad prism software 5.0作图。各组数据首先进行正态分布检验和方差齐性分析,根据检验结果,采用Mann-WhitneyUtest或Student’st-test检验进行两两比较。P<0.05认为有统计学意义。
2 结果
2.1 桦树花粉诱导的哮喘模型和特异性免疫治疗
桦树花粉致敏和激发的BALB/c小鼠,sRAW较对照组明显升高,特别是在乙酰胆碱浓度为25和50 mg/ml时(P<0.01);经特异性免疫治疗后,sRAW在25和50 mg/ml处明显降低(图2)。
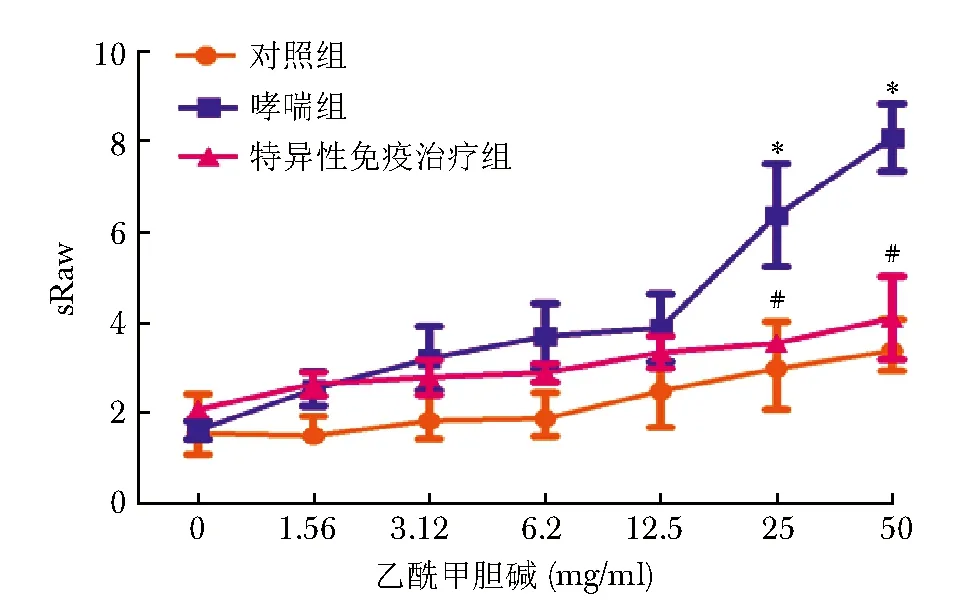
图 2 特异性免疫治疗前后气道高反应变化Fig 2 Changes of airway hyper-responsiveness before and after SCITsRaw:比气道阻力; SCIT:特异性免疫治疗;与对照组比较,*P<0.01;与哮喘组比较,#P<0.01
哮喘小鼠血清sIgE,sIgG1和sIgG2a水平显著高于对照组小鼠P<0.01。经特异性免疫治疗后,sIgE水平降低,sIgG1和保护性抗体sIgG2a水平无明显变化(图3)。

图 3 特异性免疫治疗前后免疫球蛋白水平变化
Fig 3 Changes of specific immunoglobulins before and after SCIT
SCIT:特异性免疫治疗;与对照组比较,*P<0.01;与哮喘组比较,#P<0.01
肺组织病理H&E染色发现哮喘小鼠支气管周围有大量炎性细胞浸润,形成多层细胞环,同时伴有气道增厚和水肿。特异性免疫治疗组小鼠肺部气管周围炎性细胞浸润较少,气道水肿减轻(图4)。
肺组织AB-PAS染色发现:相比对照组小鼠,哮喘小鼠气道壁广泛被染成蓝紫色,气道内也可以看到弥散的蓝紫色,表明产生大量的黏液。特异性免疫治疗组黏液分泌较少(图4)。
2.2 小鼠不同时期Th17数量和Rorc mRNA表达的变化
流式细胞术检测结果显示,哮喘组小鼠脾Th17细胞数量(0.37±0.16)较对照组小鼠脾Th17细胞数量(0.18±0.86)明显增高P<0.05;特异性免疫治疗组,Th17细胞数量(0.16±0.16)较哮喘组显著降低P<0.01(图5)。哮喘组小鼠脾Th17细胞转录因子Rorc的表达量(3.99±1.39)较对照组(1.79±1.19)显著升高(P<0.01)。经特异性免疫治疗后,Th17细胞转录因子Rorc表达量(0.65±0.23)较哮喘组明显降低(P<0.01),差异有统计学意义。哮喘小鼠血清细胞因子IL-4和IL-17A表达量均较对照组明显增高。特异性免疫治疗后,细胞因子IL-4和IL-17A水平明显降低(图6)。
3 讨论
季节性过敏性哮喘患病率逐年增加,已成为全球健康关注的问题之一。花粉是引起季节性过敏性哮喘的主要原因,受多种危险因素的影响, 如突发恶劣天气和地区分布等[11]。桦树花粉是中国北方地区春季重要致敏花粉,是过敏性哮喘的重要病因之一[12]。
针对桦树花粉诱导的过敏性哮喘,回避过敏原是最主要的预防措施。此外,抗组胺药物,白三烯抑制剂和糖皮质激素都可用于缓解过敏性哮喘症状。然而,只有特异性免疫治疗能长期控制症状,减少吸入激素的用量,改变过敏性哮喘的自然进程[13]。特异性免疫治疗停止后,仍有长期疗效存在。针对桦树花粉特异性免疫治疗的研究对诊治过敏性哮喘意义重大。由于临床研究的复杂性和众多不可控影响因素,本实验使用哮喘动物模型进行相关研究。
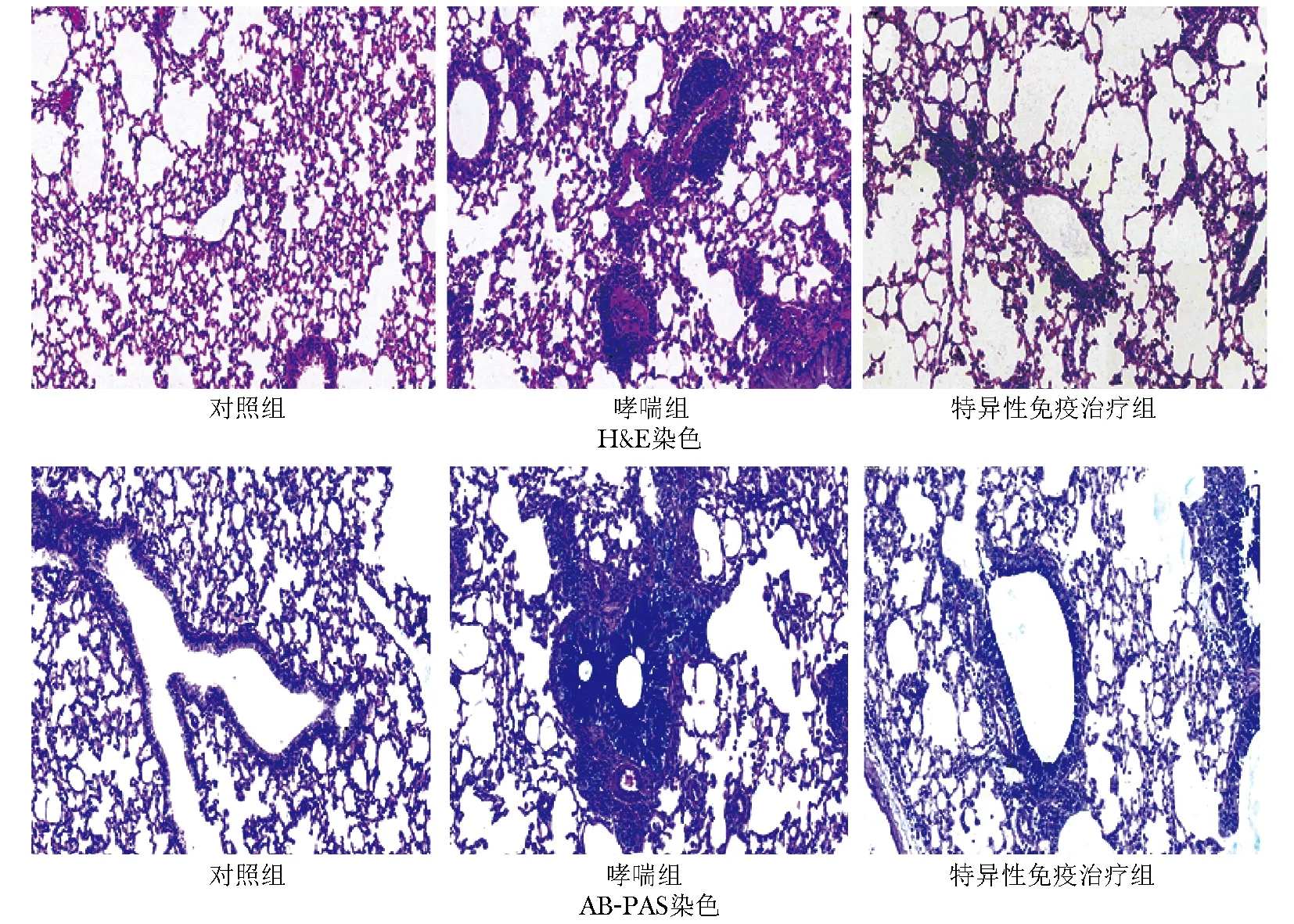
图 4 特异性免疫治疗前后肺组织病理所见
Fig 4 Pulmonary histopathology before and after SCIT
SCIT:特异性免疫治疗

图 5 流式细胞仪检测特异性免疫治疗前后CD4+IL-17A+Th17 细胞
Fig 5 Flow cytometry analysis: CD4+IL-17A+Th17 cell before and after SCIT
SCIT:特异性免疫治疗
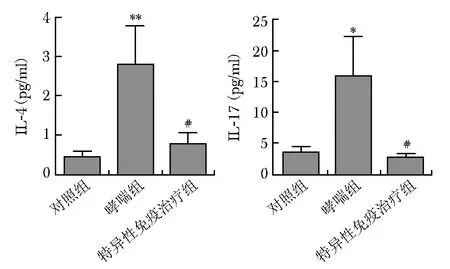
图 6 特异性免疫治疗细胞因子水平变化Fig 6 Changes of cytokines in serum before and after SCITSCIT:特异性免疫治疗;与对照组比较,*P<0.05,**P<0.01;与哮喘组比较,#P<0.01
特异性免疫治疗主要通过诱导免疫耐受,从而缓解过敏性哮喘症状。在本实验中,特异性免疫治疗组能有效缓解小鼠气道高反应,降低Th2型免疫相关的细胞因子水平(IL-4作为Th2型免疫反应细胞因子[14-15],随着特异性免疫治疗的进行逐渐降低)。同时,特异性免疫治疗能刺激机体产生保护性抗体sIgG2a,与特异性IgE竞争,从而抑制肥大细胞的活化,减少生物活性物质的合成和释放,如组胺、类胰蛋白酶、血小板活化因子和前列腺素D2等[16]。但效果不明显,可能与治疗时间过短有关。本实验结论与既往研究结果[17-18]一致,证明动物模型建立成功。
除了Th2型炎症,新出现的IL-17A及其产生细胞Th17也被认为参与哮喘发病[8,19]。Th17细胞是机体重要的免疫调节细胞。Th17细胞受转录因子Rorc调控,分泌细胞因子IL-17,包括(IL-17A~F) 6种亚型[10]。本研究结果显示,哮喘小鼠的脾Th17数量,转录因子Rorc水平和血清主要效应分子IL-17A水平均明显高于对照组小鼠。但特异性免疫治疗后相应数值均降低,说明特异性免疫治疗可以抑制Th17型免疫炎症反应,符合免疫调节的一般规律。该实验不足之处:其一,还缺少对Th17细胞的拮抗细胞Treg的数量和功能变化的探究。其二,还需要进一步对Th17细胞下游信号通路的研究。
本研究还发现,相比对照组,细胞因子IL-17A和IL-4水平在哮喘组明显升高,经特异性免疫治疗后下降。这可作为桦树花粉特异性免疫治疗相关的生物标志物,但仍需要进行下一步验证。血清细胞因子检测使用xMAP技术为基础的高通量多因子检测平台Luminex200TM,xMAP技术是液相芯片实现多重检测的基础。Merck Millipore联合Luminex®已应用于许多研究的多重生物标志物检测[20-21]。
综上,桦树花粉是我国北方地区春季主要致敏花粉,不仅会引起过敏性鼻炎、过敏性哮喘,还会并发多种食物过敏反应。特异性免疫治疗能改善患者症状,维持长期疗效。桦树花粉相关特异性免疫治疗能部分抑制Th17细胞的数量和功能。

