纳米材料在光动力疗法肿瘤治疗中的应用进展
张继双,周林
(南京师范大学化学与材料科学学院,江苏 南京 210023)
光动力疗法(photodynamic therapy,PDT)是一种利用光进行疾病治疗的重要疗法。PDT作用机制是光源激发光敏剂(photosensitizer,PS)后,其由基态跃迁至单重激发态,随后,单重激发态的光敏剂经系间窜越至三重激发态,三重激发态的PS与氧气或生物分子发生能量传递或电子转移,生成各种活性氧(reactive oxygen species,ROS)或自由基,从而损伤蛋白质及核酸等生物分子,发挥治疗活性(见图1)[1]。1972年,Diamond 发现卟啉的光敏活性可以杀死肿瘤细胞,开启了PDT肿瘤治疗序幕。如今,PDT已广泛用于肿瘤的临床治疗。然而,PDT的深部实体肿瘤治疗仍面临以下问题:1)已临床应用的PS分子的激发波长多处于可见光区或紫外光区[2],该波段范围内光源组织穿透深度有限[3]。2)由于肿瘤生长快速,其血管组织发育不全,导致实体肿瘤部分区域常呈现乏氧微环境(氧分压<5 mmHg)[4],而氧气是PDT三要素之一,乏氧微环境必定影响PDT疗效。3)与正常细胞相比,肿瘤细胞内还原型谷胱甘肽(glutathione,GSH)浓度很高(>10 mmol · L-1),高浓度的GSH势必消耗PDT产生的ROS,降低PDT治疗效果[5]。4)有机小分子PS肿瘤靶向性、光稳定性及ROS产生能力亟待提升[2]。因此,寻求有效方法解决上述问题,是PDT实现深部实体肿瘤治疗的基础。
近年来,随着制备技术及检测手段的不断进步,纳米技术发展迅速,纳米材料在生物医药领域的应用范围不断拓展。近年来,许多新型纳米材料表现出优良的光学、催化活性及ROS产生能力等性能,被广泛应用于PDT肿瘤治疗领域。本文将从光、PS及氧气三要素角度,简述近年来为解决PDT深部实体肿瘤治疗面临的问题,基于PDT三要素设计合成的纳米材料及其在PDT肿瘤治疗中的研究进展。
1 光
光的组织穿透深度与其波长密切相关,多数PS激发波长在紫外光或可见光区,然而,这些波段光源组织穿透深度浅,无法满足深部肿瘤治疗要求。因此,PDT深部肿瘤治疗效果有限。
与紫外光或可见光相比,近红外光(700 ~ 1 300 nm)有着更深的组织穿透能力,更加符合PDT治疗体内深部实体肿瘤的要求。基于此,自2007年以来,具有吸收近红外光、发出可见光性质的上转换纳米材料在PDT领域的应用研究悄然兴起。稀土离子由于其f价电子层结构具有丰富且稳定的电子能级而常作为上转换发光材料的发光中心[6]。稀土离子掺杂的上转换纳米材料可被近红外光激发,产生紫外-可见-近红外上转换发射光。通过控制稀土离子的种类与组成,可以获得具有不同发光光谱的上转换发光材料。利用共价键、氢键、自组装等原理将上转换材料与PS分子组合后,选用组织穿透深度强的近红外光激发上转换材料,其产生的可见光区或紫外光区的上转换荧光可间接激发PS产生ROS,实现PS的间接长波敏化[7](见图2)。此外,因上转换纳米材料激发光位于能量较低的近红外区,不仅具有良好的组织穿透性能,而且对生物体组织的损伤也很小,安全性较佳[8]。

图 2 基于上转换材料实现光敏剂近红外光间接敏化机制图Figure 2 Schematic presentation of near infrared lighttriggered indirect sensitization of photosensitizer based on upconversion nanoparticles
凌代舜教授课题组将PS二氢卟吩e6(chlorin e6,Ce6)与具有pH响应功能的高分子聚合物偶联后,与上转换纳米材料NaYF4:Yb,Er@CaF2及表面活性剂Pluronic F68聚合组装为复合纳米药物(PPNs)。在血液传输pH条件(pH=7.4)下,复合纳米药物中的Ce6因聚集而呈现失活态,在肿瘤微环境(pH = 6.5)及进入肿瘤细胞的内涵体或溶酶体的酸性环境(pH = 5.5)中,复合纳米药物解聚,Ce6恢复活性;经980 nm激光激发后,NaYF4:Yb,Er@CaF2产生675 nm上转换荧光,进而激发Ce6产生ROS,杀伤肿瘤细胞。皮下移植瘤模型实验中,瘤内注射 PPNs(2 g · L-1,100 μL)后,980 nm 激光(2.5 W · cm-2,10 min)光照肿瘤组织,与对照组相比,14 d治疗后,其肿瘤组织体积为对照组1/10以下[9]。
除上转换材料外,近年来,长余辉发光材料也被广泛用于PDT肿瘤治疗,通过提高光源利用效率,增强PDT治疗效果。长余辉发光材料可储存被外部光源激发时产生的激发能,并在外部光源激发停止后逐渐将能量以光的形式缓慢释放,实现短时激发和长时间发射荧光的独特光学效应。PDT过程可利用该材料产生的长效荧光作为光源,经荧光共振能量转移( fl uorescence resonance energy transfer,FRET), 间 接 持 续 激 发PS,产生ROS,从而杀灭肿瘤细胞,提高光能利用效率,增强PDT效果(见图3)。
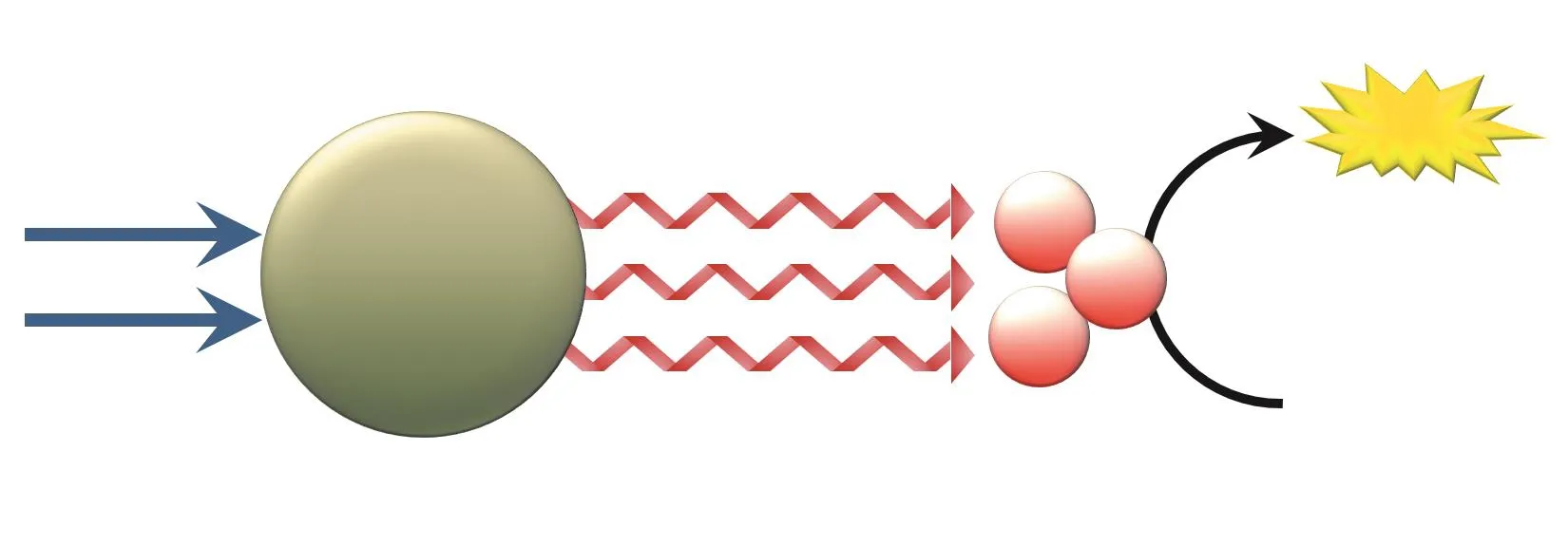
图 3 基于长余辉发光材料的光敏剂短时光照后的持续敏化机制图Figure 3 Continuous sensitization mechanism of photosensitizer based on short period of illumination and long afterglow luminescent material
陈小元教授课题组将长余辉发光材料ZnGa:Cr与聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid,PLGA)复合,形成具有长余辉发光功能的复合体(ZGC PL)并植入肿瘤组织(10 g · L-1,20 μL)作为内源光源;尾静脉注射光敏药物光克洛[2-(1-hexyloxyethyl)-2-devinyl pyropheophorbide-alpha,HPPH,1 g · L-1,150 μL] 后, 仅在第1天及第8天(治疗时间14 d)使用白光LED(400 ~ 750 nm)光照肿瘤部位15 min。结果显示,ZGC PL植入物可储存激发能,停止光照后作为内源持续发光光源为PDT提供光源,高效利用光能,14 d 治疗期内皮下移植瘤生长被完全抑制,且肿瘤细胞发生显著的凋亡及坏死[10]。许多长余辉发光材料光照后具有长时间的持续发光性能,如潘正伟教授课题组合成的Zn3Ga2Ge2O10:Cr长余辉发光材料被单次短时激发后,可在650 ~ 1 000 nm波段范围内实现超过360 h的长余辉发光[11]。但受限于余辉发光强度及生理环境对余辉发光效果的影响,目前,长余辉材料体外单次激发后,活体内肿瘤治疗时完全利用余辉发光作为光源,无需再次光照的PDT治疗体系研究鲜见。因此,还需不断探索在生理条件下,能够高强度、长时间发出余辉荧光的新型材料。
此外,近年来,具有生物自发光功能的PDT治疗研究兴起。生物自发光是一种特殊的化学发光,其作用机制是在一定条件下,特定酶催化底物发生氧化释放光子。生物发光将化学能转变为光能的效率可达到100%。生物发光应用于PDT的过程就是利用生物发光体系(供体)产生的光与PS(受体)发生荧光共振能量转移,进而敏化PS产生ROS,杀灭肿瘤细胞。吴长锋教授课题组利用PLGA合成共载荧光素酶(luciferase)、荧光素底物(D-荧光素)及光敏药物玫瑰红(rose bengal,RB)的复合纳米体系(PLGARB);该体系进入肿瘤细胞后,在三磷酸腺苷(adenosine triphophate,ATP)及Mg2+存在条件下,荧光素酶催化D-荧光素发光,激发RB产生ROS,杀灭肿瘤细胞;PLGA-RB与D-荧光素利用生物发光作为PDT光源的治疗组皮下移植瘤增殖抑制效果与PLGA-RB使用外加光源激发的对照组相近,真正实现了无外加光源的PDT肿瘤治疗[12]。
2 光敏剂
传统的PS多为有机小分子,如已用于临床治疗的光卟啉、四-(间羟基苯基)二氢卟吩、内源性卟啉Ⅸ及5-氨基乙酰丙酸等[13]。但有机小分子PS的肿瘤靶向性、光稳定性及ROS产生能力亟待提升[2]。许多纳米材料被光激发亦可产生ROS,可作为新型纳米PS;与传统的有机小分子PS相比,纳米PS来源更加广泛、价格低廉且具有优良的光稳定性与光敏活性。此外,纳米PS还可通过实体肿瘤中存在的独特的高通透性和滞留(enhanced permeability and retention,EPR)效应,被动靶向肿瘤组织,实现在肿瘤组织高效聚集,提升PDT效果。优良的纳米PS应该具有生物安全性佳、治疗后可代谢排出体外、良好的稳定性及优良的ROS产生能力等特点。
二氧化钛(TiO2)纳米颗粒是经典的无机纳米PS,在紫外光照射下,TiO2可以产生大量ROS。研究显示,紫外光组织穿透深度浅,无法有效穿透皮肤组织实现体内肿瘤治疗[14]。杨飘萍教授课题组以商业化TiO2P25为原料,用水热法合成TiO2纳米棒,在其表面修饰金纳米簇后,获得Au25/B-TiO2-x复合纳米PS;Au25/B-TiO2-x可被650 nm光激发,实现空穴电子的分离,电子会转移到金属表面,形成能抑制空穴电子重组的势垒,分离的空穴-电子对将诱导水分裂产生大量的ROS,发挥PDT抗肿瘤活性[15]。
谢毅教授课题组通过简单剥离方法获得厚度为2.0 nm的超薄黑磷纳米片,在可见光照射下,其可产生大量单线态氧,且量子产率高达0.91;该纳米片在0.2 mg · L-1的浓度下,使用 660 nm 激光器(0.5 W · cm-2)光照10 min即可使71.5%的肿瘤细胞发生凋亡;皮下注射超薄黑磷纳米片(500 mg · L-1,30 μL)12 h后,使用660 nm激光器光照肿瘤部位20 min,在16 d治疗期内,超薄黑磷纳米片加光照治疗组的皮下移植瘤增长停滞,说明超薄黑磷纳米片是一种优良的纳米PS,更重要的是,该纳米片治疗后可被降解,预示其临床应用潜力巨大[16]。
GSH是生物体内广泛存在的一种由谷氨酸、半胱氨酸和甘氨酸结合、含有巯基的还原性三肽,具有很强的抗氧化活性[17]。肿瘤细胞内GSH浓度达到正常组织细胞的7倍以上[18],而PDT是一种基于氧化损伤的治疗方法,故肿瘤细胞内高浓度还原物质GSH的存在可严重降低PDT氧化损伤效果。曲晓刚教授课题组制备了Cu2+修饰的氮化碳纳米片(Cu2+-g-C3N4)作为纳米PS[19]。该纳米PS在可见光照射下不仅可以高效产生包括超氧阴离子自由基、羟基自由基、单线态氧及过氧化氢等多种ROS,同时,Cu2+还可将肿瘤细胞内的GSH转化为氧化型谷胱甘肽(GSSG),使肿瘤细胞内GSH/GSSG比例降低1/3,显著降低肿瘤细胞抗氧化能力,因此,Cu2+-g-C3N4的GSH损伤能力大大提升了其PDT抗肿瘤活性。另外,笔者所在课题组设计了一个末端含有二硫联吡啶的新型锌酞菁PS(ZnPc-DTP),其ROS产生能力很低并可通过分子间π-π相互作用形成纳米聚合物(ZnPc-DTP NP);经尾静脉注射后,ZnPc-DTP NP可经EPR效应实现肿瘤组织靶向富集,进入肿瘤细胞后,ZnPc-DTP中的二硫键能直接与GSH发生反应,将GSH转化为GSSG,降低肿瘤细胞中的GSH浓度;同时,肿瘤细胞中高水平的GSH能切断二硫键,破坏原有的纳米结构,切断ZnPc-DTP二硫键,释放出ROS高产生能力的末端含有巯基的锌酞菁(ZnPc-SH),实现基于药物肿瘤细胞内原位活化及GSH损伤的高效PDT肿瘤治疗效果(见图4)[20]。
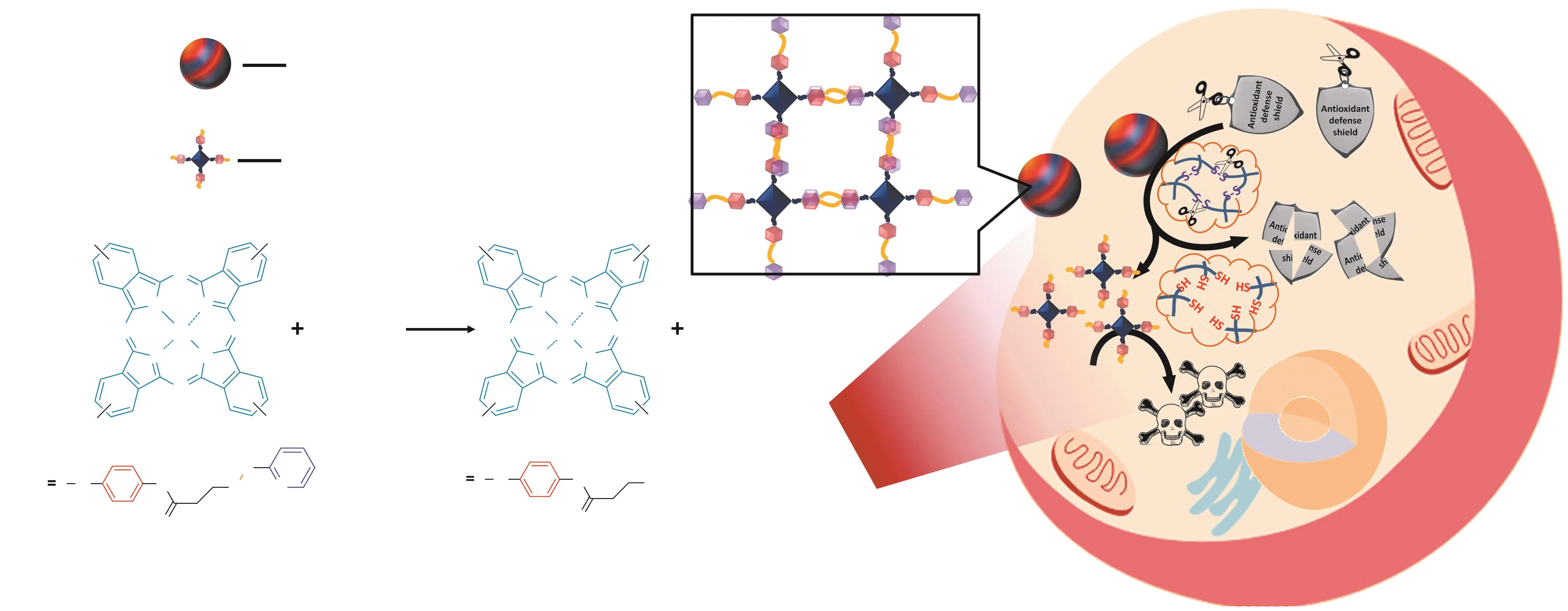
图 4 ZnPc-DTP NP抗肿瘤过程示意图Figure 4 Schematic presentation of anticancer mechanism of ZnPc-DTP NP
3 氧气
氧气通过血液循环被输送到全身各组织,然后被细胞吸收利用。正常组织中血管分布均匀,血流供应稳定,因此组织内各细胞所处氧气环境较为均衡。然而,实体肿瘤组织部位的血管结构完整性差,血流供应断续不定,导致大部分远离血管的肿瘤细胞处于乏氧的微环境(见图5)。因氧气是PDT发挥活性三要素之一,氧气缺乏会显著降低PDT治疗的效果。因此,寻求有效方法增加肿瘤组织的含氧量,对PDT肿瘤治疗具有重要意义。目前,可通过以下方法缓解肿瘤乏氧:催化肿瘤细胞内高浓度的H2O2产氧;在光敏治疗体系中共载携氧剂,实现肿瘤组织富氧;升温加快肿瘤部位血流速度,增加氧气供给等。

图 5 实体肿瘤内氧气浓度分布示意图Figure 5 Schematic diagram of oxygen concentration distribution in solid tumor
与正常细胞相比,肿瘤细胞内H2O2浓度较高。H2O2可被多种催化剂催化分解产生氧气,利用该原理,研究人员设计构建出多种催化H2O2分解产氧以缓解实体肿瘤乏氧的纳米PDT治疗体系。郭子建教授课题组将过氧化氢酶与PS亚甲基蓝(methylene blue,MB)包覆于聚合物纳米粒内部,并在纳米粒表面修饰肿瘤靶向肽(RGDfK)组成复合药物HAOP;该复合药物经尾静脉注射进入荷瘤小鼠后,在肿瘤组织高效富集,进入肿瘤细胞后,过氧化氢酶催化细胞内高浓度H2O2产生氧气;使用细胞内氧气浓度检测探针[Ru(dpp)3]Cl2检测摄取HAOP后细胞内氧气浓度增加过程显示,HAOP孵育8 h后,细胞内乏氧情况显著缓解。因此,HAOP可通过催化H2O2分解产生氧气,为PDT供氧,实现乏氧实体肿瘤的高效治疗[21]。除了过氧化氢酶,刘庄教授课题组[22]、郑南峰教授课题组[23]、汪鹏飞教授课题组[24]、雷建平教授课题组[25]及Taeghwan Hyeon课题组[26]还采用二氧化锰(MnO2)、铂包钯纳米片(Pd@Pt)、锰碳量子点、黑磷/氧化锰复合材料及MnFe2O4等纳米材料作为H2O2分解产氧的催化剂,与PS组成复合纳米药物,通过催化肿瘤细胞内源H2O2产生氧气供给PDT使用,实现了乏氧肿瘤的PDT高效治疗。
血红蛋白是血液中红细胞内负责氧气传递的主要载体,其在氧浓度高的环境中易与氧气结合,但在氧浓度低的环境中又容易与氧气解离,释放氧气。基于此,王利群教授课题组使用两亲性三嵌段共聚物(mPEG-b-PAA-b-PS)将血红蛋白与PS四(4-羧苯基)卟吩[5,10,15,20-tetra (4-carboxyphenyl) porphyrin ,TCPP]组装成仿生复合药物(I-ARCs),模拟红细胞载氧及递氧过程,直接传输氧气至肿瘤组织,缓解实体肿瘤乏氧,增进PDT疗效[27]。此外,全氟碳类化合物(per fl uorocarbon,PFC,直链或环状碳氢化合物的氟取代物)也是氧气的良好溶剂。因此,PFC也可作为氧气传递介质缓解实体肿瘤乏氧[28]。何丹农教授课题组使用PLGA包覆PFC溴化物(per fl uorooctyl bromide,PFOB)与PS IR780组成复合纳米药物(PLGA-IR780-PFOB),该复合纳米药物包覆的PFOB中携带大量氧气,复合纳米药物进入肿瘤细胞后,释放所携带的氧气至肿瘤细胞,缓解实体肿瘤乏氧;与不含PFOB对照组(PLGA-IR780)相比,PLGA-IR780-PFOB治疗组体内肿瘤抑制率提升近5倍[29]。
4 结语
综上所述,纳米技术在PDT肿瘤治疗领域得到广泛应用,在推动PDT肿瘤治疗进程中发挥了巨大的作用。基于纳米材料构建的多样化PDT体系,不仅来源广泛、价格低廉,且可克服PDT治疗过程中面临的光源组织穿透不足、肿瘤组织乏氧等问题,还可通过EPR效应实现肿瘤组织的被动靶向。然而,利用纳米材料构建PDT治疗体系的体内抗肿瘤研究的实验周期多在30 d以内,短时治疗后,可通过检测实验动物体质量变化及主要脏器超薄切片染色后的病理分析判断体系的不良反应。但纳米材料长期治疗可能导致的不良反应、对免疫系统的影响及代谢路径等问题的研究相对较少。如汪联辉教授课题组的研究表明,含Gd3+的上转换材料NaGdF4可以选择性吸附细胞内的ATP并催化其磷酸键断裂,导致细胞内ATP浓度下降,当材料质量浓度为1 600 mg·L-1时,细胞内ATP浓度趋近于零,ATP浓度的下降可诱发细胞自噬及凋亡[30]。此外,因Gd3+具有优良的核磁成像性能,其被广泛用于具有肿瘤诊疗一体化功能的PDT纳米药物合成。因此,若该类材料无法在短时间内快速代谢排出体外,在某些正常组织中聚集的材料就可能引发严重的不良反应。此外,以斑马鱼为对象的研究表明,纳米铜、纳米银、Cd/Te量子点、纳米TiO2及纳米MgO等材料具有显著的致畸效应并可影响斑马鱼正常发育[31]。但可以预见,随着纳米技术的进步,会有更多的拥有优良的生物安全性、肿瘤主动靶向能力、可代谢或可降解、协同肿瘤治疗功能等新型材料用于PDT肿瘤治疗,进一步拓展PDT肿瘤治疗应用范围,推动新型纳米药物的临床PDT肿瘤治疗进程。

