牛磺酸对甲状腺激素致血管内皮细胞损伤的保护作用及机制*
王相杰 文今福 韩然然 金松南,
1.药学院,山东第一医科大学(山东省医学科学院),山东 泰安 271016; 2.心血管内分泌研究所,山东第一医科大学(山东省医学科学院),山东 泰安 271000
血浆中一定水平的甲状腺激素(thyroid hormone, TH)对维持心血管正常功能至关重要,而甲亢(hyperthyroidism)时过量分泌的TH作用于心血管系统则可引起高血压、心肌肥厚、心力衰竭、心律失常和血管病变等一系列病理特征表现。过量的L-四碘甲状腺原氨酸(T4) 可损伤血管内皮细胞而能改变血管的形态和功能[1-2]。
牛磺酸(taurine,tau)是中药牛黄的生物活性成分之一。近年来发现[3]牛磺酸在机体心血管系统中也存在,被认为是一种内源性物质,参与心血管功能的调控。然而,牛磺酸对TH致血管内皮细胞损伤是否具有保护作用目前尚不清楚。本研究拟探讨牛磺酸对甲亢致血管内皮细胞损伤的保护作用及机制,以期为甲亢致血管损伤的防治提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1试剂 L-四碘甲状腺原氨酸(T4),wortmannin,二甲基亚砜(Sigma公司);DMEM培养基,胎牛血清, 胰蛋白酶,青霉素,MTT,链霉素(Solarbio公司); 一氧化氮试剂盒(南京建成生物工程研究所)。
1.1.2药物 牛磺酸购买于西安嘉天生物科技有限公司,纯度为98%以上。
1.1.3人脐静脉血管内皮细胞 人脐静脉血管内皮细胞(HUVECs)购买于上海细胞生物学研究所。
1.1.4仪器 倒置显微镜(中国COIC公司,XPS-1B型),流式细胞仪(美国B-D公司,FACSCalibur型),CO2培养箱(日本SANYO公司,MCO-15 AC型),多功能酶标仪(瑞士Tecan公司,Infinite F 200型)。
1.2 方法
1.2.1HUVECs细胞培养方法 培养HUVECs时,选用DMEM培养液,其中含10%的胎牛血清、青霉素100 mg/L和链霉素100 mg/L。HUVECs在37℃、5% CO2培养箱中进行培养,挑选生长良好的细胞用于实验。
1.2.2MTT法检测细胞存活率 细胞密度调整为3×104/mL,细胞悬液吹打均匀,用移液枪接种到96孔板,每孔加入100 μL(即3000个细胞)。种完细胞24 h后,等其完全贴壁,用移液枪,将上清液培养基吸掉。用完全培养基将药物按梯度配制好,每孔加入含药培养基150 μL,牛磺酸提前干预2 h,T4孵育48 h,将上清液吸出,每孔加入0.5 mg/mL 的MTT溶液100 μL,培养箱内孵育4 h 后,吸出MTT溶液,然后每孔加入150 μL 的二甲基亚砜(DMSO)溶液,震荡混匀,使其结晶完全溶解。用多功能酶标仪选取490 nm波长进行检测,计算细胞存活率。
1.2.3细胞内活性氧(ROS)水平检测 细胞密度调整为1×105个细胞/mL,用移液枪接种到6孔板,每孔加入1 mL的细胞悬液,再加入1 mL细胞培养液,置于细胞培养箱中继续培养24 h,吸弃培养基。牛磺酸提前干预2 h,T4孵育48 h,将6孔板中的培养基吸净,每孔再加入1 mL的PBS,轻轻摇晃,弃掉PBS缓冲液。每孔加入1 mL含血清培养基,反复轻柔地吹打细胞,使细胞全部悬浮,将细胞悬液转入至流式管中。在室温条件下,1000 r/min离心3 min,倒掉上清液,收集细胞,加入DCFH-DA(DCF)荧光探针,将流式管放到37℃细胞恒温培养箱内避光孵育20 min。用流式细胞仪进行荧光强度的检测,激发波长为488 nm,发射波长为525 nm。
1.2.4细胞培养液中一氧化氮(NO)水平检测 采用硝酸还原酶法测定NO2-、NO3-水平,按NO试剂盒的说明书进行操作,在550 nm处测定各管的吸光度值,根据测得的吸光度计算细胞培养液中的NO水平。

2 结 果
2.1 牛磺酸对T4调节HUVECs细胞凋亡的影响
T4组为用T4(5 μM)处理HUVECs 48 h;牛磺酸+T4组为分别用不同浓度牛磺酸(2.5,5,10 mM)预处理HUVECs 2 h后,再用T4(5 μM)处理HUVECs 48 h,然后检测HUVECs存活率。结果显示,T4(5 μM)处理后出现HUVECs存活率的降低效应(表1,P<0.01),而牛磺酸(5,10 mM)处理后T4(5 μM)降低HUVECs存活率的效应得以恢复,其细胞存活率趋向于正常水平(表1,P<0.05或P<0.01)。结果表明,牛磺酸能改善T4诱导的HUVECs存活率降低效应。
2.2 牛磺酸对T4调节HUVECs活性氧水平的影响
T4组为用T4(5 μM)处理HUVECs 48 h;牛磺酸+T4组为分别用不同浓度牛磺酸(2.5,5,10 mM)预处理HUVECs 2 h后,再用T4(5 μM)处理HUVECs 48 h,然后检测HUVECs ROS水平。结果显示,与对照组比较,T4(5 μM)明显升高HUVECs ROS生成(表2,P<0.01),而牛磺酸(5,10 mM)处理后T4(5 μM)升高HUVECs ROS水平的效应得以恢复,其ROS水平趋向于正常水平(表2,P<0.01)。结果表明,T4能促进HUVECs内的ROS生成,而牛磺酸则抑制此效应。
2.3 牛磺酸对T4调节HUVECs NO分泌的影响
T4组为用T4(5 μM)处理HUVECs 48 h;牛磺酸+T4组为分别用不同浓度牛磺酸(2.5,5,10 mM)预处理HUVECs 2 h后,再用T4(5 μM)处理HUVECs 48 h,然后检测HUVECs细胞培养中的NO水平,结果显示,与对照组比较,T4(5 μM)明显降低HUVECs细胞培养中的NO水平(表3,P<0.01),而牛磺酸(5,10 mM)处理后T4(5 μM)降低HUVECs细胞培养中NO水平的效应得以恢复,其NO水平趋向于正常水平(表3,P<0.01)。用PI3K/Akt阻断剂wortmanin处理HUVECs后,牛磺酸(5,10 mM)改善T4诱导的NO水平降低效应则消失(表3,P<0.01)。结果表明,T4明显减弱HUVECs的NO分泌,而牛磺酸通过PI3K/Akt途径则能改善此效应。

表1 牛磺酸对T4调节HUVECs存活率的影响
注:与对照组相比,*P<0.01;与T4组相比,#P<0.05,##P<0.01。

表2 牛磺酸对T4调节HUVECs ROS生成的影响
注:与对照组相比,**P<0.01;与T4组相比,##P<0.01。
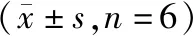
表3 牛磺酸对T4调节HUVECs NO分泌的影响
注:与对照组相比,**P<0.01;与T4组相比,##P<0.01;与牛磺酸+T4组比较,++P<0.01。
3 讨 论
本实验结果表明,牛磺酸明显抑制TH致HUVECs存活率的下降和ROS水平升高,其机制与血管内皮细胞PI3K/Akt-eNOS-NO信号通路有关。
甲亢与心血管疾病密切相关。甲亢伴随着自主神经系统功能紊乱导致心血管系统处于高动力状态,表现为心排出量和收缩压明显升高,同时引起显著的血管形态和功能变化[1-2]。目前关于甲亢时心脏病变的研究报道较多,而有关甲亢时血管病变的防治研究报道较少。
牛磺酸是一种含硫的氨基酸,最早由牛黄中分离出来。牛磺酸过去被认为是机体内含硫氨基酸无功能的终末代谢产物,但近年来研究证明牛磺酸具有广泛的生物学功能,机体内几乎所有正常生理功能的维持和调节都需要牛磺酸的参与,尤其在心血管系统的稳态中发挥重要的调节作用[3-4]。牛磺酸在循环系统中可抑制血小板凝集,降低血脂,防止动脉硬化[4-6];对心肌细胞有保护作用,可抗心律失常和抗心力衰竭[7-8]。
TH过量时可诱导血管内皮细胞的损伤[1-2]。本实验结果显示,T4 处理HUVECs后细胞存活率明显下降,与上述报道一致。本实验进一步观察到牛磺酸可明显减少T4致 HUVECs存活率下降的效果,提示牛磺酸对T4致血管内皮细胞损伤具有保护作用。
氧化应激是指机体内氧自由基增多和(或)清除能力降低导致活性氧簇在体内或细胞内蓄积而引起的氧化损伤过程。在生理状态下,ROS的作用主要表现在调控细胞的生长、迁移、增殖和激活方面,在病理状态下ROS主要涉及到炎症、内皮功能障碍、细胞增殖和凋亡等方面。已证实多种心血管疾病与ROS有着密切关系[9-10]。本实验结果显示,T4明显促进HUVECs内ROS生成,而牛磺酸则抑制此效应。提示牛磺酸通过抑制ROS生成而发挥其对T4致血管内皮细胞损伤的保护作用。
在血管内皮细胞分泌的活性物质中,NO对血管内皮细胞具有保护作用[11-12]。生理状态下,内皮细胞在内皮型一氧化氮合酶(eNOS)催化下产生适量的NO,通过细胞内环磷酸鸟苷(cGMP)途径调节平滑肌细胞的张力、舒张血管、调节血压和血流分布。越来越多的基础和临床研究结果表明[13-15],NO代谢紊乱与多种心血管疾病如高血压、动脉粥样硬化、糖尿病密切相关。本实验结果显示,T4显著降低HUVECs细胞培养液中的NO分泌,而牛磺酸则明显改善其降低效应;在PI3K/Akt阻断剂wortmanin存在下,牛磺酸改善T4致NO水平降低效应则消失。提示牛磺酸对T4致血管内皮细胞损伤的保护作用是通过PI3K/Akt-eNOS-NO信号通路来实现的。
总之,牛磺酸对TH致血管内皮细胞损伤具有保护作用,其机制与PI3K/Akt-NO-cGMP信号通路有关。本研究将为牛磺酸应用于甲亢致血管病变的防治提供新的实验依据。

