高温下乙醇/异辛烷混合物着火特性的反应动力学研究
秦明元,何本壮,陈日新,樊祥山,王井山,王锡斌
(西安交通大学能源与动力工程学院,710049,西安)
在当今石油资源不断减少的大背景下,燃料乙醇C2H5OH成为国际上公认的可降低汽车尾气排放和替代石油燃料的清洁能源。乙醇具有辛烷值高、与汽油无限互溶、污染少的特点,可以代替MTBE等作为汽油辛烷值改进剂,有助于提高燃油经济性,降低排放,具有广阔的应用前景[1-2]。
着火滞燃期作为内燃机工作过程中的一个重要参数,直接影响到发动机的动力指标、噪音大小以及工作粗暴性,同时也是内燃机燃烧过程的重要表征参数,因此研究燃料着火滞燃期特性具有很重要的意义。在燃烧研究领域,异辛烷IC8H18与汽油性质接近,通常用异辛烷作为汽油的替代燃料进行分析研究。Mittal等提出了乙醇燃烧详细机理,可以准确预测乙醇在低温和高压下的自燃特性,并在压力p为1~5 MPa、温度T为825~985 K和当量比Φ为0.3~1.0的条件下进行了着火滞燃期的验证[3]。Curran提出了高压下异辛烷空气的详细反应机理,并利用该机理模拟了激波管中的着火滞燃期,结果表明该模型与实验具有良好的吻合性[4]。Shen等利用激波管测定了异辛烷在p为0.7~5.8 MPa、T为868~1 300 K下,当量比分别为0.25、0.5、1时的着火滞燃期数据,大多情况下Ar作为稀释剂的混合燃料比N2作为稀释剂的点火时间短20%[5]。Bogin等在一台着火质量测试仪上对乙醇/异辛烷混合燃料在p为0.5~1.5 MPa、T为623~993 K、当量比为0.7~1.0时进行了着火滞燃期的研究,发现随着乙醇浓度的增加,负温度特性区域减少[6]。Barraza等利用自由活塞式快速压缩设备对乙醇、异辛烷和异辛烷/乙醇混合燃料在p为1 MPa、T为900~1 080 K、当量比为1.0的着火滞燃期进行了实验研究,结果表明乙醇/异辛烷混合燃料的反应受到异辛烷和乙醇相互之间反应的限制[7-8]。
综上所述,针对纯乙醇燃料着火滞燃期的研究较少,异辛烷及乙醇/异辛烷混合燃料的着火滞燃期特性研究虽然较多,但大多集中在温度低于1 000 K的工况,而内燃机工作混合气处于更高的温度状态,此时通过着火滞燃期结合反应机理及反应路径,可以更好地反映缸内燃料燃烧的化学反应过程。因此,本文通过激波管研究了高温条件下(1 100~1 900 K)乙醇/异辛烷混合燃料着火滞燃期的变化规律,可为进一步完善乙醇/异辛烷混合燃料的机理提供实验基础。
1 实验装置与燃料组分
1.1 实验装置
激波管实验平台可被用来测量不同燃料的着火滞燃期,是研究燃料自燃特性、优化化学反应机理的理想设备,实验装置如图1所示。图中间的双膜机构将激波管分成2.0 m的高压驱动段和7.4 m的低压被驱动段,低压被驱动段右端为实验段,附近等距布置了4个壁面压力传感器,压力传感器之间并联有3个时间间隔计数器,用于获得实验段端面的入射激波速度,实验段端面为OH*光信号传感器,用于测量OH*浓度的变化[9]。

图1 激波管实验装置示意图
配气时,首先计算乙醇、异辛烷、Ar、O2各分压,按照设计压力比,将乙醇和异辛烷注入到抽过真空的不锈钢预混罐中,控制罐内压力要低于二者饱和蒸气压的1/2,以保证两种液体完全气化与混合。将相对应比例的He、N2充入高压段和夹膜段,低压段充入预混罐中的混合气。当气体进入后,打开夹膜段和排气阀门,使得高压驱动段与夹膜段之间存在的压差足以穿透夹膜;等待双模机构破膜后,利用实验段右端面的光电倍增管(PMT)测量OH*光信号作为着火开始的判断依据[10]。本文的实验数据均为同一条件下进行多次实验,在误差范围内取平均值所得,具有一定的重复性。
着火滞燃期的定义不同,得出的实验结果不同。本实验中定义实验段端面反射激波形成的时刻,即将压力曲线上涨达到目标压力的时刻定义为着火滞燃期的零点,选择OH*发光自由基信号曲线上升过程中斜率最大处的切线反推至零线的时刻点作为开始剧烈燃烧的时刻,二者之间的时间间隔即为着火滞燃期[11-12],反射激波温度为1 200 K、压力为1 MPa、当量比为1.0条件下乙醇/异辛烷/Ar/O2混合压力和OH*信号随时间的变化如图2所示。由图2可知,E50(见表1)的着火滞燃期为2 411 μs,可使结果受环境影响最小,减小了后处理过程中产生的误差,因而得到了燃烧学界的广泛使用[13]。

图2 反射激波管和OH*信号演变过程
1.2 燃料组分
目前,低掺比醇类混合燃料研究较多,中高掺比的研究相对较少,高掺醇比和纯乙醇燃料是目前的研究热点。因此,本文选择乙醇摩尔分数分别为0、50%、75%和100%的乙醇/异辛烷混合燃料(分别用E0、E50、E75和E100表示)进行分析,实验采用Ar稀释,初始压力为0.2、1 MPa,温度为1 100~1 900 K,当量比为1.0。4种不同混合燃料的实验配气组分如表1所示。
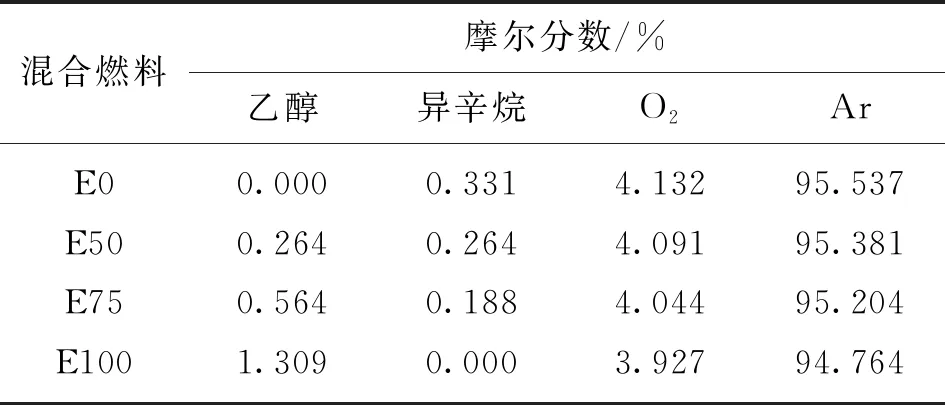
表1 混合燃料的实验配气组分
混合燃料着火滞燃期的模拟计算采用CHEMKIN-Pro软件的SENKIN子代码,采用定容、绝热、零维反应器模型进行研究,SENKIN中着火滞燃期定义为从反应开始时刻到温度梯度达到最大值之间的时间间隔[14]。文献[15]的异辛烷机理较为完善,且包含详细的乙醇机理,因此本文采用文献[15]的异辛烷机理来模拟计算乙醇/异辛烷混合燃料的着火滞燃期。
2 实验结果与分析
2.1 乙醇掺混比对滞燃期的影响
初始压力为0.2、1 MPa时乙醇/异辛烷混合燃料着火滞燃期随乙醇掺混比的变化关系如图3所示。由图3可知:初始压力为0.2、1 MPa时乙醇/异辛烷混合燃料的着火滞燃期随着乙醇含量的增加而缩短,而且在较低温时乙醇掺比变化对着火滞燃期的影响效果和较高温度时相比更明显,这时温度升高也会对着火滞燃期产生影响;乙醇含量较高时,着火滞燃期变化更明显,当异辛烷中加入乙醇后,由于乙醇中的OH基,影响了重要反应的活性,而燃料高温裂解会产生OH基,从而促进燃料分子的氧化,有效地缩短的着火滞燃期;T=1 452 K时,E0的着火滞燃期为373.7 μs,E50着火滞燃期为206 μs,时间缩短了44.9%;E100着火滞燃期为57.7 μs,与E0的着火滞燃期相比缩短了84.6%。

(a)p=0.2 MPa

(b)p=1 MPa图3 乙醇/异辛烷混合燃料滞燃期随乙醇掺混比的变化关系
2.2 初始压力对滞燃期的影响

图4 E75在不同压力、温度下滞燃期的实验、模拟值
压力为0.2、1 MPa、温度为1 200~1 900 K时E75着火滞燃期的变化如图4所示。由图4可知,着火滞燃期的对数值与温度的倒数近似呈线性关系。E75混合燃料的着火滞燃期随温度的升高而减小,随压力的增大而减小,T=1 479 K时,E75在压力为0.2 MPa时着火滞燃期为329 μs,而在压力为1 MPa时着火滞燃期为103.4 μs,缩短了68.6%。当初始温度升高时,外界环境为化学反应提供了更多的能量,从而更容易达到反应所需的活化能,所需的时间更短,混合燃料的着火滞燃期缩短。温度一定时可认为分子动能恒定,根据分子碰撞理论,压力升高会减小分子的平均自由历程,增大分子之间的碰撞频率,从而促进燃料化学反应,使得混合燃料的着火滞燃期缩短。
2.3 混合燃料滞燃期的Arrhenius拟合公式
由实验结果可对不同乙醇掺混比混合燃料进行多元线性回归拟合,Arrhenius公式为
(1)
式中:τ为滞燃期,μs;A为指前因子;B为压力指数;Ea为活化能,kJ/mol;p为激波管端面的实际压力,MPa;Ru=8.314 kJ/(mol·K-1)为通用气体常数;T为激波管端面的实际温度,K。式(1)表征了温度和压力对滞燃期的影响,Arrhenius公式中各参数随乙醇掺混比的变化如表2所示。
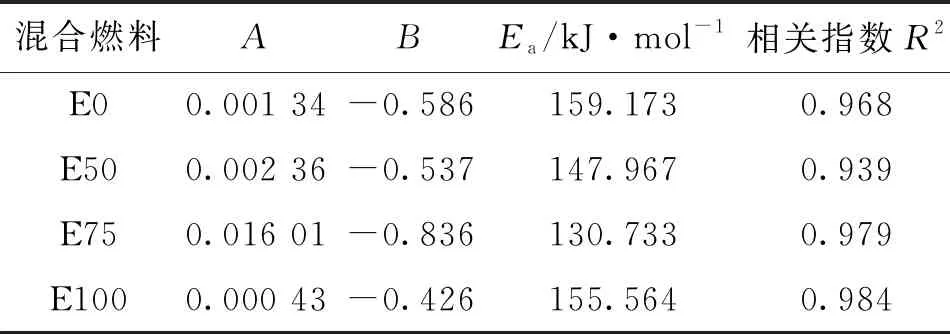
表2 不同乙醇掺混比下的Arrhenius公式参数
由表2可知,压力指数B为负数,印证了乙醇/异辛烷着火滞燃期随压力的增大而减小,并且异辛烷着火滞燃期压力指数的绝对值大于乙醇(E100)压力指数的绝对值,这说明压力对异辛烷着火滞燃期的影响大于乙醇,着火滞燃期与温度的倒数呈正相关,也说明着火滞燃期随温度的增大而减小,各掺混比拟合式的相关指数R2均大于0.9。乙醇/异辛烷混合燃料滞燃期拟合值和实验值的对比如图5所示,可知拟合值与实验值吻合良好。

图5 乙醇/异辛烷混合燃料滞燃期拟合值和实验值对比
2.4 化学反应路径分析
为深入理解高温条件下乙醇/异辛烷的化学反应历程,通过模拟软件CHEMKIN,得到Φ=1.0、T=1 600 K、p=1 MPa条件下E25、E75的简化反应路径,如图6所示。
乙醇在高温下的氧化过程主要通过燃料分子的脱氢反应及燃料的裂解反应,乙醇的主要高温反应式为C2H5OH+H⟺SC2H4OH+H2、C2H5OH+H⟺PC2H4OH+H2、C2H5OH⟺C2H4+H2和C2H5OH⟺CH2OH+CH3。乙醇的脱氢反应生成物不同,主要是由于C2H5OH的H原子有3个位置[16],其中α位氢原子和OH基团最近,键能最低,最容易发生脱氢反应,因此有超过一半的乙醇在高温条件下α位发生脱氢反应生成SC2H4OH,乙醇氧化的最终产物为醛类和烯烃,其中醛基对甲基等自由基有一定的消耗作用,促进燃料氧化。异辛烷的主要高温反应式为IC8H18⟺YC7H15+CH3、IC8H18⟺PC7H15+CH3、IC8H18⟺TC4H9+IC4H9和IC8H18⟺NCOC5H11+IC3H7。异辛烷主要是通过裂解产生YC7H15、PC7H15两种同分异构体,进而再进行裂解消耗,异辛烷氧化的最终产物以烯烃为主。
由图6可知:在相同工况下,随着乙醇掺混比的增大,乙醇氧化过程中的脱氢反应比例减少,分解反应比例增多;随着乙醇含量的增加及乙醇的裂解反应增多使得乙烯(C2H4)的含量明显增加,而乙烯基(C2H3)是烃类氧化过程中重要的高活性C2类自由基[14],能促进燃料分子的氧化过程。

数值有下划线表示E75的,无下划线表示E25的(a)乙醇反应路径

数值有下划线表示E75的,无下划线表示E25的(b)异辛烷反应路径图6 T=1 600 K、p=1 MPa、Φ=1.0时E25、E75的反应路径

(a)E25 (b)E75图7 E25、E75中异辛烷的OH基生成路径对比
E25、E75混合燃料的异辛烷反应路径中OH基生成路径的对比如图7所示。1 600 K时,异辛烷的反应中OH基的生成主要来自反应O2+H⟺O+OH和反应C2H5OH⟺C2H5+OH中,由图7可知,E25反应C2H5OH⟺C2H5+OH占生成OH基总反应的38.2%,E75占比增至87.8%,随着乙醇含量的增加,混合燃料中的OH基得到显著增加,从而促进燃料分子的氧化。无论是从乙醇反应路径分析还是异辛烷反应路径分析,随着乙醇含量的增加乙醇/异辛烷混合燃料的反应速率都增加,因而着火滞燃期缩短。
2.5 着火滞燃期敏感性分析
本文使用正规化敏感性分析温度为1 300、1 600 K时,乙醇掺混比的增加对乙醇/异辛烷混合燃料着火主要反应速率的影响。敏感性系数为
(2)
式中:Si为着火滞燃期的敏感性系数;ki为第i个反应的反应速率。利用Atef Nour简化机理(189个组分,912个反应),通过模拟计算得到最影响滞燃期的前23个反应,如图8所示,敏感性分析中涉及的主要反应方程式如表3所示。

(a)1 300 K

(b)1 600 K图8 p=1 MPa、Φ=1.0时E25、E75着火滞燃期的敏感性分析
由图8可知,无论是温度为1 300 K还是1 600 K,着火滞燃期敏感性系数绝对值最大的都是反应R5,其中敏感性系数为负数时表示促进反应进行,正数时表示抑制反应进行。图8中敏感性系数为负

表3 乙醇/异辛烷/O2/Ar反应系统关键基元反应
数的公共反应分别是R5、R94、R70、R3、R136、R240,其中只有R3的滞燃期敏感性随着温度的升高而增大,这是因为高温下更容易产生OH自由基从而促进R3的进行,而对于R136、R240,虽然反应物中也含有OH自由基,但因为另一反应物都为C2物质,而高温下主要以低碳分子进行反应,因而敏感性下降。反应R136在1 300 K时敏感性随乙醇掺混比增大而增大,1 600 K时随掺混比增大而减小。反应R240随乙醇掺混比增加敏感性变化最大,这是由于乙醇含量的增加使得OH基浓度大幅增大导致,是掺混乙醇后影响着火滞燃期的关键反应。
图8中敏感性为正数,即抑制氧化进行的公共反应占大多数,只有反应R537、R522、R298、R63为独有反应,这是因为高温下更易发生低碳分子的反应,虽然R537、R522、R298在1 300 K时敏感性系数较大,但在1 600 K时几乎为0。在公共反应中,所有反应的滞燃期敏感性系数均随温度的升高而降低,其中反应R23、R78、R91的敏感性系数随着乙醇掺混比的增加而增大,主要是因为反应物中含有乙醇氧化生成的OH自由基和醛基,且反应R78、R91构成链式反应,加快反应进行。
3 结 论
本文在压力为0.2或1 MPa、温度为1 100~1 900 K、当量比为1.0条件下,研究了高温环境下不同掺比的乙醇/异辛烷混合燃料着火滞燃期变化规律,得到如下结论。
(1)随着压力和乙醇掺混比的升高,混合燃料的着火滞燃期均有所减小;温度越高着火滞燃期越短,且着火滞燃期的对数值与温度的倒数近似呈线性关系。
(2)将实验数据进行Arrhenius公式的拟合,通过拟合公式计算的拟合值与实验值吻合良好,根据拟合公式的压力指数发现,压力对异辛烷着火滞燃期的影响大于对乙醇滞燃期的影响。
(3)通过反应路径和滞燃期敏感性分析发现,混合燃料在燃烧过程中,随着乙醇掺混比的增加,乙醇产生的OH等自由基会促进反应的进行,从而导致混合燃料的着火滞燃期缩短。

