耐药脊柱结核术后并发窦道患者实施个体化治疗的临床效果(附24例短期疗效分析)
张会军 鲁增辉 谭淦文 朱昌生
近年来,耐药脊柱结核患者比例不断升高,如果治疗不当会导致疾病的迁延复发,其致残率高、治疗难度大[1]。其中脊柱结核术后极易发生并发症,形成窦道是最常见的并发症之一。术后一旦形成窦道,其治疗周期长、效果差、难愈合;有的患者反复形成窦道,甚至多次手术治疗,严重影响患者的生活质量,给患者及其家庭带来很大的经济负担、心理负担和生活负担。关于耐药脊柱结核术后并发皮肤窦道患者的保守治疗,文献鲜有报道。因此,为了帮助解决耐药脊柱结核术后发生皮肤窦道的治疗,提供有益的临床参考,本研究收集西安市胸科医院骨科2015年1月至2017年1月收治的24例术后并发皮肤窦道的耐药脊柱结核患者,评价其个体化化疗的短期疗效。
对象和方法
一、临床资料
收集2015年1月至2017年1月西安市胸科医院入住的耐药脊柱结核术后并发皮肤窦道的患者,共24例。所有患者均经组织病理检查确诊为脊柱结核,且脓液或肉芽组织或其他相关标本(包括胸腔积液、痰液、脑脊液等)进行结核分枝杆菌培养阳性。本组24例患者均采用BACTEC MGIT 960分枝杆菌液体培养系统和改良罗氏固体培养基对临床样本进行平行接种,分离培养分枝杆菌,培养阳性者采用绝对浓度法进行抗结核药物的药物敏感性试验(简称“药敏试验”),表型药敏试验结果显示对一线药物异烟肼、利福平、硫酸链霉素、盐酸乙胺丁醇存在不同程度耐药。根据患者一线药物耐药特点,分为单耐药组、耐多药组(对一种以上的抗结核药物至少包括异烟肼、利福平耐药)和多耐药组(对一种以上的一线抗结核药物耐药,但不包括同时对异烟肼、利福平耐药)。其中,单耐药8例,多耐药8例,耐多药8例。
24例患者中,男15例,女9例;年龄21~69岁,平均(41.5±12.4)岁;手术时间150~300 min,平均(206.3±35.1) min;窦道形成时间为术后14~210 d,平均(90.6±57.0) d;发生窦道时抗结核药物治疗已经进行了36~246 d,平均(112.0±56.7) d。24例患者中16例并发肺结核,6例并发结核性胸膜炎;24例患者中包括胸椎结核7例,胸腰段结核10例,腰椎结核6例,腰骶段结核1例;累及3个椎体4例,2个椎体16例,1个椎体4例。其中5例行单纯后路病灶清除加植骨融合术及内固定术,11例行单纯前路病灶清除加植骨融合术及内固定术,8例行前后路联合手术(后路固定及植骨融合术、前路病灶清除术)。
二、纳入和排除标准
1. 纳入标准(同时满足以下条件):(1)脊柱结核病灶清除和(或)内固定术后;(2)手术切口或引流管口并发窦道,且窦道内病灶标本普通菌培养阴性,无混合感染;(3)患者结核分枝杆菌培养阳性且药敏试验结果提示对一线抗结核药物存在不同程度的耐药;(4)患者个人原因(身体情况差、经济等)无手术条件或拒绝再次手术的保守治疗患者。
2. 排除标准: (1)随访时间<12个月的患者;(2)对化疗依从性差,不能配合的患者;(3)死亡或失访患者;(4)窦道通过长期换药(>3个月)仍不能愈合,随即进行了再次手术者。
三、换药方法
24例患者在个体化抗结核药物治疗方案基础上,坚持窦道每隔一日换药一次,同一品牌碘伏消毒,均采用我院统一消毒的换药盒。换药方法:窦道口周围用碘伏常规消毒,由边缘向中心,用刮勺反复适度刮除坏死病灶和肉芽,采用含0.1 g异烟肼的纱条填塞窦道,无菌纱布包扎。
四、个体化抗结核药物治疗方案的制定
根据入选患者对一线抗结核药物的药敏试验结果,参考患者既往抗结核药物化疗(anti-tuberculosis treatment ATT)史及《耐药结核病化学治疗指南(2015)》[2]的要求,调整化疗方案:(1)尽可能使用敏感的一线抗结核药物;(2)使用1种敏感的注射剂(氨基糖苷类或卷曲霉素);(3)使用1种氟喹诺酮类药物;(4)必要时加用二线抗结核药物,以组成5联化疗方案,其中,耐利福平(RR)者按照耐多药方案选药,化疗时间24个月。
单耐药组:单耐异烟肼者3例,采用6Am/Cm-Lfx-RFP-PZA-EMB/18RFP-PZA-EMB-Lfx化疗方案;其中阿米卡星(Am)0.4 g/次,1次/d,静脉滴注;卷曲霉素(Cm)0.75 g/次,1次/d,静脉滴注;利福平(RFP)0.6 g/次,1次/d,口服;吡嗪酰胺(PZA)1.5 g/次,1次/d,口服;乙胺丁醇(EMB)1.0 g/次,1次/d,口服;左氧氟沙星(Lfx)0.4 g/次,1次/d,口服。单耐链霉素者5例,采用6Lfx-RFP-PZA-EMB-INH/18RFP-INH-PZA-EMB-Lfx化疗方案;其中RFP 0.6 g/次,1次/d,口服;异烟肼(INH)0.4 g/次, 1次/d,口服;PZA 1.5 g/次,1次/d,口服;EMB 1.0 g/次,1次/d,口服;Lfx 0.4 g/次,1次/d,口服。
耐多药组:同时耐异烟肼、利福平和链霉素者8例,采用6Cm/PAS-Lfx(Mfx)-Pto-PZA-EMB/18Pto-PAS-PZA-EMB-Lfx(Mfx)化疗方案;其中Cm 0.75 g/次,1次/d,静脉滴注;对氨基水杨酸(PAS)8.0 g/次,1次/d,静脉滴注,6个月后改口服;Lfx或莫西沙星(Mfx)0.4 g/次,1次/d,口服;丙硫异烟胺(Pto)0.2 g/次,3次/d,口服;PZA 1.5 g/次,1次/d,口服;EMB 1.0 g/次,1次/d,口服。同时耐利福平、异烟肼、乙胺丁醇和链霉素者3例,采用6Cm-PAS-Lfx(Mfx)-PZA-Pto/18Pto-PZA-Lfx-PAS-PAS化疗方案;其中Cm 0.75 g/次,1次/d,静脉滴注;PAS 8.0 g/次,1次/d,静脉滴注,6个月后改口服;Lfx或Mfx 0.4 g/次,1次/d,口服;PZA 1.5 g/次,1次/d,口服;Pto 0.2 g/次,3次/d,口服。
多耐药组:耐异烟肼和链霉素者3例,采用6Cm/PAS-Lfx(Mfx)-RFP-PZA-EMB/18Rfp-PZA-EMB-Lfx(Mfx)-PAS化疗方案;其中Cm 0.75 g/次,1次/d,静脉滴注;PAS 8.0 g/次,1次/d,静脉滴注,6个月后改口服;Lfx或Mfx 0.4 g/次,1次/d,口服;RFP 0.6 g/次,1次/d,口服;PZA 1.5 g/次,1次/d,口服;EMB 1.0 g/次,1次/d,口服。耐异烟肼、链霉素和乙胺丁醇者3例,采用6PAS/Cm-Lfx(Mfx)-RFP-PZA-Pto/18RFP-PZA-Pto-Lfx(Mfx)-PAS化疗方案;其中PAS 8.0 g/次,1次/d,静脉滴注,6个月后改口服;Cm 0.75 g/次,1次/d,静脉滴注;Lfx/Mfx 0.4 g/次,1次/d,口服;RFP 0.6 g/次,1次/d,口服;PZA 1.5 g/次,1次/d,口服;Pto 0.2 g/次,3次/d,口服。耐利福平和乙胺丁醇者1例,采用6PAS/Cm-Lfx/Mfx-INH-PZA-Pto/18INH-PZA-Pto-Lfx/Mfx-PAS化疗方案;其中PAS 8.0 g/次,1次/d,静脉滴注,6个月后改口服;Cm 0.75 g/次,1次/d,静脉滴注;Lfx/Mfx 0.4 g/次,1次/d,口服;INH 0.4 g/次,1次/d,口服;PZA 1.5 g/次,1次/d,口服;Pto 0.2 g/次,3次/d,口服。耐利福平和链霉素者1例,采用6PAS/Cm-Lfx/Mfx-INH-PZA-EMB/18INH-PZA-EMB-Lfx/Mfx-PAS化疗方案,其中PAS 8.0 g/次,1次/d,静脉滴注,6个月后改口服;Cm 0.75 g/次,1次/d,静脉滴注;Lfx/Mfx 0.4 g/次,1次/d,口服;INH 0.4 g/次,1次/d,口服;PZA 1.5 g/次,1次/d,口服;EMB 1.0 g/次,1次/d,口服。
五、疗效评价
观察患者窦道愈合的时间及血红细胞沉降率(ESR)与C反应蛋白(CRP)变化,即患者入组时、入组后1个月时、入组后3个月时、入组后6个月时和入组后12个月时的ESR、CRP的检测值变化。观察窦道外观变化和窦道CT表现变化:分别于患者入组时、入组后1个月、入组后3个月、入组后6个月和入组后12个月时观察患者窦道外观变化和CT表现变化,判断耐药脊柱结核术后并发窦道的愈合情况。
六、统计学处理
结 果
一、窦道愈合时间
24例患者窦道经过个体化抗结核治疗后均愈合。窦道的平均愈合时间:单耐药组为18~52 d,平均(36.7±10.3) d;多耐药组为53~96 d,平均为(71.7±13.6) d;耐多药组为68~260 d,平均为(141.2±39.7) d。通过三组患者窦道愈合时间可以看出,单耐药组患者的窦道愈合时间较多耐药组和耐多药组患者窦道愈合时间短,差异均有统计学意义(t=-4.804,P<0.05;t=-4.989,P<0.05);多耐药组较耐多药组愈合时间短,差异有统计学意义(t=-3.197,P<0.05)。
二、ESR和CRP变化
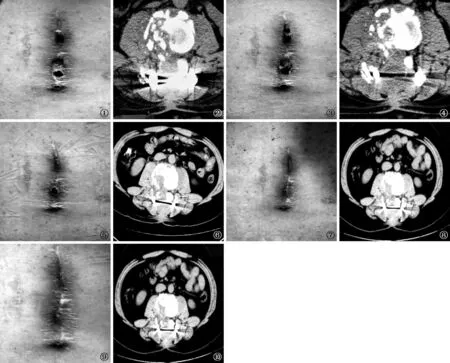
图1~10 患者,男,43岁。于2016年7月13日在西安市胸科医院住院治疗。图1:患者入院时(2016年7月13日)可见明显的手术切口窦道形成。 图2:入院时(2016年7月13日)CT检查,显示内固定术后椎体骨质破坏及较多坏死骨粒,腰大肌水肿。 图3:患者治疗1个月时(2016年8月14日)窦道仍未愈合,内仍有坏死肉芽组织和水肿。 图4:患者治疗1个月时(2016年8月14日)CT复查,显示内固定术后椎体骨质破坏及少量坏死骨粒。图5:患者治疗3个月时(2016年10月13日)窦道部分愈合,较前好转。 图6:患者治疗3个月时(2016年10月13日)CT复查,显示内固定术后椎体骨质破坏及少量坏死骨粒。 图7: 患者治疗6个月时(2017年1月15日)窦道大部分愈合,较前明显好转。 图8: 患者治疗6个月时(2017年1月15日)CT复查,显示内固定术后椎体骨质破坏及少量坏死骨粒,与前比较变化不大。图9: 患者治疗12个月时(2017年7月11日)换药,窦道已经全部愈合。 图10: 患者治疗12个月时(2017年7月 11日)CT复查,显示内固定术后椎体骨质破坏及少量坏死骨粒
患者入组时ESR为27~120 mm/1 h,平均(77.4±24.5) mm/1 h;入组1个月时ESR复查为33~112 mm/1 h,平均(70.0±20.8) mm/1 h;入组3个月时ESR复查为28~87 mm/1 h,较前有所下降。入组6个月时复查较前2次明显下降,平均(28.5±10.4) mm/1 h。入组12个月时为平均(14.6±5.5) mm/1 h,恢复至正常(0~20 mm/h)。
患者入组时的CRP为42~121 mg/L,平均(79.1±18.0) mg/L;入组1个月复查时CRP为21~102 mg/L,平均(49.0±23.3) mg/L,较前有所下降。入组3个月CRP为10~65 mg/L,平均(21.3±11.4) mg/L,较前明显下降。入组6个月时平均(6.3±4.1) mg/L,入组12个月时平均为(2.8±1.3) mg/L。恢复至正常(0~6 mg/L)。
三、窦道外观和窦道CT表现变化
入组患者的窦道变化,在个体化抗结核药物治疗方案的基础上,结合隔日一次的窦道换药,分别观察窦道外观变化、窦道CT表现的变化。入组时窦道皮肤缺损多而明显,多伴脓性分泌物;CT扫描可以观察到骨质缺损破坏,术后残留的病灶及死骨,部分患者并发椎旁软组织水肿。患者治疗1个月时窦道仍未愈合,内仍有坏死肉芽组织和水肿,CT复查显示椎体骨质破坏及少量坏死骨粒。患者治疗3个月时可见窦道部分愈合,较前好转,CT复查显示椎体骨质破坏及少量坏死骨粒,与前比较变化不明显。患者治疗6个月时窦道大部分愈合,较前明显好转,CT复查显示椎体骨质破坏及少量坏死骨粒,与前比较变化不大。患者治疗12个月时窦道已经全部愈合,CT复查显示椎体骨质破坏及少量坏死骨粒无变化。典型病例见图1~10。
四、随访情况
24例入组患者随访12~24个月,平均(19.8±4.5)个月。其中15例随访24个月,5例随访18个月,4例随访12个月。末次随访时21例患者窦道已经愈合;3例明显好转,未愈合,残留窦道口有少量渗液,无再次窦道形成。
讨 论
一、耐药脊柱结核术后并发窦道概况
随着结核分枝杆菌耐药性的不断出现,我国结核病耐药情况十分突出,耐药脊柱结核的治疗中复治及术后复发患者比例不断增高,且治愈困难[3]。尤其是复发复治耐药脊柱结核伴严重并发症者,术后出现难愈合的窦道为主要表现之一,若不及时诊治,其病死率及致残率较高,预后不佳,对患者和社会造成沉重负担,成为当今结核病治疗领域的难点,可归入复杂性脊柱结核[4]。耐药脊柱结核术后并发窦道的患者治疗难度大、时间长、效果差、花费多,如果没有得到及时、有效的治疗,对患者的生活质量会造成极大的影响[5]。
耐药脊柱结核术后并发难治性窦道的部分患者需要再次手术治疗,而手术治疗应以有效的药物治疗为前提,对于久治不愈的窦道、脊髓或神经根受压、脊柱不稳或重度畸形、调整后个体化药物治疗效果不佳病情恶化者需手术治疗[6]。然而,仍有部分患者不需要再次手术治疗,采取保守治疗依然可以取得满意效果。本研究中入选的患者根据手术切口或引流管口并发皮肤窦道的特点、患者耐药情况、患者自身条件等情况进行选择。根据结核分枝杆菌药敏试验及耐药情况,制定个体化抗结核治疗方案,并坚持通过窦道换药逐步愈合,避免了再次手术的创伤、痛苦和经济浪费。
二、耐药脊柱结核术后并发窦道的原因
耐药脊柱结核术后并发窦道一般是因为术前准备不充分、不合理化疗导致。特别对于术前处于结核活动状态的患者,病情发展快,伴有发热、脓肿迅速增大、ESR加快、CRP检测值较高,患者卧床休息及抗结核药物治疗时间不够。在此情况下急于手术,则很容易复发。因此,术前有必要参考ESR、CRP检测值或早期的结核分枝杆菌培养、药敏试验结果、GeneXpert技术等实验室相关检查结果,对于手术时机的选择有重要意义[7-8]。ESR和CRP在临床上通常作为检测脊柱结核活动情况和严重程度的重要指标,有学者认为术前 ESR和CRP检测正常才是最合适的手术时机[9]。笔者通过回顾性分析24例患者的ESR和CRP检测结果,经过积极的个体化化疗,其检测值是逐渐下降的,末次随访时基本恢复至正常,说明个体化的抗结核药物治疗是有效的,故认为此两项指标对判断耐药脊柱结核术后皮肤窦道是否愈合有指导和参考意义。
耐药菌株的不断产生和传播,会导致原发性耐药菌株的不断增加[10],特别是耐多药结核分枝杆菌的增多、不典型结核分枝杆菌感染等原因可导致脊柱结核患者治疗失败或复发的概率增大[11-12]。在脊柱结核的治疗过程中,医生对耐药结核病尚缺乏足够的认识。如术后抗结核药物治疗时间超过3周,患者的结核毒性症状并未见明显改善,甚至部分患者病情恶化或影像学检查发现局部植骨吸收、内固定失败、病灶复发等情况,这些都提示可能为耐药菌株所致[13]。
术后不规律的抗结核药物化疗,以及患者局部制动和卧床时间不够等也是引起脊柱结核治疗失败、复发的原因之一。董伟杰等[14]研究指出,耐药脊柱结核主要是获得性耐药,原因在于不能遵循严格的抗结核药物规范治疗及督导不严密引起。由于结核分枝杆菌培养阳性率低,耐药诊断困难,因此,应当努力提高结核分枝杆菌培养阳性率,这对于提高骨关节结核的治愈率起着关键性的作用。同时,如果手术治疗失败,术后出现切口窦道及脓肿复发,应按照耐药脊柱结核进行处理。
病灶范围广、多节段病变的患者容易出现病灶清除不彻底。造成病灶清除不彻底的原因包括:(1)麻醉不充分、肌肉紧张,影响术者操作和病灶的暴露;(2)病灶暴露不佳,遗留死骨、脓肿或干酪样物质;(3)椎体结核病灶清除的切口选择不当, 无法做到充分外暴露和内暴露;(4)病灶椎体定位错误,未能取出病灶内容;(5)术者操作不仔细,遗漏病变;(6)病灶混合感染,严重的患者可出现窦道长期不愈合。
根据我科治疗经验,中小类窦道伴较少渗液和病灶,可经单纯多次换药保守治疗而愈合,较大的窦道伴较多积液和坏死病灶,愈合较困难,可以考虑手术干预处理。这与文献[15-16]的报道是一致的。
三、术后基于药敏试验的个体化抗结核药物治疗方案
脊柱结核属于全身感染性疾病,全身抗结核药物化疗是脊柱结核治愈的基础[17]。药物治疗应贯穿于治疗的全过程,必须严格执行化疗的原则,保证体内活动性结核分枝杆菌得到控制,结核病变趋于相对静止或静止状态。在耐药脊柱结核的临床药物治疗中,主要原则为尽早、联合、定量、定期、全面。耐药患者结核分枝杆菌耐药性的影响因素和严重程度各有其特点,对于不同特点的患者,临床化疗方案是不尽相同的;需要充分地评估患者自身的具体情况,在密切结合药敏试验结果的基础上为患者制定科学有效的临床治疗计划[18]。
脊柱结核病灶中耐药结核分枝杆菌仍以对一线抗结核药物(异烟肼、利福平、链霉素、乙胺丁醇)耐药为主,提高脊柱结核的结核分枝杆菌培养阳性率并获取可靠的药敏试验结果,才能够给予患者合理的抗结核治疗方案,对防止耐药结核病的发生有重要意义。根据药敏试验结果选择合理的药物和治疗方案是耐药脊柱结核治疗的方向,是治愈耐药脊柱结核的有效策略。本研究24例患者进行了脓液或肉芽组织等标本的结核分枝杆菌培养,均显示阳性;同时有明确的一线抗结核药物药敏试验结果为耐药的依据。随后制定了个体化的耐药结核病化疗方案,并结合窦道进行长期换药的辅助治疗,通过短期随访观察,效果良好。
对耐药脊柱结核应结合既往抗结核药物化疗、药敏试验结果及按照我国《耐药结核病化学治疗指南(2015)》的要求来指导临床用药,必要时参考WHO[19]《耐药结核病治疗指南(2016更新版)》制定个体化化疗方案。化疗方案中至少包括2种或3种敏感药物,强化期最好有5种有效的抗结核药物,巩固期至少3种药物联合使用,坚持联合用药,避免单一给药;氟喹诺酮类为首选药物,并至少选择一种注射类药物[20]。耐药脊柱结核的治疗必须有足量、足够的疗程,强化期需4个月,疗程至少18~24个月,在手术治疗后,亦应不少于18个月[21]。不因手术而缩短化疗时间,18~24个月的化疗仍是针对耐多药结核病的标准治疗方案。同时还需注意以下几点:避免向证明已经失败的化疗方案中添加单药;避免使用易引起不良反应且价格昂贵的药物;应加强对患者进行健康教育、实施直接督导下的化疗,并鼓励患者坚持治疗;同时密切监测药物不良反应[22]。
四、 换药对耐药脊柱结核术后并发窦道的意义
本组入选的24例耐药脊柱结核术后并发窦道的患者,既往接受过时间不一、不规范的抗结核药物治疗。对于耐药脊柱结核术后并发窦道的治疗,文献鲜有报道;其主要治疗方法在临床上有保守治疗和手术治疗。本研究患者均是在个体化的抗结核药物治疗方案基础上,同时通过窦道定期换药进行辅助治疗。笔者认为,个体化的抗结核药物化疗方案是治疗的根本,换药是促进窦道愈合的辅助治疗手段,二者相辅相成,对于窦道的愈合均有重要意义。通过短期观察,在有效抗结核药物治疗的基础上进行窦道换药,可以解决窦道长期不愈合、难愈合的问题,尤其是既往经历过多次手术、无法耐受手术者,是可供选择的方法之一。它不仅可以减少患者反复手术的创伤、减轻经济负担,而且可以提高患者生活质量,同时节约医疗成本。
综上所述,耐药脊柱结核术后并发皮肤窦道的治疗较为棘手,既要重视合适的手术方式及手术时机,更要正确设计并采用正规、有效的个体化药物化疗方案;另外,要对患者的全身营养状况进行调理。本研究局限之处在于患者例数较少,并且为单中心回顾性研究,有待开展多中心大样本的前瞻性研究。

