血清尿酸及C反应蛋白与恶性实体肿瘤临床分期的关系
苑小星 杨海芳
近年来,恶性肿瘤发病率和死亡率呈上升趋势。2017年中国肿瘤登记年报资料显示,全国每天约1万例确诊为癌症。癌症是环境因素(吸烟、饮食习惯不良、环境污染、药物、辐射、感染)和体内遗传因素相互作用的结果,是一个多种因素长期作用、多基因损伤和多阶段病理改变的过程。在癌变过程中,肿瘤细胞形成了一套异常代谢模式,其中以糖酵解增高、谷氨酰胺代谢活跃、三羧酸循环和氧化磷酸化改变、脂肪酸氧化异常等最为显著,这为其无限增殖、侵袭转移等恶性表型提供必须的能量及原料,研究人员将涉及肿瘤细胞能量供给的现象定义为肿瘤细胞的能量代谢重编程。癌细胞代谢的改变对肿瘤的生长至关重要,目前已将此列为继生长信号的自我激活、对抑制生长信号的不敏感、逃逸凋亡、无限复制能力、持续的血管生成、组织侵袭、组织转移之后的肿瘤第8大特征。尿酸(UA)是嘌呤核苷酸代谢的最终产物。1982年Ames等[1]提出,UA作为一种抗氧化剂,能有效清除体内具有致癌潜能的超氧自由基。近期研究表明,UA的促炎特性在癌症的发病机制中起着重要作用,可诱导单核细胞趋化因子-1、C反应蛋白(CRP)等炎症介质的表达[2-3]。本文就血清UA及CRP与恶性实体肿瘤临床分期的关系作一探讨,现将结果报道如下。
1 对象和方法
1.1 对象 选取2013年1月至2017年1月本院初诊为恶性实体肿瘤患者的573例为肿瘤组,其中男296例,女 277 例;年龄 28~72(56.83±11.34)岁;肺癌 153例,食管癌55例,胃癌76例,大肠癌124例,乳腺癌62例,卵巢癌103例。同期本院健康体检者200例为对照组,其中男 107 例,女 93 例;年龄 25~75(58.71±13.13)岁。两组对象性别、年龄比较,差异均无统计学意义(均P>0.05)。本研究经医院医学伦理委员会审批通过。
1.2 方法 查询电子病例系统,收集患者临床资料,包括年龄、性别、肿瘤类别、临床分期(肺癌分期依据国际肺癌研究协会的分期标准,乳腺癌、食管癌、胃癌、大肠癌、卵巢癌分期依据美国癌症联合委员会的分期标准)、初诊时血清UA及CRP水平。血清UA水平男性>416.5μmol/L,女性>357.0μmol/L定义为高尿酸血症。
1.3 统计学处理 应用SPSS 22.0统计软件。计量资料用M(P25,P75)表示,组间比较采用秩和检验。血清UA及CRP水平对肿瘤临床分期的影响采用单因素logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组对象实验室指标比较 肿瘤组初诊时血清UA、CRP 水平分别为488.3(327.9,567.7)μmol/L、27.5(16.5,43.1)mg/L,对照组分别为 318.5(227.6,425.4)μmol/L、5.3(2.5,10.4)mg/L,两组对象以上指标比较差异均有统计学意义(均P<0.05)。
2.2 不同类别及临床分期肿瘤患者血清UA及CRP水平比较 肺癌、大肠癌、卵巢癌、胃癌、食管癌、乳腺癌(绝经前、后期)不同临床分期患者血清UA及CRP水平比较,差异均有统计学意义(均P<0.05),均为Ⅲ~Ⅳ期患者高于Ⅰ~Ⅱ期患者,见表1。
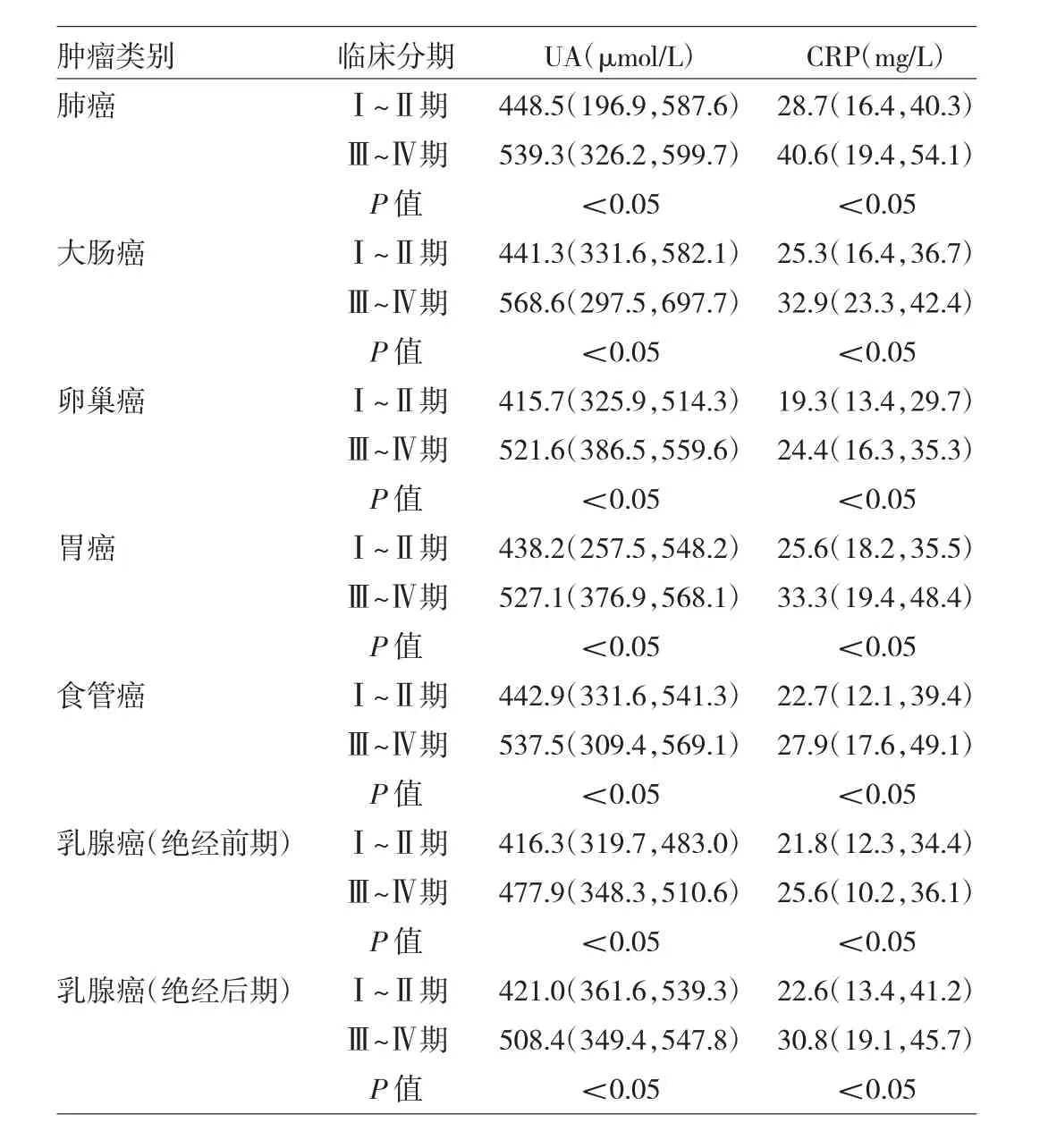
表1 不同类别及临床分期肿瘤患者血清UA及CRP水平比较
2.3 血清UA及CRP水平对肿瘤临床分期的影响经单因素logistic回归分析,血清UA及CRP水平是肺癌、乳腺癌、大肠癌临床分期的影响因素,见表2。

表2 血清UA及CRP水平对肿瘤临床分期的影响
3 讨论
20世纪20年代,德国科学家Warburg首先发现,与正常细胞相比,肿瘤细胞在氧供充足情况下也会优先进行无氧糖酵解,为其生长提供充足的能量,为合成生物大分子提供所需前体。近年来,Warburg效应的内涵被进一步扩展,越来越多证据表明细胞癌变的代谢模式发生了变化。目前对肿瘤代谢异常及其分子基础的研究正在成为前沿领域。
基础医学实验发现,UA通过抑制过氧亚硝酸盐诱导的蛋白质亚硝化、脂质及蛋白质过氧化、四氢生物喋呤失活来清除氧自由基,从而表现其抗氧化的特性[4]。血清UA水平升高与癌症发病及病死风险增加存在相关性,它在癌症生物学中具有复杂的作用。有研究表明,UA具有促炎特性,单尿酸钠盐晶体激活Toll受体可刺激WBC等促炎症细胞因子的产生,并诱导单核细胞趋化蛋白-1、CRP等炎症介质的表达[3,5]。炎症反应所招募的激活巨噬细胞含有大量自由基,可引起细胞损伤;这种炎症坏死激发的细胞增生可使DNA复制错误的概率大大增加[6]。黄嘌呤氧化酶是嘌呤分解代谢途径最后2个步骤中的限速酶,能使次黄嘌呤氧化生成终产物UA。该反应可产生超氧自由基,这种途径被认为是超氧自由基生成的关键来源,可诱发氧化应激和基因突变。有研究表明,在肿瘤组织内,UA水平与脂联素水平呈负相关,且UA可诱导脂联素水平下降[7],而脂联素有明显的抗炎、抑制细胞异常增殖、促癌细胞凋亡等作用[8-11],提示脂联素水平的下降是高尿酸血症与肿瘤发生的间接机制。
一项对78 850例澳大利亚男性人群进行持续12.4年的前瞻性队列研究结果显示,高UA水平(≥472μmol/L)明显增加患癌的风险[12]。对奥地利人群进行的一项前瞻性研究结果发现,高UA水平(男性>398.65μmol/L,女性>321.3μmol/L)是肿瘤相关死亡的独立危险因素[13]。一项关于前瞻性研究的Meta分析结果提示,与低UA者比较,高UA者患癌风险较高(RR=1.11,95%CI:0.95~1.27);血清 UA 水平每升高 59.52μmol/L,患癌风险增加1.03倍;多为肺癌、结肠癌[14]。一项对150例Ⅱ~Ⅲ期结肠腺癌患者的回顾性研究结果显示,其平均血清UA水平为414.72μmol/L;多数Ⅲ期患者血清UA水平>498.02μmol/L,同时也是吸烟者、伴体重下降者、肝转移早发者[15]。对475例新确诊的直肠癌患者进行分析,发现淋巴结转移者较无淋巴结转移者的血清UA水平明显升高,血清UA与CRP、癌胚抗原水平均呈正相关[16]。对158例接受贝伐单抗治疗的转移性结肠癌患者进行UA水平及预后分析,结果显示治疗3个月后UA水平与治疗有效率、总生存期均相关[17]。一项研究对209例行R0根治术后的食管鳞癌患者术前UA水平进行分析,结果发现血清UA为304.5μmol/L时,灵敏度(0.67)和特异度(0.65)均较高;术前 UA水平>304.5μmol/L者,其生存期较短[18]。对384例Ⅲb~Ⅳ期非小细胞肺癌患者的研究结果显示,化疗前高UA者(>441.91μmol/L)脑转移发生率较高,生存期较短[19]。本研究结果显示,恶性实体肿瘤患者体内核苷酸代谢存在明显异常;初诊时血清UA水平是肺癌、乳腺癌、大肠癌临床分期的影响因素。
临床上癌症患者伴UA异常的情况十分常见,目前关于是否控制肿瘤患者UA水平仍存在争议。对于无症状高尿酸血症的肿瘤患者,由于目前无相关指南及共识指导,易被忽略处理,往往会导致肾炎、肾功能衰竭、关节病变等,使肿瘤规范化治疗受限。对于部分肿瘤患者,高UA水平是保护因素,若盲目降低UA水平则可能诱发或促进肿瘤进展。当发生组织损伤、感染、肿瘤、心肌梗死及急慢性炎症性疾病时,CRP会升高,从而加强吞噬细胞的作用,及时清除病原微生物及坏死的组织细胞碎片。本研究结果显示,恶性肿瘤患者血清UA及CRP水平均明显升高,且是肺癌、乳腺癌、结肠癌临床分期的影响因素。

