姜黄素类似物J7对2型糖尿病大鼠肾脏的保护作用
姬秀焕 章琼莹 池琛 吴谷 李慧敏 陈国荣
糖尿病是严重的国际性公共卫生问题。糖尿病肾病(DN)是糖尿病主要的微血管并发症。高血糖导致的氧化应激增强是DN的重要发病机制,而抗氧化应激是防治DN的重要措施[1]。高血糖引起的生长因子表达异常也是DN的重要发病机制,其中转化生长因子β(TGF-β)的作用尤其突出[2]。研究表明,TGF-β/人信号转导因子(Smad)信号通路与DN发生、发展及肾脏纤维化密切相关[3]。姜黄素(CUR)是从姜黄的干燥根茎中提取出来的黄色色素,目前许多研究表明CUR对多种疾病具有良好的脏器保护作用[4-6]。然而,CUR在生理条件下不稳定、吸收较差,使其应用受到了限制。新型CUR类似物J7去除了不稳定基团,在代谢、生物利用度等方面均优于CUR,能更好地发挥其药理作用,具有良好的临床应用前景[7]。但目前尚无CUR类似物J7对DN保护作用及相关机制的研究。本研究通过建立2型糖尿病(T2DM)大鼠模型,使用CUR类似物J7、CUR进行药物干预,以探讨CUR类似物J7对T2DM大鼠肾脏的保护作用及可能机制,为防治DN提供新的实验依据。
1 材料和方法
1.1 动物及试剂 无特定病原体(SPF)级雄性SD大鼠60只,体重180~220g,由温州医科大学实验动物中心提供。CUR类似物J7、CUR均由温州医科大学药学院惠赠;羧甲基纤维素钠购自美国Sigma公司;链脲佐菌素(STZ)购自上海润朗生物科技有限公司;胰岛素放免试剂盒购自上海瑞齐生物科技有限公司;超氧化物歧化酶(SOD)试剂盒及丙二醛(MDA)试剂盒购自南京建成生物工程研究所;兔抗大鼠B淋巴细胞瘤-2基因相关X蛋白(Bax)、B 淋巴细胞瘤-2基因(Bcl-2)、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自美国Cell Signaling Technology公司;兔抗大鼠TGF-β1多克隆抗体、兔抗大鼠Smad7多克隆抗体均购自美国Antibody Cambridge公司;辣根过氧化物酶标记的山羊抗兔IgG购自美国Bioworld公司;山羊抗兔单克隆抗体(二抗)PV6001购自北京中杉金桥生物技术有限公司。
1.2 模型建立及分组给药 SD大鼠适应性喂养1周后,采用抽签法随机分出10只为正常对照(NC)组,其余50只为实验组。参考文献[8]的造模步骤,实验组通过高脂高糖饮食喂养大鼠4周,单次腹腔注射STZ(30mg/kg)诱导T2DM模型。喂养过程中有4只大鼠死亡;喂养结束后,6只大鼠尾静脉空腹血糖(FBG)<16.7mmol/L,造模失败予以剔除。最终有40只大鼠造模成功。造模成功后,实验组40只大鼠按抽签法随机分为模型组、CUR治疗组、J7低剂量(LJ7)治疗组、J7高剂量(HJ7)治疗组,每组10只。CUR组、LJ7组、HJ7组分别予20mg/kgCUR、10mg/kg J7、20mg/kg J7(CUR、J7 溶于 1%羧甲基纤维素钠)灌胃1次/d,每次灌胃量按1ml/100g体重计算得出,另两组分别给予同等容积羧甲基纤维素钠灌胃,持续8周。实验期间,实验组持续给予高脂高糖饮食,NC组给予普通饮食。实验结束后处死大鼠。
1.3 大鼠体重及肾脏组织称重 实验结束时,使用电子秤测量安静状态下大鼠体重。实验结束后,10%水合氯醛腹腔注射麻醉大鼠并作股动脉放血处死,解剖大鼠两侧完整的肾脏组织,称重并计算肾重指数。肾重指数=肾重(g)/体重(100g)×100.0%。
1.4 血生化指标检测 处死大鼠后收集血清,采用放射免疫法测定FBG,使用自动生化分析仪测定血肌酐(Scr)、尿素氮(BUN)。
1.5 肾脏组织病理形态观察 (1)HE染色:常规石蜡包埋、切片,HE染色,光镜下观察各组大鼠肾脏肾小球结构、肾小球平均横截面积、毛细血管管腔及系膜区基质增生情况。(2)Masson染色:常规石蜡切片,红色Masson液染色,光镜下观察肾脏组织中肾小球基底膜和系膜基质的胶原纤维染色情况。其中肾小球基底膜和系膜基质的胶原纤维被染成亮绿色,细胞质被染成红色,细胞核被染成蓝色。(3)PAS染色:常规石蜡切片,Schiff试剂染色,光镜下观察肾脏组织中肾小球基底膜和系膜基质的胶原纤维染色情况。其中肾小球基底膜和肾小球系膜基质被染成紫红色。(4)电镜下观察:制备半薄切片及超薄切片,半薄切片甲苯胺蓝染色定位并制作超薄切片(厚度100nm);醋酸双氧铀、柠檬酸铅双重染色;在H-7500日立透射电子显微镜下观察大鼠肾小球超微结构。
1.6 肾脏组织MDA水平及SOD活性检测 取1g大鼠肾脏组织,加0.9%氯化钠溶液研磨,制成10%组织匀浆,2 500r/min低温离心10min,取上清液。二辛可宁酸(BCA)法测定蛋白浓度。上清液稀释10倍后,采用硫代巴比妥酸法检测肾皮质内MDA水平,羟胺法检测SOD活性,检测步骤按照试剂盒操作说明进行。
1.7 肾脏组织TGF-β1蛋白表达检测 采用免疫组化染色法。石蜡切片、脱蜡至水,3%H2O2室温阻断20min,高温高压修复,山羊血清封闭,兔抗大鼠TGF-β1一抗(1∶1 000的稀释比)4℃过夜,辣根过氧化物酶标记的山羊抗兔二抗37℃孵育,DAB显色,苏木素复染,常规梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜观察。结果判读:以PBS代替一抗作为阴性对照,以细胞质内出现棕黄色细颗粒样物质为阳性表达,每张切片随机选取10个肾皮质肾小球高倍镜视野(400倍)观察。
1.8 肾脏组织 Bax、Bcl-2、TGF-β1、Smad7 蛋白相对表达量检测 采用Western blot法。常规制备肾脏组织匀浆,Bradford 法检测 Bax、Bcl-2、TGF-β1、Smad7 蛋白浓度,配胶、上样、电泳,以恒流230mA转膜90min,5%脱脂牛奶室温封闭 1.5h,抗 Bax(1∶1 000)、抗 Bcl-2(1∶1 000)、抗 TGF-β1(1∶1 000)、抗 Smad7(1∶1 000)一抗4℃孵育过夜。辣根过氧化物酶标记的二抗室温孵育1h。化学发光显影定影,以GAPDH抗体为内参,使用Bio-Rad Quantity One 4.6凝胶成像分析系统拍照,Image-Pro Plus 6.0图像分析系统对各条带进行相对定量分析。
1.9 统计学处理 应用GraphPad Prism 5.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般状态比较 给药期间,NC组大鼠体型正常,活动正常,毛发顺滑有光泽;模型组大鼠体型瘦弱,多饮、多食、多尿,行动迟缓,精神萎靡,毛发干燥、色黄;CUR组、LJ7组和HJ7组症状明显减轻。实验结束时各组大鼠体重及肾重指数比较,差异均有统计学意义(均P<0.05)。与NC组比较,模型组大鼠体重明显降低,肾重指数明显升高,差异均有统计学意义(均P<0.05);与模型组比较,CUR组、LJ7组和HJ7组大鼠体重稍增加,肾重指数稍下降,差异均无统计学意义(均P >0.05),见表 1。
2.2 各组大鼠血生化指标比较 实验结束时各组大鼠FBG、Scr、BUN水平比较,差异均有统计学意义(均P<0.05)。与NC组比较,模型组FBG、Scr、BUN水平均明显升高,差异均有统计学意义(均P<0.05)。与模型组比较,CUR组、LJ7组和HJ7组FBG水平均明显下降,差异均有统计学意义(均P<0.05);Scr、BUN水平比较差异均无统计学意义(均P>0.05),见表2。
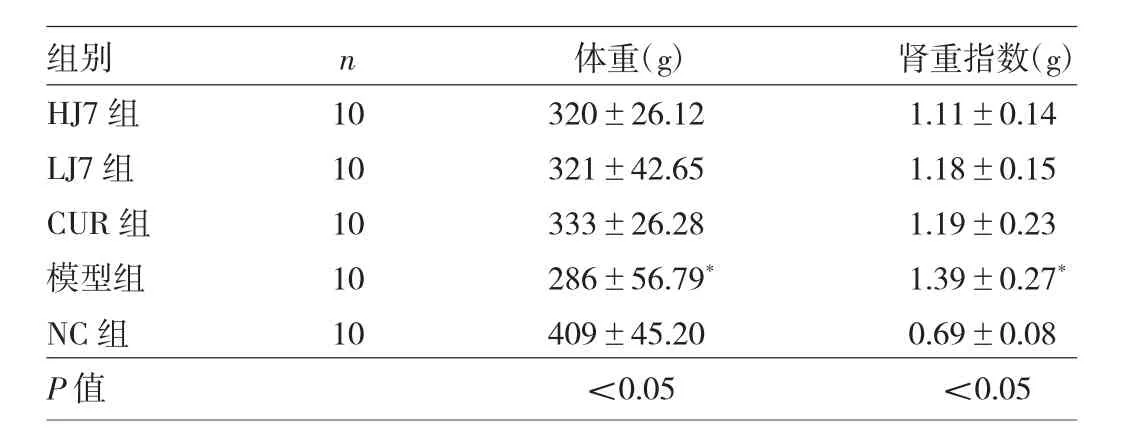
表1 实验结束时各组大鼠体重及肾重指数比较
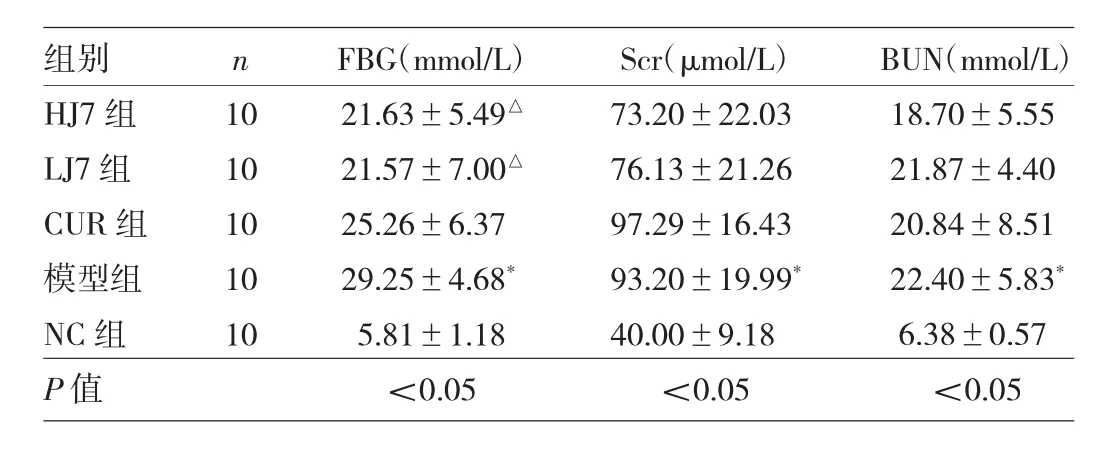
表2 实验结束时各组大鼠血生化指标比较
2.3 大鼠肾脏组织光镜下组织病理学变化
2.3.1 各组大鼠肾脏组织HE染色结果 NC组大鼠肾小球毛细血管管腔规则,管壁菲薄,见图1a(插页);模型组大鼠肾小球平均横截面积增大,肾小球肥大,毛细血管袢蜷曲紊乱,系膜基质增生,见图1b(插页);CUR组、LJ7组和HJ7组肾小球肥大程度较模型组减轻,肾小球平均横截面积减小,特别HJ7组肾小球体积接近正常,形态规则,系膜基质增生明显减少,见图1c-e(插页)。
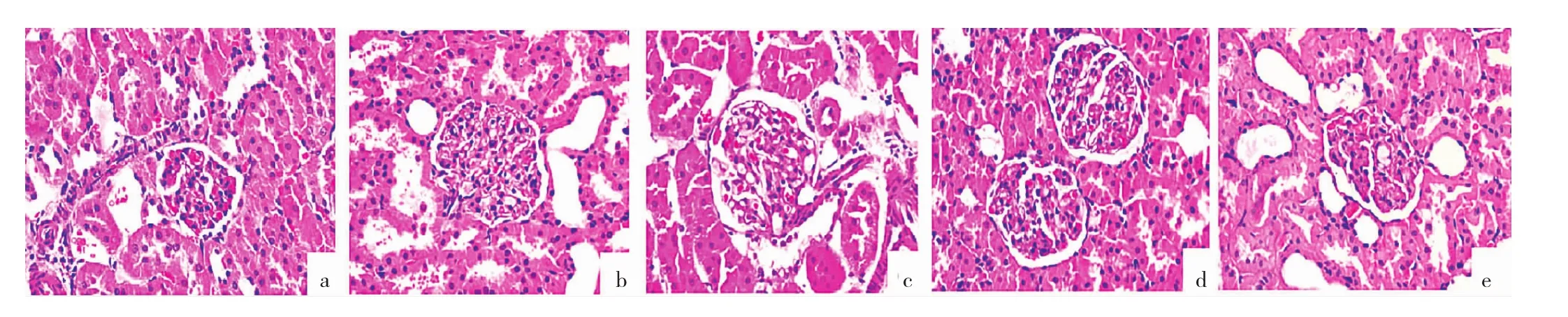
图1 各组大鼠肾脏组织 HE 染色结果(a:NC 组;b:模型组;c:CUR 组;d:LJ7 组;e:HJ7 组;×400)

图2 各组大鼠肾脏组织 Masson 染色结果(a:NC 组;b:模型组;c:CUR 组;d:LJ7 组;e:HJ7 组;×400)
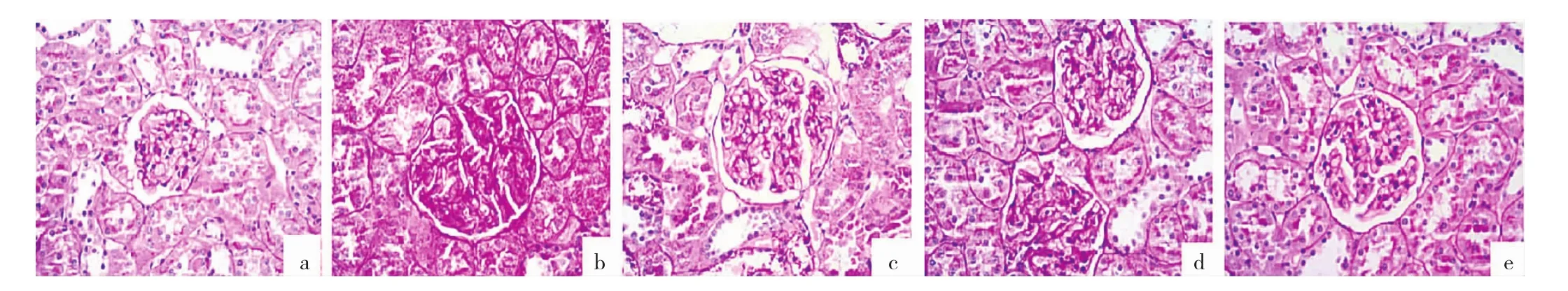
图3 各组大鼠肾脏组织 PAS 染色结果(a:NC 组;b:模型组;c:CUR 组;d:LJ7 组;e:HJ7 组;×400)

图5 各组大鼠肾脏组织 TGF-β1 免疫组化染色结果(a:NC 组;b:模型组;c:CUR 组;d:LJ7 组;e:HJ7 组;Envision 染色,×400)
2.3.2 各组大鼠肾脏组织Masson染色结果 NC组大鼠肾小球毛细血管基底膜可见少量亮绿色胶原纤维,见图2a(插页);模型组大鼠肾小球肥大,亮绿色基底膜和系膜基质明显增多,见图2b(插页);CUR组、LJ7组和HJ7组肾小球肥大程度减轻,肾小球亮绿色胶原纤维较模型组明显稀疏,HJ7组显著减少,接近正常肾小球,见图 2c-e(插页)。
2.3.3 各组大鼠肾脏组织PAS染色结果 NC组大鼠肾小球紫红色基底膜和系膜基质稀疏,见图3a(插页);模型组大鼠肾小球肥大,基底膜增厚,系膜基质增多,见图3b(插页)。CUR组、LJ7组和HJ7组肾小球肥大程度减轻,基底膜和系膜基质紫红色明显减少,HJ7组较为显著,见图3c-e(插页)。
2.4 大鼠肾脏组织电镜下组织病理学变化 NC组大鼠肾小球基底膜厚薄均匀,足细胞形态正常,足突细长,足细胞线粒体数量较多,见图4a;模型组大鼠肾小球基底膜不同程度增厚且厚薄不均,系膜细胞边缘见较多电子密度高的基质沉积,足突肿胀变短,足突融合,足细胞线粒体数目减少,足细胞核膜皱缩退变,见图4b;CUR组、LJ7组和HJ7组基底膜基本恢复正常,CUR组仍可见部分基底膜厚薄不均,LJ7组、HJ7组基底膜厚薄较均匀,足细胞形态相较于模型组恢复正常,足突未见明显肿胀、粗短,未见广泛足突融合现象,足细胞线粒体数目较模型组增多,线粒体未见明显肿胀,其中LJ7组、HJ7组减轻糖尿病肾小球超微结构病变的效果明显,见图4c-e。

图4 透射电镜下观察各组大鼠肾脏组织超微结构(a:NC 组;b:模型组;c:CUR 组;d:LJ7 组;e:HJ7 组;×10 000)
2.5 各组大鼠肾脏组织MDA水平和SOD活性比较各组大鼠肾脏组织MDA水平和SOD活性比较,差异均有统计学意义(均P<0.05)。与NC组比较,模型组大鼠MDA水平明显升高,SOD活性明显降低,差异均有统计学意义(均P<0.05);与模型组比较,CUR组、LJ7组和HJ7组MDA水平明显降低,HJ7组SOD活性明显升高,差异均有统计学意义(均P<0.05),见表3。

表3 各组大鼠肾脏组织MDA水平和SOD活性比较
2.6 各组大鼠肾脏组织TGF-β1免疫组化染色结果NC组肾小球和肾小管细胞质均有弱阳性表达,见图5a(插页);模型组TGF-β1蛋白表达呈强阳性,高倍镜下见细胞质内大量染色较深的棕黄色颗粒物弥漫分布,见图5b(插页);CUR组、LJ7组和 HJ7组TGF-β1蛋白阳性表达强度明显减弱,细胞质内见中等染色强度的棕黄色颗粒弥漫分布,见图5c-e(插页)。
2.7 各组大鼠肾脏组织 Bax、Bcl-2、TGF-β1、Smad7 蛋白相对表达量及Bcl-Bax比较 各组大鼠肾脏组织Bax、Bcl-2、TGF-β1、Smad7 蛋白相对表达量及 Bcl-2/Bax比较,差异均有统计学意义(均P<0.05)。与NC组比较,模型组Bax、TGF-β1蛋白相对表达量均明显升高,Bcl-2、Smad7蛋白相对表达量及Bcl-2/Bax均明显降低,差异均有统计学意义(均P<0.05)。与模型组比较,LJ7组、HJ7组Bax、TGF-β1蛋白相对表达量均明显降低,Bcl-2、Smad7蛋白相对表达量及Bcl-2/Bax均明显升高,差异均有统计学意义(均P<0.05);CUR组Bcl-2蛋白相对表达量及Bcl-2/Bax均明显升高,差异均有统计学意义(均P<0.05),见表4和图6-8。
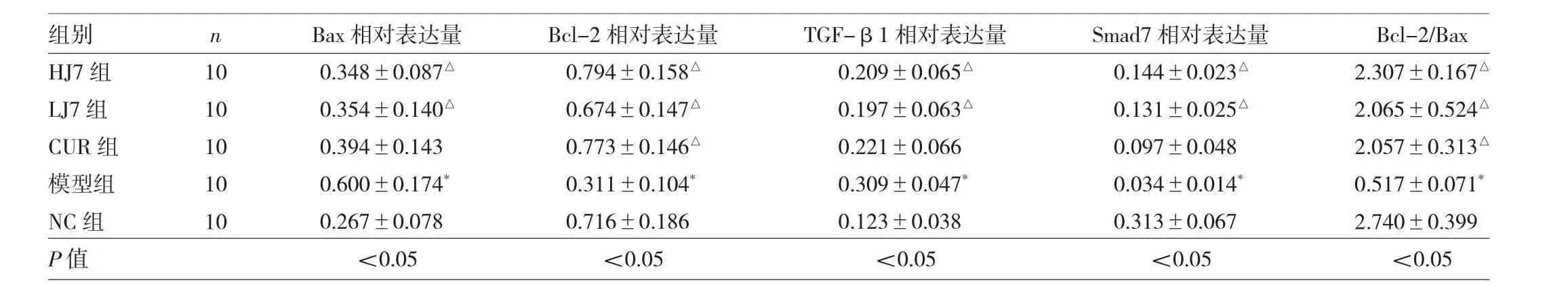
表4 各组大鼠肾脏组织Bax、Bcl-2、TGF-β1、Smad7蛋白相对表达量及Bcl-Bax比较
3 讨论
糖尿病是一种常见的慢性病,DN是糖尿病最主要的微血管并发症,也是糖尿病患者病死的主要原因[3]。糖尿病各种脏器并发症发生的主要原因是长期高血糖水平导致细胞内线粒体生产过剩的活性氧(ROS),使得氧化应激增强,氧化-抗氧化平衡失调,导致ROS积累与细胞损伤[9]。研究表明,糖尿病中ROS的积累会诱导β细胞功能障碍,增加胰岛素抵抗,导致糖尿病相关并发症增多[9]。相关临床研究表明,ROS在DN和终末期肾病的发生、发展中起着重要作用[1,10]。在通常情况下,肾脏通过各种抗氧化剂抵御ROS损伤,如SOD、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX),其中SOD是一种强有力的酶。MDA的产生是由于体内增加的ROS攻击并破坏各种生物膜中的多不饱和脂肪酸,引发脂质过氧化作用。MDA是生物体内脂质过氧化代谢的毒性产物,MDA水平能反映生物体内脂质过氧化的程度,从而间接反映组织细胞氧化应激损伤的程度。本实验模型组大鼠肾脏组织SOD活性降低,MDA水平升高,提示T2DM大鼠氧化应激增强,符合预期结果。经过CUR类似物J7、CUR药物干预后,SOD活性升高,MDA水平降低;提示CUR类似物J7具有抗氧化应激的作用,从而减少脂质过氧化,降低细胞损伤的程度。
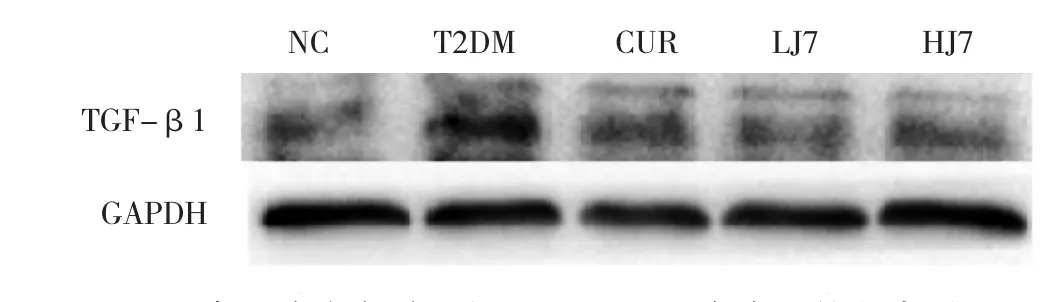
图6 各组大鼠肾脏组织TGF-β1蛋白表达的电泳图
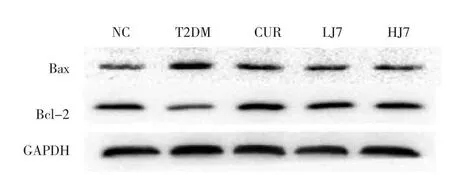
图7 各组大鼠肾脏组织Bax、Bcl-2蛋白表达的电泳图
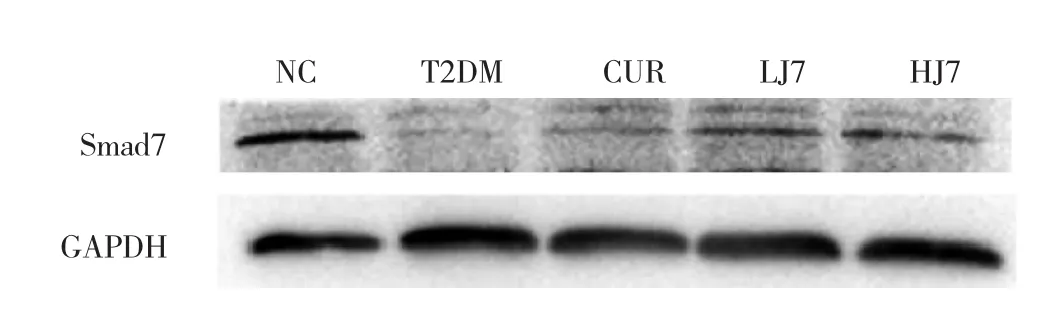
图8 各组大鼠肾脏组织Smad7蛋白表达的电泳图
氧化应激在高血糖诱导的细胞损伤中起关键作用[11]。它能负性调节细胞的生存和寿命,并导致程序性的细胞死亡[12]。Bcl-2蛋白家族(如Bax和Bcl-2)是凋亡相关蛋白,Bax促进细胞凋亡,Bcl-2抑制细胞凋亡。Bcl-2和Bax可形成异源二聚体,抑制细胞色素C释放,进而抑制其下游凋亡相关因子Caspase-3的活化,最终抑制细胞凋亡[11]。Bcl-2/Bax可用来反映抑制细胞凋亡的能力。本实验模型组大鼠Bax蛋白相对表达量明显升高,Bcl-2蛋白相对表达量明显降低,Bcl-2/Bax明显下降,提示T2DM大鼠肾脏组织存在细胞凋亡。在电镜下观察肾小球超微结构,可见模型组大鼠肾小球足突肿胀变短、足突融合、足细胞线粒体数目减少、核膜皱缩退变的病理学改变。经CUR类似物J7治疗后,Bcl-2/Bax升高,提示J7具有抗糖尿病大鼠肾脏组织细胞凋亡的作用;足细胞病理学改变也相对减轻,提示J7具有保护足细胞的作用。
TGF-β1信号通路的启动是糖尿病肾损伤中的一个关键步骤[2]。TGF-β1在DN发生、发展中具有重要作用,参与细胞外基质沉积、肾小球硬化和间质纤维化的发展[13]。在DN中,高血糖环境和氧化应激可启动TGF-β/Smad信号通路,从而促进肾小球系膜基质沉积,促进Ⅰ型和Ⅳ型胶原合成,并且通过抑制蛋白酶活性来减少基质降解,促进肾小球和肾小管间质的纤维化[14-15]。有文献报道,在动物模型中长期给予抗TGF-β1抗体来阻断TGF-β1介导的信号转导通路,可抑制肾小球系膜区增宽[16]。Smad7是抑制性Smad,已知TGF-β1信号通路受Smad7的负调控,可抑制DN肾脏组织的纤维化[14]。本实验模型组大鼠TGF-β1蛋白相对表达量明显升高,纤维化抑制因子Smad7蛋白相对表达量明显降低,与Masson染色和PAS染色显示的模型组大鼠肾小球存在纤维化和基质增多的结果一致;提示TGF-β1蛋白相对表达量升高、Smad7蛋白相对表达量降低可能是引起T2DM大鼠肾脏纤维化和基质沉积的重要原因。本实验造模成功的大鼠经CUR类似物J7治疗后,TGF-β1蛋白相对表达量降低,Smad7蛋白相对表达量升高,Masson染色和PAS染色结果显示相应病理学改变减轻,提示J7具有抗肾纤维化的作用。
综上所述,CUR类似物J7对T2DM大鼠肾脏组织具有保护作用,下调氧化应激水平可能是其抑制肾脏组织细胞凋亡的机制;而直接抑制TGF-β/Smad通路或通过下调氧化应激水平来间接抑制TGF-β/Smad通路可能是其抑制肾组织纤维化的机制。

