柴胡-黄芩药对的不同分离部位对H2O2刺激肝星状细胞增殖的影响
王华林 程丽飞 卢伟龙


【摘要】目的:研究柴胡-黄芩药对的不同分离部位对过氧化氢(H2O2)刺激的肝星状细胞增殖的影响,探讨柴胡-黄芩药对抗肝纤维化主要药效物质基础。方法:柴胡-黄芩水提液经D101型大孔吸附树脂吸附,依次用水、30%、60%和90%的乙醇梯度洗脱,分别得到水洗脱部位(A)、30%乙醇洗脱部位(B)、60%乙醇洗脱部位(C)及90%乙醇洗脱部位(D)。体外培养肝星状细胞,采用不同浓度的H2O2刺激肝星状细胞增殖,筛选最佳造模浓度,然后用柴胡-黄芩药对水提液及A、B、C、D的高、中、低剂量组进行干预24h。采用MTT法测定各组肝星状细胞的抑制情况;应用ELISA法检测细胞上清液中透明质酸酶(hy-aluronidase,HA)、层黏连蛋白(laminin,LN)、Ⅲ型前胶原(procollagenⅢ,PCⅢ)、Ⅳ型胶原(collagentypeⅣ,Ⅳ-C)的浓度。结果:结果显示,5μmol/L的H2O2能显著刺激肝星状细胞增殖,柴胡-黄芩药对及其各分离部位对H2O2刺激的肝星状细胞增殖均具有一定的抑制作用,而且能够将低HA、LN、PCⅢ、Ⅳ-C的细胞释放水平,具有剂量相关性,其中B、C高剂量组对其抑制作用最为明显,有统计学意义(P<0.01)。结论:柴胡-黄芩药对及其30%、60%乙醇洗脱部位对H2O2刺激的肝星状细胞增殖均具有一定的抑制作用,30%、60%乙醇洗脱部位可能是柴胡-黄芩药对抗肝纤维化主要有效部位。
【关键词】柴胡-黄芩药对;肝星状细胞;不同分离部位;H2O2;肝纤维化
【中图分类号】R285.5【文献标志码】A【文章编号】1007-8517(2019)8-0024-05
Abstract:ObjectiveTostudytheeffectofdifferentfractionsofBupleurium-Scutellariaontheproliferationofhepaticstellatecellsstimulatedbyhydrogenperoxide(H2O2).InordertoseekforthebasisofthemainpharmacodynamicsubstancesofBupleurium-Scutellariainanti-hepaticfibrosis.MethodsBupleurium-ScutellariawaterextractionliquidwasadsorbedbyD101macroporousresin,afterbeingelutedbywater,30%,60%and90%ethanol,respectivelygetwater-elutedfraction(A),30%ethanol-elutedfraction(B),60%ethanol-elutedfraction(C)and90%ethanol-elutedfraction(D).TheHSCofratwasculturedinvitro,withdifferentconcentrationsofH2O2tostimulatetheproliferationofhepaticstellatecell,screeningtheoptimumconcentration,usingthehigh,mediumandlowdosegroupofBupleuri-ScutellariaewaterextractionliquidandA,B,C,Dtointervenefor24h.TomeasuretheinhibitionofhepaticstellatecellsbyMTTassay.TheHA,LN,PCⅢ,Ⅳ-CconcentrationinthecellsupernatantwasdetectedbyELISA.ResultsTheexperimentalresultsshowthatthetendencytowards5μmol/LH2O2couldsignificantlystimulatetheproliferationofhepaticstellatecell,Bupleurium-ScutellariaanditsdifferentfractionshavecertaininhibitiontotheproliferationofhepaticstellatecellbyH2O2stimulated,anditcanreducethereleaselevelofHA,LN,PCⅢ,Ⅳ-Cincell.Therewasacertaindosecorrelation.amongthem,BandChighdosegroupoftheinhibitoryeffectismostobvious,Therewereacertainstatisticallysignificant(P<0.01).ConclusionBupleuri-Scutellariaeandits30%,60%ethanol-elutedfractionshavecertaininhibitoryeffectontheproliferationofhepaticstellatecellsstimulatedbyH2O2.30%ethanol-elutedfractionand60%ethanol-elutedfractionmaybethemaineffectivepartforBupleuri-Scutellariaeinanti-hepaticfibrosis.
Keywords:Bupleurium-Scutellaria;HSC;DifferentFractions;H2O2;HepaticFibrosis
肝纖维化是指肝脏内弥漫性细胞外基质(特别是胶原物质)的过度沉积[1],是各种病因引起的肝脏损伤后的一种损伤修复反应,其中肝星状细胞(Hepaticstellatecell,HSC)的活化是关键,因为肝脏受损后HSC活化是细胞外基质的主要来源。氧化应激是造成HSC活化增殖的重要因素,研究表明氧化应激相关分子过氧化氢(H2O2)能够刺激HSC活化增殖,改变细胞外基质的沉降[2-3]。
随着肝组织的持续损伤,增生的纤维组织逐步取代正常的肝组织,最终发展成为肝硬化,其在全球呈现出高发病率以及高死亡率[4]。肝纤维化是各种慢性肝病发展成为肝硬化的一个中间环节。肝纤维化属于可逆性病变[5],若在临床早期采取抗肝纤维化治疗,将对慢性肝病的治疗以及阻止肝硬化的发生会产生非常积极的作用。目前,在抗肝纤维化方面中医药表现出独特的疗效,而且多是采用舒肝理气、活血类中药,其对于多种慢性肝病的治疗具有积极意义[6]。课题组前期研究表明,柴胡-黄芩配伍水煎液对大鼠肝纤维化模型具有良好的保护作用[7],但对于柴胡-黄芩药对抗肝纤维化的药效物质基础尚未见报道,故本实验在建立体外H2O2刺激HSC活化增殖的基础上,观察柴胡-黄芩药对不同分离部位的抗肝纤维化作用,以期寻找柴胡-黄芩药对抗肝纤维化主要药效物质基础,为进一步研究抗肝纤维化药物开发奠定基础。
1材料与方法
1.1试药中药材柴胡和黄芩均购自陕西中医药大学校医院中药房,经陕西中医药大学生药教研室教师鉴定为正品,符合2015版《中华人民共和国药典》规定标准。
1.2细胞大鼠肝星状细胞株HSC-T6,购自灏洋生物公司。
1.3试剂与材料胎牛血清(批号:FB-10,美国KIRGEN公司);DMEM-H(美国Hyclone公司);胰蛋白酶(批号:1939066)、青链霉素双抗(批号:1924794)美国Gibco公司;透明质酸酶试剂盒(hy-aluronidase,HA,批号:201805)、层黏连蛋白试剂盒(laminin,LN,批号:201805)、Ⅲ型前胶原试剂盒(procollagenⅢ,PCⅢ,批号:201805)、Ⅳ型胶原试剂盒(collagentypeⅣ,Ⅳ-C,批号:201805)购自上海优选生物科技有限公司;MTT(3-(4,5-二甲基-2-噻唑)-2,5-四氮唑溴盐)(批号:EZ2811B347,美国Sigma公司);乙醇为分析纯(天津市天力化学试剂有限公司);D101大孔吸附树脂(天津市海光化工有限公司);30%H2O2(天津北联精细化学品开发有限公司)。
1.4仪器CO2培养箱(新加坡ESCO);倒置显微镜(奥特BDS200);酶标仪(美国BioTekELx808);离心机(湘仪L530);双人型超净工作台(新加坡ESCO);旋转蒸发器RE-52A(上海亚荣生化仪器厂)。
1.5方法
1.5.1柴胡-黄芩水提液的制备参照文献及课题组前期实验结果[8],柴胡饮片50g、黄芩饮片25g,共75g,加入8倍量水浸泡30min,煎煮,并保持沸腾30min;过滤,再加入8倍量水煎煮30min。过滤,合并两次滤液混匀浓缩至150mL,即得浓度为0.5g/mL的柴胡-黄芩水提液。将得到的柴胡-黄芩水提液平均分成两份,一份用于分离制备不同部位,一份进行干燥得干粉用于后续体外实验。
1.5.2柴胡-黄芩不同分离部位的制备参照文献方法制备柴胡-黄芩不同分离部位[9-11],将上述0.5g/mL的柴胡-黄芩水提液上D101大孔吸附树脂柱,径高比为1∶10以上,依次用水和30%,60%,90%乙醇梯度洗脱,收集洗脱液,得到水和30%,60%,90%乙醇洗脱4个不同极性部位,即水洗脱部位(A)、30%乙醇洗脱部位(B)、60%乙醇洗脱部位(C)、90%乙醇洗脱部位(D),分别干燥得干燥粉末。
1.5.3大鼠HSC的培养将大鼠肝星状细胞株(HSC-T6)于DMEM高糖培养基(含10%的胎牛血清、100kU/L青霉素、100mg/L链霉素),37℃、5%CO2饱和湿度培养箱中培养并传代。取对数生长的HSC,以5×104(个)/mL浓度接种到96孔培养板中过夜。
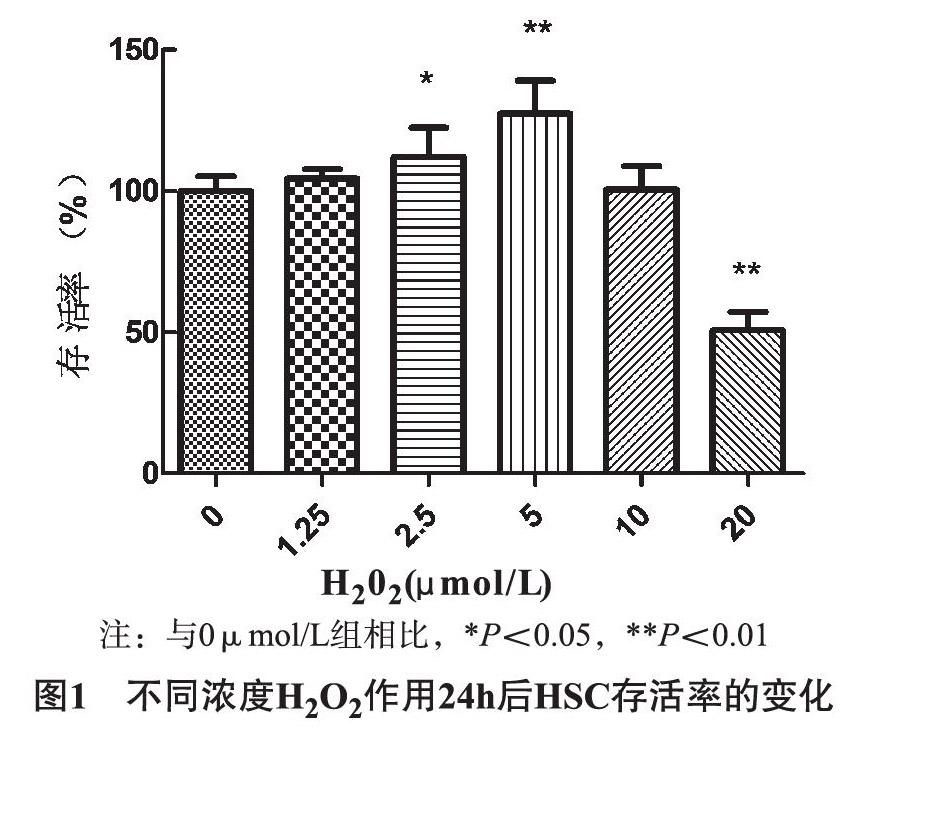
1.5.4H2O2刺激HSC增殖模型的建立参照文献方法建立H2O2刺激的HSC增殖模型[2-3]。将30%H2O2用无血清培养基进行稀释,分别配制成为终浓度为0、1.25、2.5、5、10、20μmol/L的H2O2溶液。加入到细胞贴壁后的96孔板中,每个浓度分别设6个复孔。培养24h后,每孔加入5mg/mL的MTT溶液20μL,置培养箱继续培养4h后,吸净孔内培养基,每孔加入150μLDMSO,震荡10min,酶标仪单波长检测OD值。按下列公式计算细胞存活率。
细胞存活率%=(试验组OD值/对照组OD值)×100%。
1.5.5药物处理实验分组如下:对照组(无药物处理),H2O2模型组(5μmol/LH2O2作用24h),给药组(5μmol/LH2O2作用24h后,再用柴胡-黄芩及A、B、C、D高中低剂量作用24h)。
1.5.6柴胡-黄芩及其不同分离部位对H2O2刺激的HSC增殖的影响各组培养24h后,加入5mg/mLMTT20μL,37℃孵育4h,吸弃孔内培养液,每孔加入DMSO150μL,低速震荡10min,以充分溶解被还原的MTT结晶,酶标仪单波长检测OD值。
1.5.7柴胡-黃芩及其不同分离部位对H2O2刺激的HSC分泌HA、LN、PCⅢ、Ⅳ-C的影响各组培养24h后,收集细胞上清液,参照试剂盒使用说明书,应用ELISA法检测HA、LN、PCⅢ、Ⅳ-C的含量。
1.6统计学处理用SPSS13.0计算机软件进行统计学分析,研究数据资料以(x±s)表示,组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05表示差异有统计学意义。
2结果
2.1H2O2刺激HSC增殖模型的建立在H2O2浓度0~5μmol/L范围内时,H2O2对HSC具有活化促增殖作用,且具有一定的剂量相关性;在H2O2浓度为5μmol/L时对HSC具有明显的活化促增殖作用(P<0.01);在H2O2浓度大于5μmol/L时,随着浓度的不断增大,H2O2对HSC的激活作用逐渐减弱,且在H2O2浓度为20μmol/L时HSC的存活率仅50%左右,H2O2对HSC表现为显著的抑制作用(P<0.01)。综上所述,本课题组选用5μmol/LH2O2作用24h作为HSC的增殖模型。如图1所示。
2.2柴胡-黄芩及其不同分离部位对H2O2刺激的HSC增殖的影响与对照组比较,H2O2干预后,能够显著促进HSC的增殖(P<0.01);与H2O2组相比,柴胡-黄芩组(高、中剂量组)、A组(高剂量组)、B组(高、中剂量组)、C组(高、中剂量组)及D组(高剂量组)对H2O2诱导的HSC增殖均具有一定的抑制作用,其中柴胡-黄芩高剂量组及B组高剂量组、C组高剂量组对H2O2诱导的HSC增殖具有尤其明显的抑制作用(P<0.01)。见表1。
2.3柴胡-黄芩及其不同分离部位对H2O2刺激的HSC分泌HA、LN、PCⅢ、Ⅳ-C的影响与对照组比较,H2O2作用于HSC后,HSC分泌的HA、LN、PCⅢ、Ⅳ-C含量明显升高;与H2O2组比较,柴胡-黄芩组及A组、B组、C组、D组可以明显降低H2O2诱导的HSC细胞分泌的HA、LN、PCⅢ、Ⅳ-C的含量,其中柴胡-黄芩组高剂量组、A组高剂量组及B组高剂量组对其作用最为明显(P<0.01)。见表2。
3讨论
HSC的激活过程是肝脏胶原产生和肝纤维化形成的重要环节。在一系列刺激因素的作用下,HSC被活化转变为肌成纤维细胞,细胞大量增殖,合成细胞外基质,在肝脏内大量沉积,造成肝纤维化。氧化应激在HSC的活化和细胞外基质生成中具有重要作用,H2O2是氧化应激的相关分子,多项研究发现H2O2能够刺激HSC活化和细胞外基质的生成[2-3]。
肝纤维化是慢性肝病发展成肝硬化的必经阶段。现研究认为肝纤维化是一个动态过程,属于可逆性病变[5],而肝硬化则是一种不可逆性病变。因此,抗肝纤维化则成为治疗慢性肝病以及预防肝硬化的重要目标。源自汉代张仲景的小柴胡汤是临床治疗肝病的常用方剂,具有确切的抗肝纤维化疗效[12-14],柴胡-黄芩是小柴胡汤的核心药对。本课题组前期以小柴胡汤中的核心药对柴胡-黄芩的抗肝纤维化作用为切入点,研究发现其水提液具有确切抗肝纤维化作用[7]。为了进一步探究柴胡-黄芩药对抗肝纤维化的药效物质基础,筛选出其发挥抗肝纤维化作用的有效部位,故本实验在建立体外H2O2刺激HSC活化增殖的基础上,观察柴胡-黄芩药对不同分离部位的抗肝纤维化作用。
实验结果显示,与对照组相比,HSC经H2O2刺激后,大量增殖,其细胞培养液中HA、LN、PCⅢ、Ⅳ-C的含量显著增加。由此可见,H2O2对于HSC具有一定的激活促增殖作用,使肝纤维化相关因子HA、LN、PCⅢ、Ⅳ-C分泌显著增加,显现出肝纤维化倾向。给予柴胡-黄芩药对及其不同分离部位的高、中、低剂量干预后,各给药组中的HSC的增殖均受到抑制,HA、LN、PCⅢ、Ⅳ-C含量也有所降低,其中柴胡-黄芩及B、C高剂量组中的HSC受到的抑制作用最为明显,具有一定的剂量相关性,差异有统计学意义(P<0.01)。
综上所述,柴胡-黄芩药对及其B、C部位对H2O2刺激的肝星状细胞增殖具有一定的抑制作用,B、C可能是柴胡-黄芩抗肝纤维化的主要有效部位。据文献报道柴胡中主要含多糖、皂苷、挥发油、黄酮、甾醇类等成分[15],黄芩中主要含黄酮、萜类、苷类、挥发油等成分[16]。根据各成分的性质推测B、C中可能含有的成分为皂苷、黄酮苷类等成分,但其具体成分有待进一步研究。单味中药本身所含成分复杂多样,药对及复方甚之,且中医复方讲求整体性以及多种成分之间的相互关系,两味中药共同煎煮会出现怎样的成分变化,以及不同分离部位进行重新配伍组合以后会出现怎样的现象,有待进一步的研究,以期为抗肝纤维化中药研发提供实验依据。
参考文献
[1]FriedmanSL.Mechanismsofhepaticfibrogenesis[J].Gastroenterology,2008,134(6):1655.
[2]张峰,张自力,张雪娇,等.天然生物碱川芎嗪通过阻断PDGF-β受体介导的ERK和/或p38信号通路抑制高糖高胰岛素和过氧化氢诱导的肝星状细胞的活化[J].中华中医药杂志,2013,28(5):1174-1182.
[3]付金柏,霍冬梅,郑仕中.川芎嗪抑制H2O2诱导肝星状细胞活化的研究[J].南京中医药大学学报,2014,30(11):542-545.
[4]GülsümzlemElpek.Cellularandmolecularmechanismsinthepathogenesisofliverfibrosis:Anupdate[J].WorldJGastroenterol,2014,20(23):7260-7276.
[5]陳芳艳,贺福初,姜颖.肝纤维化发生发展及逆转过程中肝巨噬细胞亚群分类[J].中国化学与分子生物学报,2012,28(10):879-887.
[6]程明亮,周明玉.中医药防治肝纤维化[J].中华中医药杂志,2011,26(12):2761-2765.
[7]王斌,李敏,侯建平.基于TLR4-NFκB信号通路的柴胡-黄芩药对抗肝纤维研究[J].中药药理与临床,2015,31(3):103-106.
[8]李敏,韩燕,王华林,等.基于TLR4-NF-κB的柴胡黄芩水煎液抑制CCl4诱导大鼠肝星状细胞激活作用机制研究[J].中国药理学通报,2017,33(5):729-732.
[9]杨江萍,高增平,谢鸣.柴芩水提液退热有效部位的研究[J].中药实验方剂学杂志,2012,18(14):132-134.
[10]李容,蒋玉婷,罗莉娅,等.大孔吸附树脂纯化黄芩4种黄酮类成分的工艺研究[J].中药与临床,2012,6(2):47-50.
[11]迟雪洁,任海勇,黄伟,等.大孔吸附树脂分离纯化柴胡总皂苷工艺研究[J].中国药物警戒,2012,9(10):595-598.
[12]江山,李芳.小柴胡汤对肝纤维化大鼠的抗肝纤维化作用[J].中药药理与临床,2013,29(1):17-19.
[13]陈丹丹,龚作炯.小柴胡汤治疗慢性乙型肝炎肝纤维化的临床研究[J].现代中西医结合杂志,2011,20(31):3928-3930.
[14]李晋,徐尚福,罗果,等.ERK2和PI-3K在小柴胡汤抗大鼠肝纤维化中的表达[J].中成药,2014,36(11):2238-2242.
[15]陈亚双,孙世伟.柴胡的化学成分及药理作用研究进展[J].黑龙江医药,2014,27(3):630-633.
[16]郑勇凤,王佳婧,傅超美,等.黄芩的化学成分与药理作用研究进展[J].中成药,2016,38(1):141-147.
(收稿日期:2019-02-02编辑:程鹏飞)

