铁氰化镍/普鲁士蓝复合膜传感器的制备及性能研究
宋诗稳, 刘冉彤, 莫 驰, 王 溦, 吴孟玉
(延安大学 石油工程与环境工程学院, 陕西 延安 716000)
0 引言
自Neff和Itaya研究了普鲁士蓝(Prussian Blue,PB)的电化学性质,并报道了PB对H2O2的电催化作用以来,PB及其类似物在电分析、生物传感器、离子交换与电子转移等方面的应用引起了人们的广泛关注[1,2],特别是对过渡金属铁氰化物的电化学和电催化性质进行了研究.
制备金属铁氰化物(MHCF)修饰电极通常使用的方法有机械固载法、将电子递质导入聚合物等体系中或封装在溶胶凝胶中以及共沉积法[3-5].利用电化学方法从同时含有目标金属离子和铁氰化钾混合溶液中电沉积MHCF薄膜因其步骤简单应用较广.李春香等[6]在氧化石墨烯(GO)表面吸附Ni2+,再利用循环伏安法将GO-Ni2+修饰电极上的Ni2+转化为铁氰化镍,此修饰电极不仅稳定性显著增加且对NO2-有明显的催化作用.赵鸿彩等[7]利用高分子支撑法制备出石墨烯平面电极,通过循环伏安法获得铁氰化钴修饰石墨烯电极,此电极对过氧化氢具有良好的传感作用.
限制电化学沉积法的主要问题是双组份法中金属离子的浓度过高会导致成核速率过快,而形成松散、疏松的薄膜,从而影响修饰电极的电催化活性与稳定性.混合金属铁氰化物为提高PB及其类似物膜的稳定性及电催化活性提出了新的解决方法.Kumar等[8]将新制备的NiHCF膜修饰电极在含ZnCl2的酸性溶液中循环扫描数圈,使Zn2+通过共沉淀掺杂于NiHCF的晶格中形成更稳定的Zn-NiHCF膜,可显著提高修饰电极的稳定性及电催化活性.
基于此,本文以EDTA为络合剂降低金属离子有效浓度并避免胶体形成,在线电沉积Nano-NiHCF/PB复合膜,研究了该复合膜修饰电极的电化学性质及其对H2O2的电催化活性,为其在生物电化学传感器领域的应用提供了可能性.
1 实验部分
1.1 主要试剂
甲基三甲氧基硅烷(MTMOS,杭州硅宝化工);FeCl3·6H2O、Ni(NO3)2·6H2O、铁氰化钾、H2O2,均为分析纯;水为二次蒸馏水.
1.2 实验仪器
CHI660D型电化学工作站,上海辰华;TM3000型扫描电子显微镜,日本日立;pHS-3C型精密酸度计,上海雷磁.采用三电极系统电化学池,以修饰电极为工作电极,铂丝电极为辅助电级,饱和甘汞电极为参比电极.
1.3 实验方法
裸CCE电极的制作方法参考Tsionsky等[9]工作.
电沉积液的制备:在pH=1.0条件下将EDTA与Fe3+按摩尔比1∶1混合,在中性条件下将EDTA与Ni2+按摩尔比1∶1混合,加入K3Fe(CN)6与KCl.电解液组成为:1.0 mmol/L Ni(NO3)2+1.0 mmol/L FeCl3+2.0 mmol/L EDTA+2.0 mmol/L K3Fe(CN)6+0.10 mol/L KCl (pH=2.00).将处理好的CCE置于上述电沉积液中,控制电位范围为-0.2~1.0 V,以50 mV/s的扫描速率连续扫描一定的圈数,记为Nano-NiHCF/PB/CCE.同时制备相同条件下不含EDTA的NiHCF/CCE与PB/CCE.
2 结果与讨论
2.1 电化学沉积Nano-NiHCF/PB
前期研究表明MHCF在CCE表面沉积速率优于GCE,CPE以及AuE电极[10],可能源于sol-gel过程中形成的三维网状微孔为MHCF提供了成核点位.另一方面,包埋于sol-gel网格中的石墨颗粒增加了CCE表面粗糙度与电极有效面积,也为提高沉积速度提供了可能.本法选择CCE为基础电极.双组份法中金属离子浓度过高会导致成核速率太快而生成不致密且易团聚的MHCF,影响电极的电催化活性与稳定性,因此本法向沉积液中加入EDTA以控制铁氰化物的成核速率.
图1为电沉积Nano-NiHCF/PB的循环伏安图.在第一圈扫描过程中(图1(b)),循环伏安图上出现了一个还原峰和三个氧化峰.其中0.20 V处的氧化峰为PB的氧化峰;位于0.48 V与0.53 V处的氧化还原峰是Fe(CN)64-/Fe(CN)63-的氧化还原峰;位于0.78 V处的氧化峰不同于PB高电位处的氧化峰,可能是铁、镍共沉积铁氰化物的氧化峰.扫描第二圈时在相同电位处出现三对氧化还原峰证实铁和镍共沉积铁氰化物的存在.
由图1(a)可知,随着电位扫描的进行,循环伏安图上0.20 V与0.78 V处的氧化还原峰电流均不断增加,说明在电位循环过程中铁、镍共沉积铁氰化物沉积于电极表面.

(a)沉积图
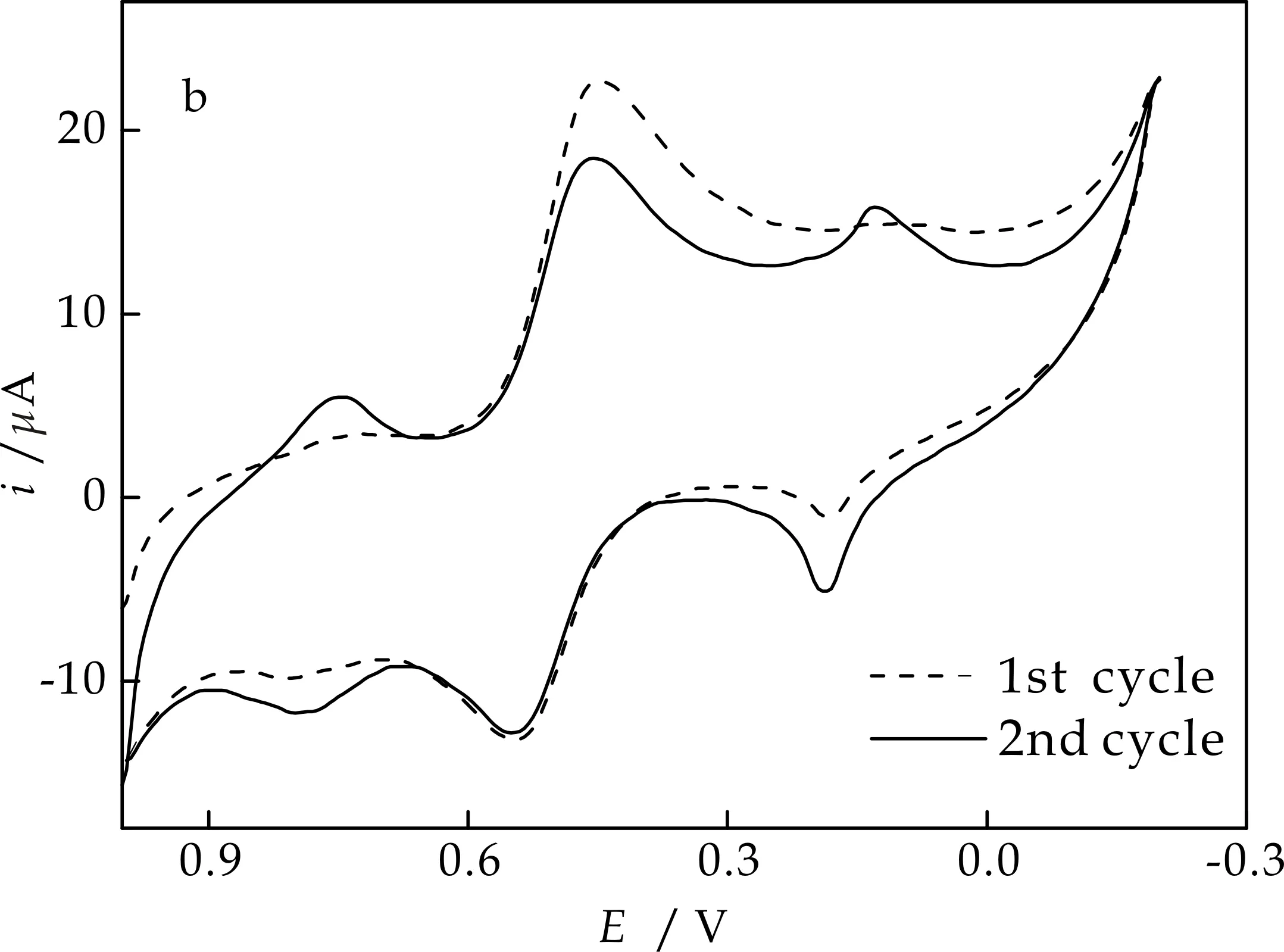
(b)沉积图的第一圈与第二圈图1 电化学沉积Nano-NiHCF/PB的循环伏安图
图2为PB、NiHCF以及本实验制得的Nano-NiHCF/PB修饰电极在0.10 mol/L KCl中以20 mV/s的扫速记录的循环伏安图.由图2可见,Nano-NiHCF/PB循环伏安图上的两对氧化还原峰与单独的PB、NiHCF明显不同,说明在本实验条件下PB立方晶体中高自旋位置的FeШ被Ni2+占据,生成了铁、镍共沉积的多核MHCF,面心立方晶格结点上交替出现的NiП和FeП间以C≡N基桥联形成三维网状聚合结构,电沉积液中阳离子K+填充于晶胞间隙,使NiHCF的电子结构由FeШ(低自旋)-CN-NiП(高自旋)转变为FeП(高自旋)-CN-CoШ(低自旋)[11].
根据晶体生长理论,减慢溶液中金属离子的成核速率有利于形成形貌规则的晶体.无EDTA存在时,较快的成核速率导致胶体溶液的形成使电极表面MHCF的沉积速率反而较慢[12,13].反之,虽然EDTA的存在减慢了成核速率,但其避免了胶体溶液的形成反而加快了电极表面MHCF的沉积速率[10],因此相同沉积条件下得到的Nano- NiHCF/PB的峰电流明显高于PB、NiHCF.从图3可以看出, NiHCF/PB纳米粒子均匀分布于电极表面,形成致密的复合膜,部分区域因分子间静电作用形成分子团聚造成分散不匀.
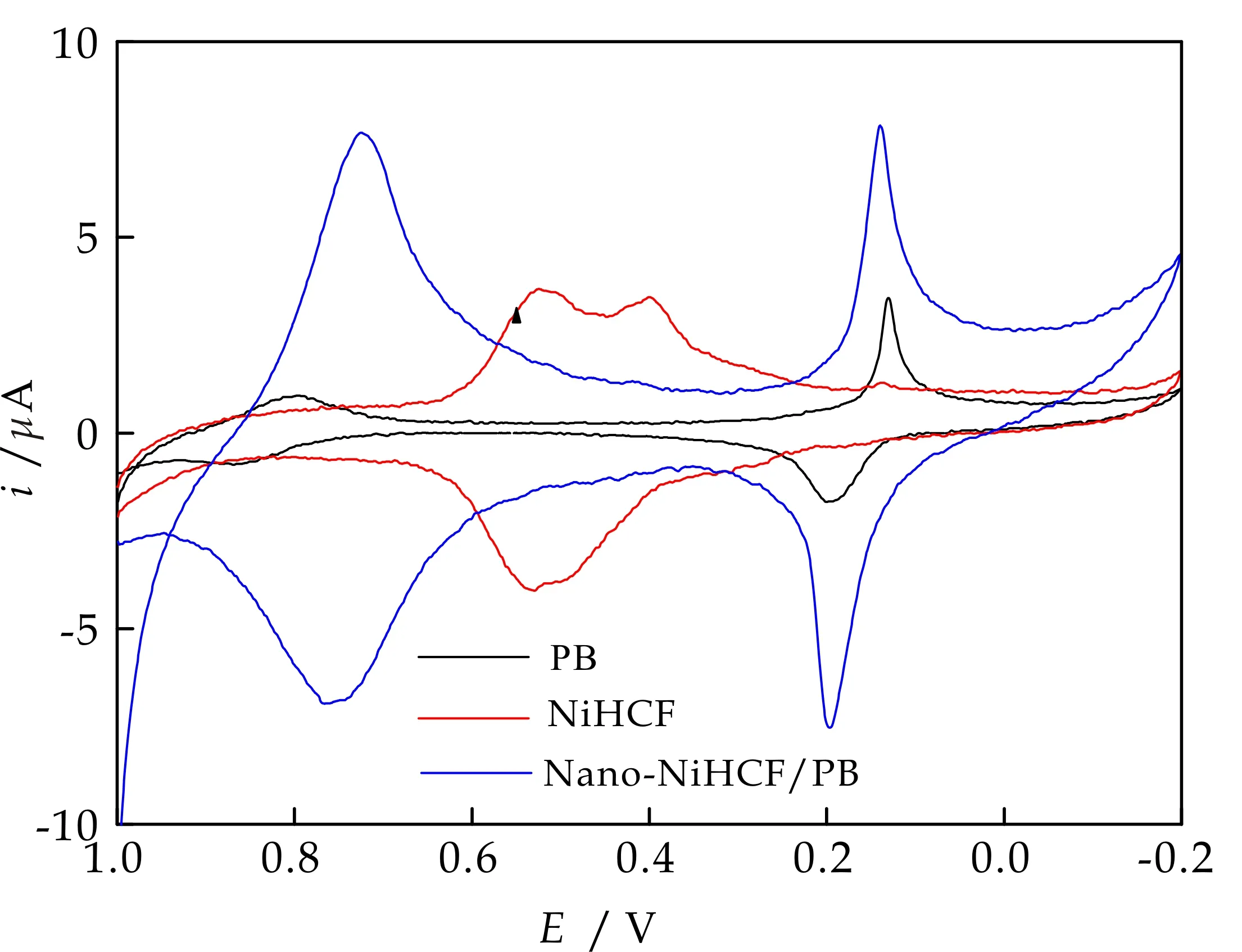
图2 修饰电极的循环伏安图

图3 Nano-NiHCF/PB电极的扫描电镜图
2.2 Nano-NiHCF/PB制备条件的优化
通过比较电极表面Nano-NiHCF/PB表观浓度优化了制备复合膜的实验条件.包括溶液酸度、铁氰化钾浓度、EDTA浓度和电位扫描范围等.电量值通过0.10 mol/L KCl中记录的循环伏安图 0.15 V处还原峰下覆盖的面积进行积分求得,并扣除空白实验背景干扰.电沉积实验均在选定条件下沉积20圈.在优化的沉积条件下,所得电极在KCl中表现出最好的电化学响应(图4(d)).
MHCF沉积速度主要取决于其成核速度,EDTA浓度过低则成核速率过快而生成疏松的MHCF(0.0或1.0×10-3mol/L).EDTA浓度过高会减慢电沉积速率,使MHCF生成量降低(3.0×10-3mol/L),EDTA浓度为2.0×10-3mol/L时表观浓度获最大值.
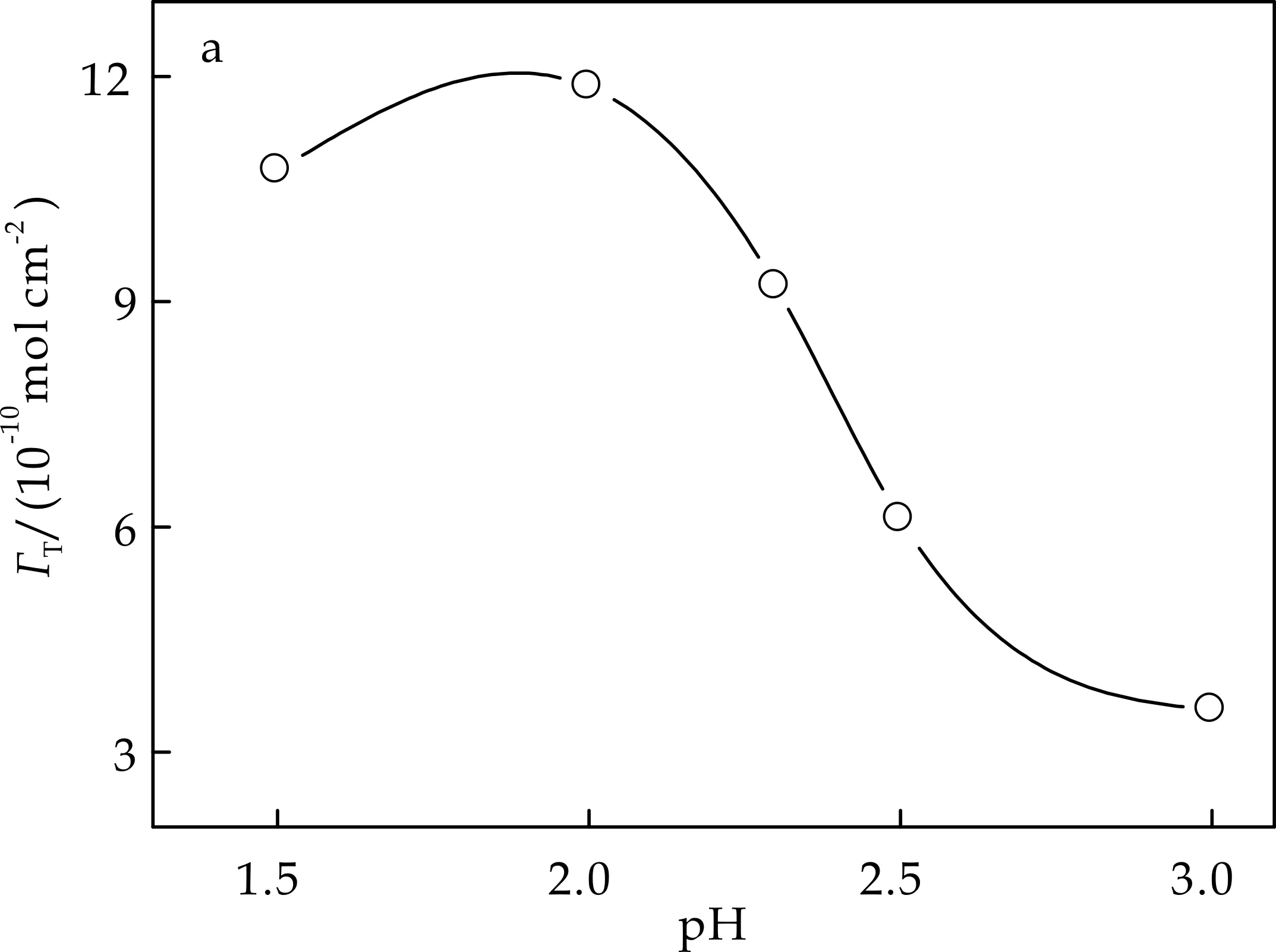
(a)pH值对复合膜表观浓度的影响
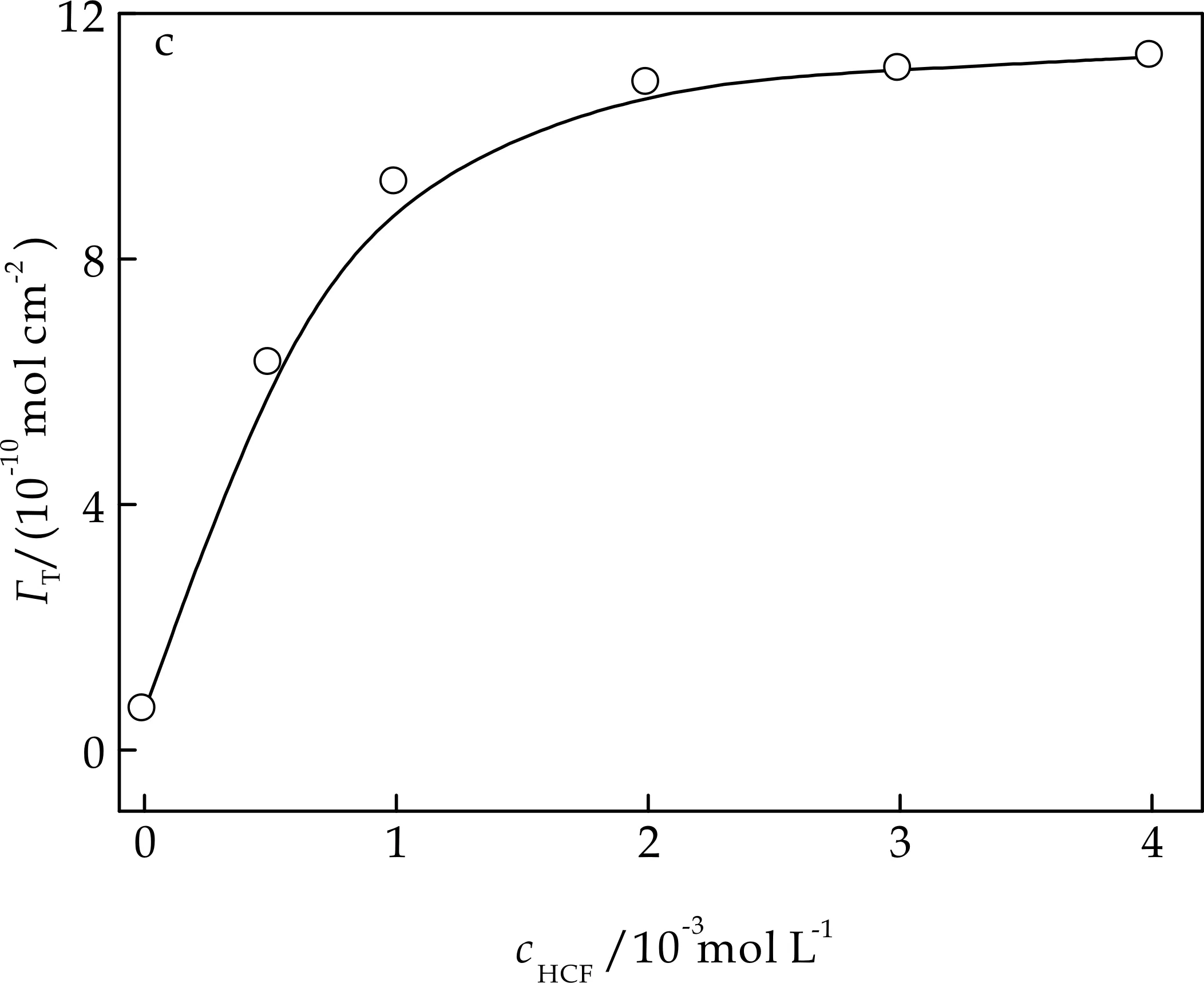
(c)铁氰化钾浓度对复合膜表观浓度的影响

(d) 电解质阳离子对电极电化学行为的影响图4 实验条件优化
2.3 Nano-NiHCF/PB/CCE的电化学行为
图5为以5 mV/s的扫速记录的循环伏安图.其中低电位(P1、P2)与高电位(P3、P4)处式量电位为0.15 V与0.74 V,阴、阳极峰电位分离为38.0 mV与26.0 mV,峰电流比值约为1,表明电极过程为可逆过程.
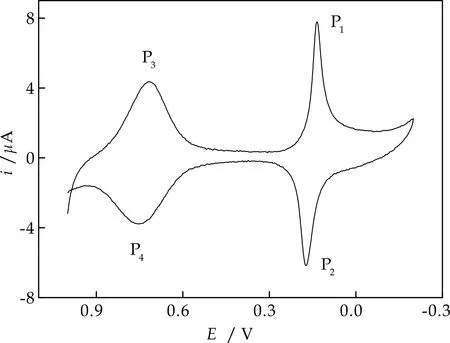
图5 Nano-NiHCF/PB修饰电极在0.10 mol/LKCl中的循环伏安图
图6(a)考察了扫描速率与峰电流的关系,图6(b)以高电位处氧化还原峰为例研究了电极的动力学过程,当v<100 mV/s时阴、阳极峰电位分离ΔEp<58 mV(图6(b)),峰电流与扫描速率成正比(图6(c)),表明此电极过程为一表面控制过程.当扫描速率较高时,峰电流与v1/2成正比(图6(d)),峰电位分离ΔEp>200 mV,表明此时电极过程由对离子扩散控制.根据Laviron[14]理论,电子传递速率常数和电子转移系数分别为0.48与1.31 s-1(v:450~800 mV/s).
由支持电解质阳离子对电极电化学行为的影响发现,在含有Li+、Na+、K+的溶液中,Nano-NiHCF/PB的式量电位按 K+>Na+>Li+的顺序朝正电位方向移动.在含K+溶液中峰电流最大,峰形对称,而在Li+和Na+溶液中,电化学响应不明显,氧化还原峰可逆性很差(图4(d)).说明Li+和Na+水合半径较大(2.37 Å与1.83 Å)不易浸入Nano- NiHCF/PB的离子通道.
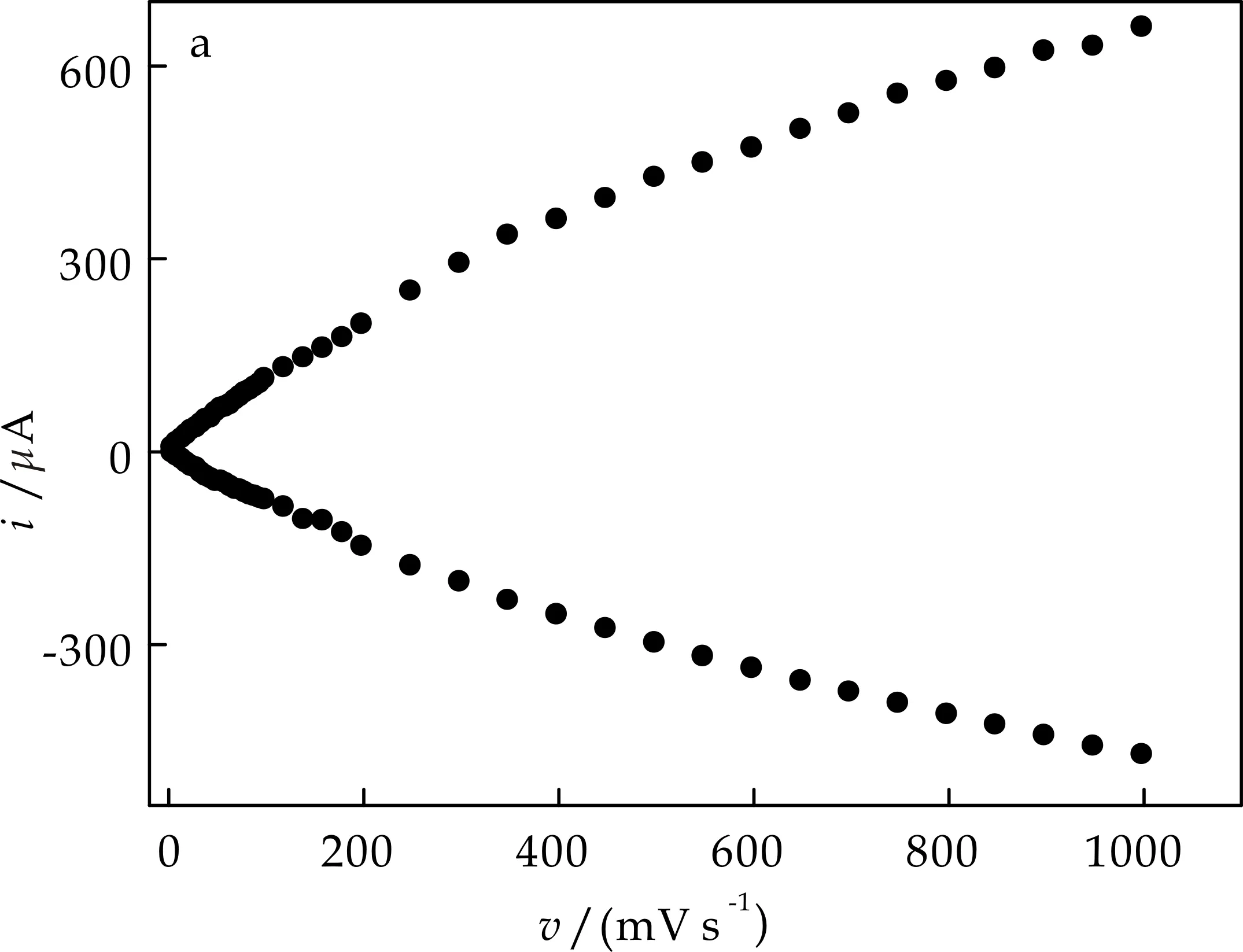
(a)扫描速率与峰电流的关系
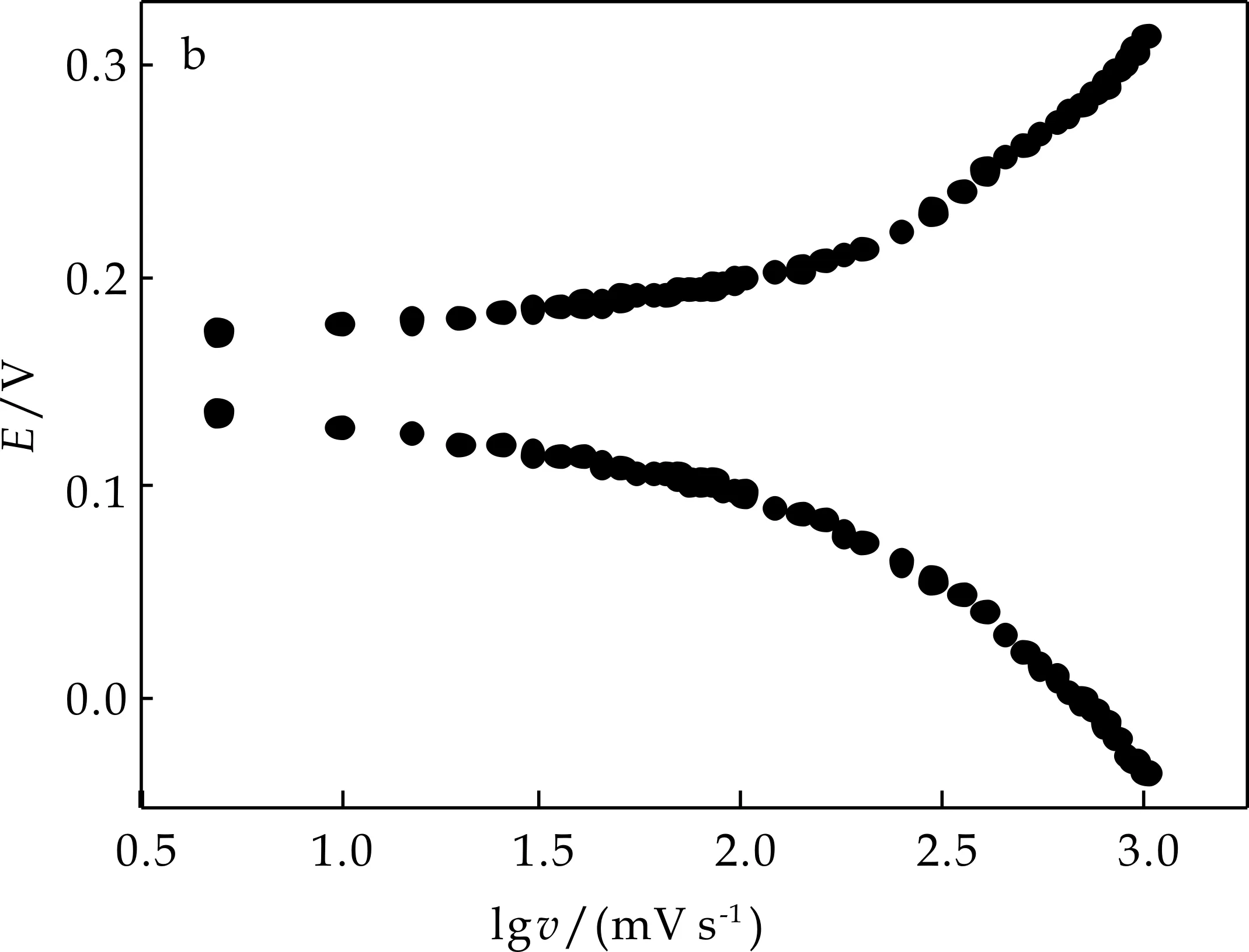
(b)扫描速率的对数与峰电位的关系

(c)扫描速率与峰电流的线性关系
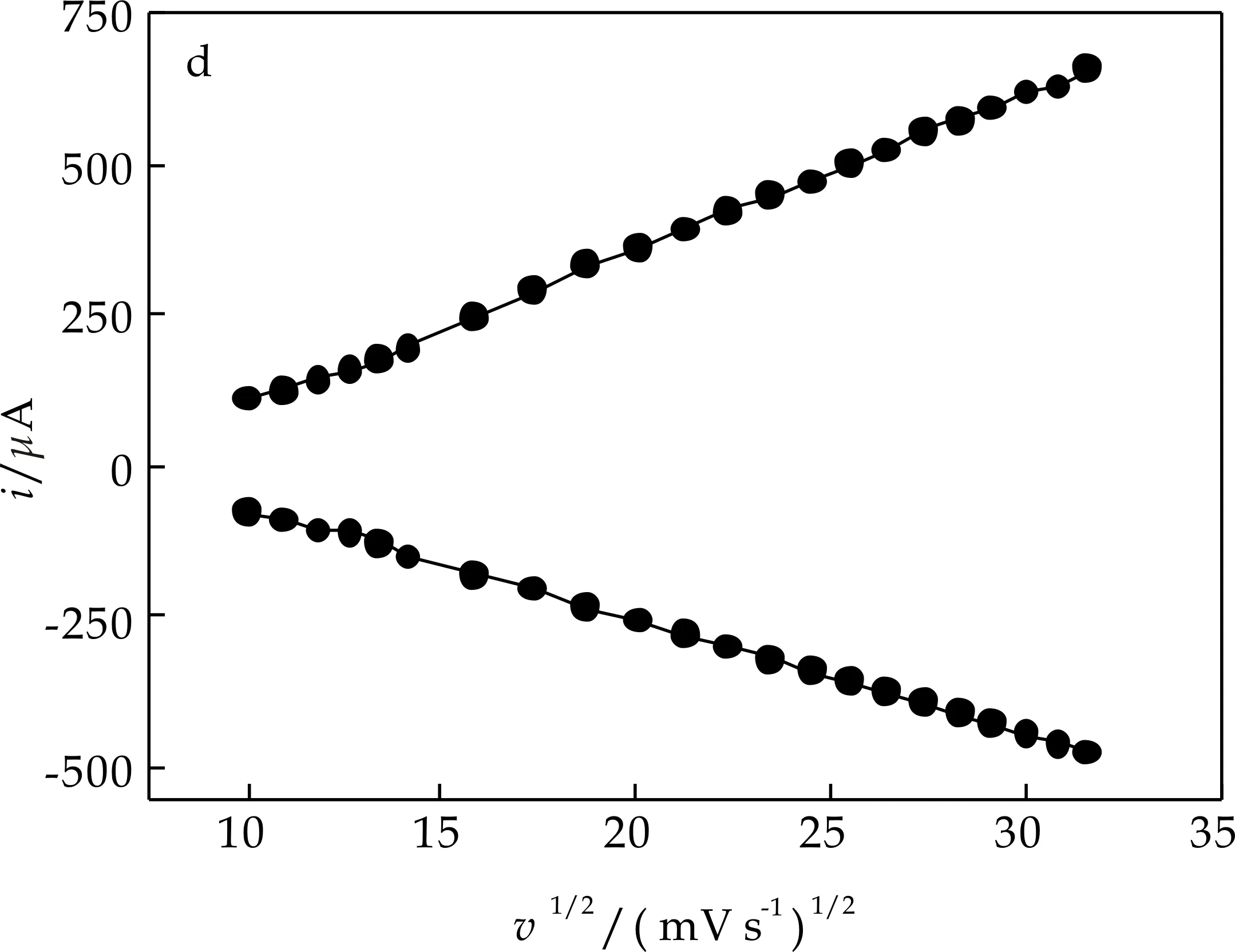
(d)扫描速率的1/2次方与峰电流的线性关系图6 扫描速率对峰电流和峰电位的影响
E0′与lgck线性斜率分别为48.7 mV与54.7 mV,该值接近一电子、一质子的理论斜率58.8 mV,说明Nano-NiHCF/PB的氧化还原过程中伴随着一个电子的传递和一个支持电解质阳离子的迁移,电极反应可表示为:
KNiП[FeШ(CN)6]+K++e-→K2NiП[FeШ(CN)6]
(1)
由计时安培实验求得扩散系数为2.45×10-5cm2/s(如图7所示),异相催化反应速率常数kcat为1.6×103L/mol/s(如图8所示).
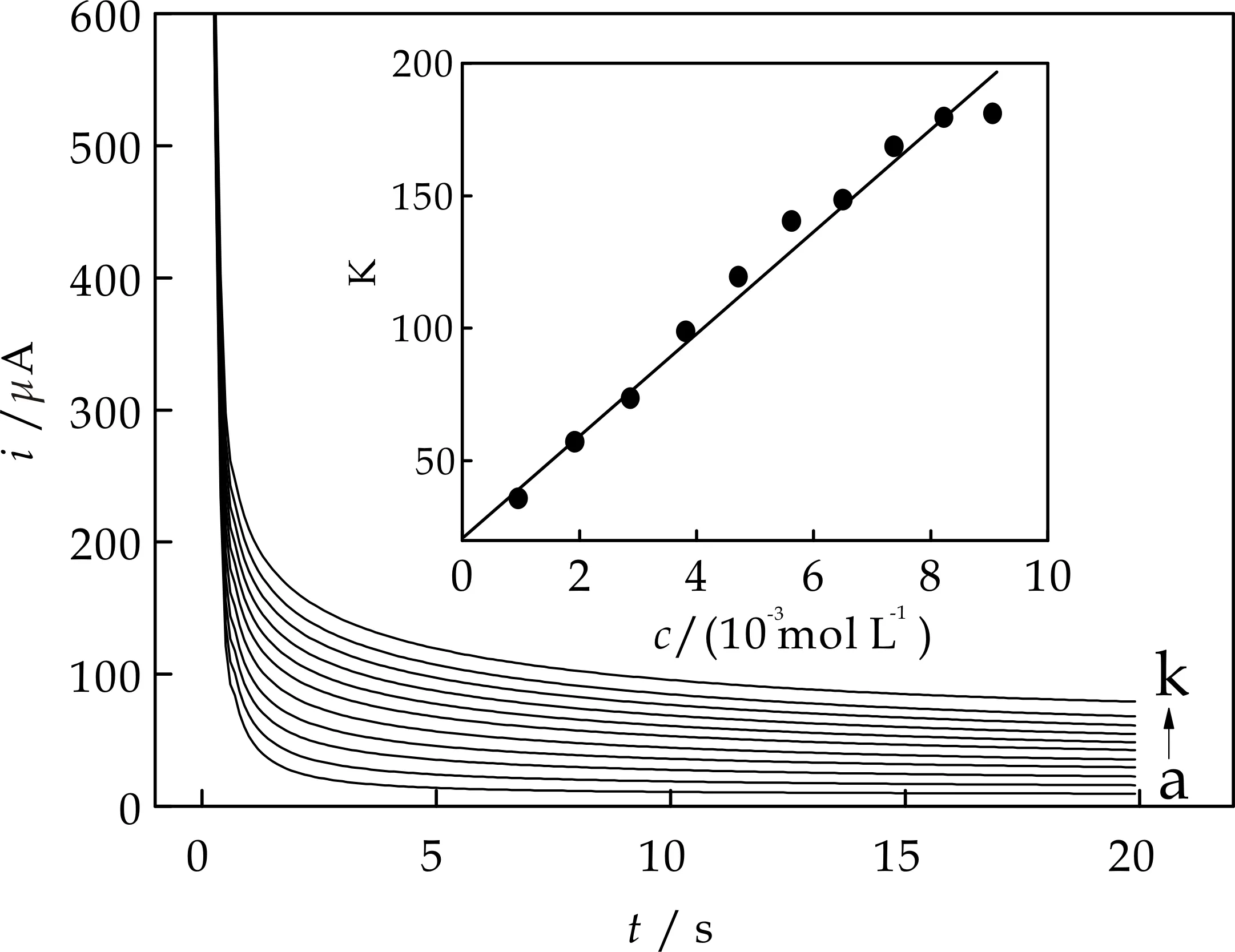
a~k:0.0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0×10-3 mol/L; E:-0.20~0.45 V图7 Nano-NiHCF/PB的计时安培曲线(插图为斜率与H2O2浓度的线性关系)

H2O2浓度:0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0×10-3 mol/L;E:-0.20~0.45 V图8 异相催化反应速率常数的测定(插图为斜率与H2O2浓度1/2次方的线性关系)
2.4 安培法检测H2O2
采用循环伏安法(如图9所示)和动力学计时安培法(如图10所示)研究了修饰电极定量测定H2O2的分析性能.图10为控制工作电位为-0.05 V,向不断搅拌的0.10 mol/L PBS中加入不同浓度H2O2的计时安培曲线.结果表明,H2O2还原峰电流与其浓度在7.9×10-6~ 2.3×10-2mol/L范围呈线性关系(r=0.998 7),灵敏度为77.5μA/mmol/L,检出限为2.6×10-6mol/L (S/N=3),响应时间小于5 s.将本法与文献结果[15-19]相比(如表1所示),Nano-NiHCF/PB/CCE线性范围较宽且检出限较低.

a~j:0.00,0.99,1.96,2.91,3.85,4.76,5.66,6.54,7.41,8.26×10-3 mol/L H2O2;v:20 mV/s图9 Nano-NiHCF/PB加入H2O2前后的循环伏安响应(插图为峰电流与H2O2浓度的线性关系)
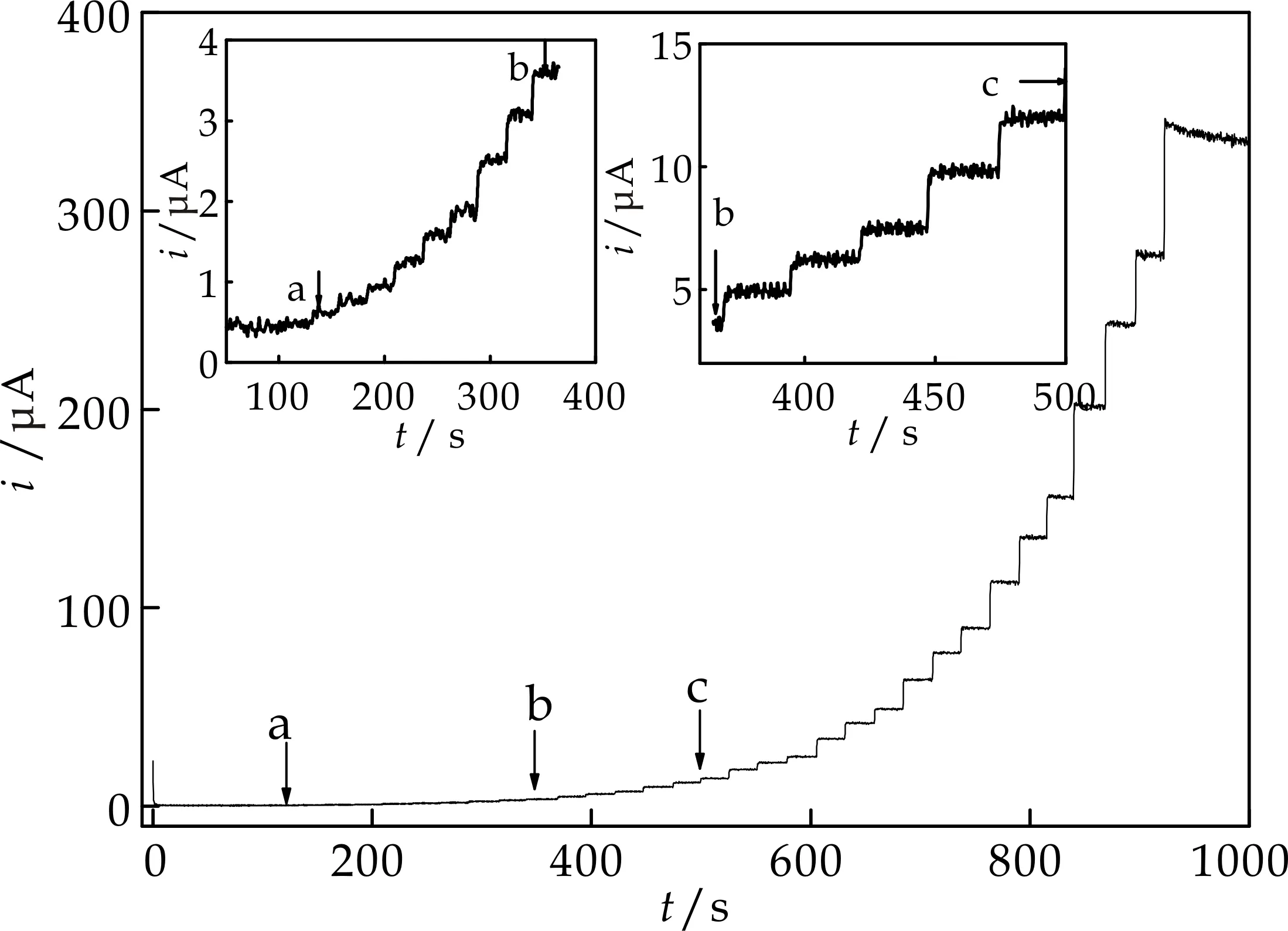
图10 Nano-NiHCF/PB的计时安培曲线(插图为70~370 s与370~500 s)

电极种类线性范围/(mol/L)检出限/(μmol/L)DPPA-rGO/AgNPs/GCE0.1×10-3~4.1×10-235DNA-Fe/CTS/GCE1.0×10-5~2.0×10-33.0PNIPAN/GNPs5.0×10-7~2.0×10-525AgNPs-CNF/GC2.0×10-5~1.4×10-22.2GE-poly-CoTAPc1.9×10-5~1.9×10-44.7Nano-NiHCF/PB7.9×10-6~2.3×10-22.6
2.5 样品分析
采用标准加入法对H2O2样品进行测定,结果如表2所示.本传感器对实际样品的相对标准偏差小于3%,回收率在97.4%~103.2%之间,说明此传感器可用于实际样品的测定.
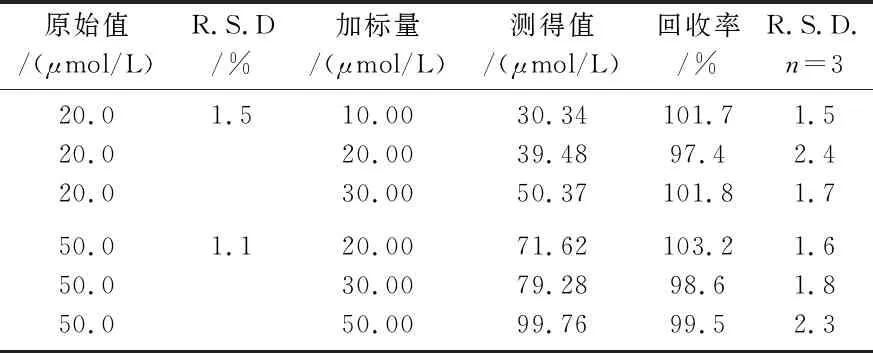
表2 H2O2消毒液中H2O2的分析结果
3 结论
在EDTA存在的条件下,采用电化学方法制备了均匀致密的Nano-NiHCF/PB复合膜,研究了该电极的电化学性质及电催化活性.实验表明,此传感器具有稳定性好、成本低且制备简单等优点,对H2O2表现出很好的电催化活性与测定稳定性,线性范围为7.9×10-6~2.3×10-2mol/L,灵敏度为77.5μA/mmol/L,检出限为2.6×10-6mol/L,响应时间小于5 s,可用于实际样品中H2O2的快速测定.

