钯催化烯基苯胺与重氮化合物的[3+2]环化反应
南 江, 张佳雯, 马养民
(1.陕西科技大学 化学与化工学院, 陕西 西安 710021; 2.陕西科技大学 陕西省轻化工助剂重点实验室, 陕西 西安 710021)
0 引言
2,3-二氢呋喃化合物是一类具有重要合成价值的环烯醇醚,该结构单元广泛存在于具有生物活性的天然产物和药物分子中[1-3],如图1所示.同时,二氢呋喃及其衍生物也是一类有机合成中的重要中间体,可通过环加成反应或环化反应构造更复杂的有机杂环化合物[4,5].
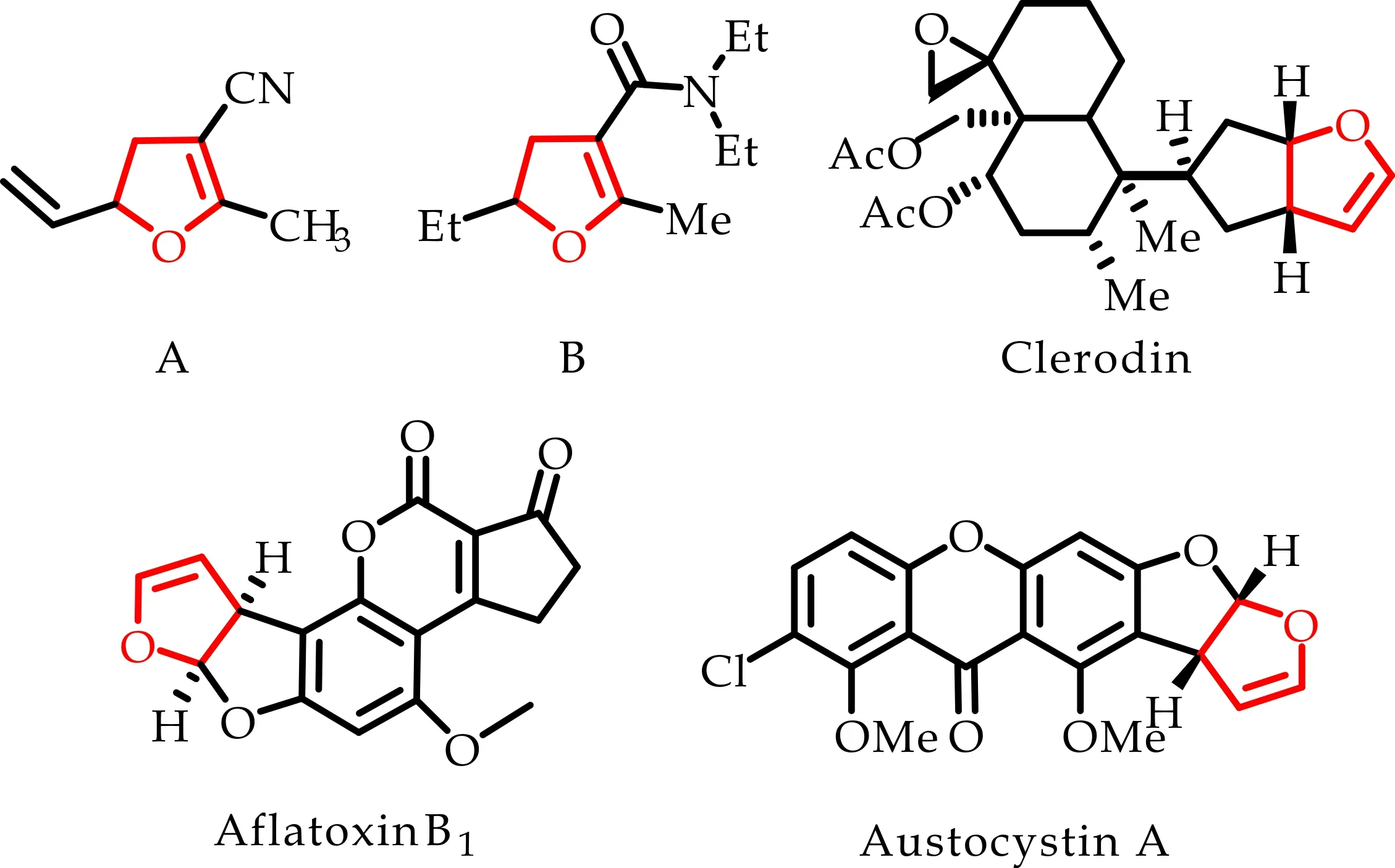
图1 含有二氢呋喃骨架的生物活性化合物
近年来,以二氢呋喃为骨架的杂环化合物的合成取得了一定的进展.Aleman J课题组开发了手性双功能酰胺类催化剂(10 mol%)催化溴代烯烃一锅法合成反式二氢呋喃衍生物[6].Feng J H课题组开发了多米诺迈克尔-烷基化反应合成不对称二氢呋喃衍生物[7].Miao C B课题组报道了在碱控制下,通过I2介导环化选择性构建多取代的二氢呋喃及其衍生物[8].尽管目前该类转化已经取得突破性进展,但整体看来多数反应仍然存在原料合成复杂冗长、条件苛刻以及选择性差等问题.因此,发展探寻更加绿色、经济、高效的二氢呋喃类化合物的合成方法就显得尤为重要.
在钌、铑、钯等过渡金属的催化下,重氮化合物能产生金属卡宾.这种金属卡宾中间体含有空轨道,具有一定的亲电性,这使重氮化合物能够通过一些重键进行环化反应[9-12].在近年的研究中,重氮羰基化合物常作为C1合成子或C2合成子参与环化反应.2017年,Ding Q P课题组开发了一种使用过渡金属铑催化氧化2-乙烯基苯胺与重氮二羰基化合物发生[5+1]环化反应来构建喹啉-2-羧酸酯衍生物的方法[13],如图2(a)所示;2018年,Mandal S课题组开发了一种在铑催化下2-芳基酞嗪-1,4-二酮与重氮二羰基化合物发生[4+2]环化反应合成酞嗪基稠合喹啉的方法[14],如图2(b)所示.
相比较而言,重氮化合物作为3原子合成子参与环化反应的报道甚少,且考虑到其具有合成杂环化合物的潜质以及原子经济性的优点[15-17],本文报道了使用重氮羰基化合物作为3原子合成子在过渡金属钯催化下与烯基苯胺发生[3+2]环化反应.在探索重氮羰基化合物新化学性质的同时,也合成了一系列具有手性季碳中心的2,3-二氢呋喃骨架化合物,如图2(c)所示.

(a)[5+1]环化,C-1合成子

(b)[4+2]环化,C-2合成子
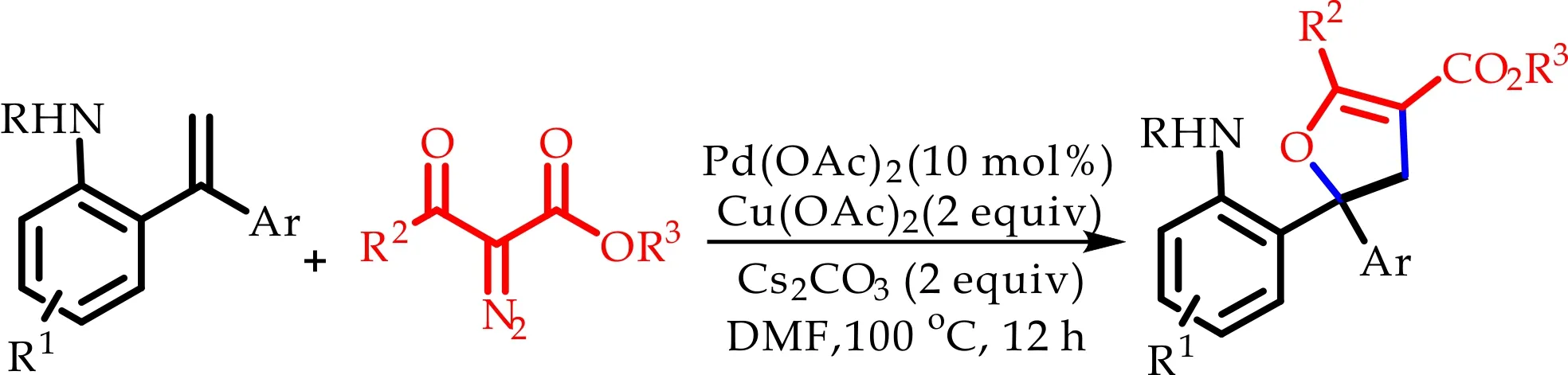
(c)本文所用[3+2]环化,3原子合成子图2 重氮羰基化合物作为合成子参与环化反应
1 实验部分
1.1 仪器和试剂
(1)主要试剂:对溴苯胺;苯乙炔;蒙脱石(KSF);二甲苯;对甲苯磺酰氯;2′-氨基苯乙酮;对溴苯甲醚;氰基硼氢化钠;2-溴噻吩;对甲苯磺酰叠氮;4-氟苯乙酮;对甲氧基苯乙酮;Cu(OAc)2(醋酸铜);Cs2CO3(碳酸铯);Pd(OAc)2(醋酸钯);以上试剂均购买自上海萨恩化学技术有限公司;200~300目柱层析用硅胶,青岛海洋化工厂.
(2)主要仪器:XT5型显微熔点仪,北京市科仪电光仪器厂;AVANCE III 400 MHz型核磁共振仪,德国Bruker公司;Impact HD Q-TOF型高分辨质谱仪,德国Bruker公司;VECTOR II型光谱仪,德国Bruker公司;旋转蒸发仪,上海亚荣科技有限公司;DF-101S型集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司.
1.2 二氢呋喃系列衍生物的合成
向5 mL反应瓶中依次加入Pd(OAc)2(4.4 mg,0.02 mmol)、Cu(OAc)2(72.6 mg,0.4 mmol)、Cs2CO3(130.0 mg,0.4 mmol)、2-乙烯基苯磺酰胺衍生物(0.2 mmol)以及重氮羰基化合物(0.2 mmol),加入溶剂DMF(1.6 mL),在Ar保护下100 ℃搅拌12 h.待反应结束后冷却至室温,用饱和氯化铵水溶液与乙酸乙酯萃取三次,得到的有机相用无水硫酸镁干燥,真空旋干.然后对样品进行硅胶柱色谱分离得到最终相应的二氢呋喃产物,最后用核磁、质谱、红外、熔点仪对产物进行表征.
产品的表征数据如下:
4-(4-甲氧基苯基)-2-甲基-4-(2-((4-甲基苯基)磺酰氨基)苯基)-4,5-二氢呋喃-3-羧酸乙酯(3a),白色固体(34.8 mg,产率69%).PE/EA=10∶2,Rf=0.34.熔点:128.5 ℃~130.5 ℃.1H NMR(400 MHz,Chloroform-d):δ7.71(s,1H),7.65(d,J=8.2 Hz,1H),7.41(d,J=7.9 Hz,1H),7.30-7.22(m,3H),7.08 (t,J=7.6 Hz,1H),7.04-6.96(m,4H),6.78-6.74 (m,2H),4.16(q,J=7.1 Hz,2H),3.82(s,3H),3.60(d,J=14.9 Hz,1H),3.23(d,J=14.7 Hz,1H),2.38(s,3H),2.32(s,3H),1.27(t,J=7.1 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ165.5,164.9,159.5,143.6,136.2,135.6,135.4,131.4,129.5,129.4,127.4,127.1,126.3,123.5,119.6,114.3,102.5,92.0,60.0,55.4,44.0,21.6,14.6,14.2.IR:3 347,3 050,2 969,2 857,1 685,1 600,1 164.HRMS (ESI):calculated for C28H30NO6S [M+H]+:508.1 794,found 508.179 0.
4-(5-溴-2-((4-甲基苯基)磺酰氨基)苯基)-2-甲基-4-苯基-4,5-二氢呋喃-3-羧酸乙酯(3b).无色油状(33.2 mg,产率60%).PE/EA=10∶2,Rf=0.4.1H NMR(400 MHz,Chloroform-d):δ7.69(s,1H),7.56(d,J=2.3 Hz,1H),7.50(d,J=8.8 Hz,1H),7.37-7.28(m,4H),7.17(d,J=8.5 Hz,2H),7.11-7.07(m,2H),7.0(d,J= 8.0 Hz,2H),4.16(q,J=7.1 Hz,2H),3.62(d,J=14.8 Hz,1H),3.23(d,J=14.8 Hz,1H),2.40(s,3H),2.32(s,3H),1.27(t,J=7.1 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ165.2,164.8,143.9,142.8,134.8,133.1,132.4,130.1,129.6,129.2,128.4,127.8,127.4,124.8,121.0,116.5,102.5,91.4,60.2,44.0,21.7,14.5,14.1.IR:3 342,3 055,2 980,2 849,1 724,1 615,1 178,697.HRMS (ESI): calculated for C27H27NO5SBr [M+H]+:556.079 3, found 556.078 5.
2-甲基-4-(2-((4-甲基苯基)磺酰氨基)苯基)-4-乙基(噻吩-2-基)-4,5-二氢呋喃-3-羧酸甲酯(3c).黄色固体(25.1 mg,产率52%).PE/EA=10∶2,Rf=0.32.熔点:124 ℃~126 ℃1H NMR(400 MHz,Chloroform-d):δ7.71(s,1H),7.66(d,J=8.2 Hz,1H),7.47(d,2H),7.37(d,J=7.9 Hz,1H),7.30-7.24(m,2H),7.14-7.05(m,3H),6.85-6.82(m,1H),6.59(d,J=3.6 Hz,1H),4.19(q,J=7.1 Hz,2H),3.54-3.43(m,2H),2.35(s,6H),1.30(t,J=7.1 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ164.7,164.1,147.0,143.2,135.7,134.6,130.9,129.0,126.8,126.3,126.3,125.9,124.9,123.2,119.4,102.1,89.0,59.5,44.6,29.2,21.1,13.9,13.6.IR:3 361,3 047,2 934,2 862,1 726,1 612,1 167.HRMS(ESI): calculated for C25H26NO5S2[M+H]+:484.125 2,found 484.124 7.
4-(4-甲氧基苯基)-2-甲基-4-(2-((4-甲基苯基)磺酰氨基)苯基)-4,5-二氢呋喃-3-羧酸甲酯(3d).白色固体(32 mg,产率65%).PE/EA=10∶2,Rf=0.28.熔点:110 ℃~112 ℃.1H NMR(400 MHz,Chloroform-d):δ7.65 (d,J=8.2 Hz,2H),7.41(d,J=7.9 Hz,1H),7.30-7.23(m,3H),7.09(t,J=7.6 Hz,1H),7.04-6.95(m,4H),6.80-6.73(m,2H),3.82(s,3H),3.70(s,3H),3.56(d,J=14.8 Hz,1H),3.27-3.20(m,1H),2.37(s,3H),2.32(s,3H).13C NMR(100 MHz,Chloroform-d):δ165.8,165.3,159.5,143.6,136.2,135.4,135.2,131.5,129.5,129.4,127.3,127.0,126.3,123.5,119.7,114.3,102.2,92.0,55.4,51.2,43.9,21.6,14.2.IR:3 341,3 048,2 966,1 691,1 601,1 181.HRMS(ESI):calculated for C27H28NO6S [M+H]+:494.163 7,found 494.162 9.
4-(4-甲氧基苯基)-4-(2-((4-甲基苯基)磺酰氨基)苯基)-2-苯基-4,5-二氢呋喃-3-羧酸乙酯(3e).淡黄色固体(30.1 mg,产率53%).PE/EA=10∶2,Rf=0.29.熔点:61 ℃~63 ℃.1H NMR(400 MHz,Chloroform-d):δ7.94-7.89(m,2H),7.84(s,1H),7.67(d,J=8.2 Hz,1H),7.52-7.45(m,4H),7.30-7.22(m,3H),7.13-7.07(m,3H),6.97(d,J=8.1 Hz,2H),6.81-6.76(m,2H),4.13(q,J=7.1 Hz,2H),3.91-3.84(m,1H),3.82(s,3H),3.47(d,J=15.3 Hz,1H),2.31(s,3H),1.22(t,J=7.1 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ164.7,162.3,159.5,143.6,136.0,135.7,135.3,131.2,131.1,129.5,129.4,129.1,128.2,127.4,127.2, 126.4,123.4,119.5,114.3,102.6,91.3,60.3,55.4,45.7,21.6,14.4.IR:3 352,3 059,2 924,2 838,1 697,1 603,1 163,1 091.HRMS(ESI):calculated for C33H32NO6S [M+H]+:570.195 0,found 570.195 6.
2,4-双(4-甲氧基苯基)-4-(2-((4-甲基苯基)磺酰氨基)苯基)-4,5-二氢呋喃-3-羧酸乙酯(3f).白色固体(33.5 mg,产率56%).PE/EA=10∶2,Rf= 0.23.熔点:57 ℃~59 ℃.1H NMR(400 MHz,Chloroform-d):δ8.00-7.95(m,2H),7.93(s,1H),7.66(d,J=8.2,1.2 Hz,1H),7.46(d,J=7.9,1.5 Hz,1H),7.30-7.22(m,3H),7.12-7.05(m,3H),7.02-6.95(m,4H),6.80-6.74(m,2H),4.14(q,J=7.1 Hz,2H),3.88(s,3H),3.83(m,4H),3.44(d,J=15.2 Hz,1H),2.31(s,3H),1.24(t,J=7.1 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ164.9,162.2,161.8,159.5,143.5,136.1,135.7,135.5,131.3,131.3,129.4,129.4,127.4,127.3,126.4,123.4,121.3,119.4,114.3,113.6,101.1,90.9,60.2,55.5,55.4,45.8,21.6,14.4.IR:3 361,3 056,2 939,2 829,1 711,1 597,1 160.HRMS(ESI):calculated for C34H34NO7S [M+H]+:600.205 6,found 600.204 8.
2-(4-氟苯基)-4-(4-甲氧基苯基)-4-(2-((4-甲基苯基)磺酰氨基)苯基)-4,5-二氢呋喃-3-羧酸乙酯(3g).白色固体(29.9 mg,产率51%).PE/EA=10∶2,Rf=0.3.熔点:62 ℃~64 ℃.1H NMR(400 MHz,Chloroform-d):δ7.99-7.92(m,2H),7.74(s,1H),7.65(d,J=8.2,1.3 Hz,1H),7.46(d,J=7.9,1.6 Hz,1H),7.30-7.23(m,3H),7.20-7.04(m,5H),7.02-6.96(m,2H),6.81-6.76(m,2H),4.14(q,J=7.2 Hz,2H),3.88-3.80(m,4H),3.48(d,J=15.4 Hz,1H),2.32(s,3H),1.23(t,J=7.2 Hz,3H).13C NMR(100 MHz,Chloroform-d):δ165.5, 164.6,163.0,161.2,159.6,143.6,136.2,135.6,135.2,131.9,131.8,131.2,129.5,129.5,127.4,127.2,126.4,125.3,123.5,119.6,115.5,115.3,114.4,102.6,91.3,60.4,55.4,45.5,21.6,14.4.IR:3 354,3 050,2 979,2 845,1 701,1 609,1 230,1 174.HRMS(ESI):calculated for C33H31NO6SF [M+H]+:588.185 6,found 588.185 8.
2 结果与讨论
2.1 条件优化
在前期对该类转化进行大量实验的基础上,本文重点拟尝试通过改变催化剂的类型和溶剂对反应进行简单的产率优化.
如表1所示,首先本文以0.2 mmol的1a与0.2 mmol的2a为标准底物,在Cu(OAc)2,Cs2CO3与THF组成的反应体系下分别对[Cp*RhCl2]2,[Ru(p-cymene)Cl2]2以及 Pd(OAc)2催化剂进行考察.实验结果表明,三种催化剂均能得到目标化合物3a(通过单晶衍射已确定结构,如图3所示),而Pd(OAc)2催化剂相对较优;随后在Pd(OAc)2催化剂的作用下,系统考察常用有机溶剂的作用效果,结果显示,当DMF作溶剂时,反应效果明显较好,能以69%的收率给出目标化合物;最后本文又在DMF溶剂下再次考察[Cp*RhCl2]2与[Ru(p-cymene)Cl2]2催化剂的效果,其分别以45%和52%给出3a.因此,根据初步的反应条件探索,本文确定了反应的较优条件为:Pd(OAc)2(0.01 mmol),Cu(OAc)2(0.2 mmol),Cs2CO3(0.2 mmol),DMF(0.8 ml)为溶剂在100 ℃下反应12 h.
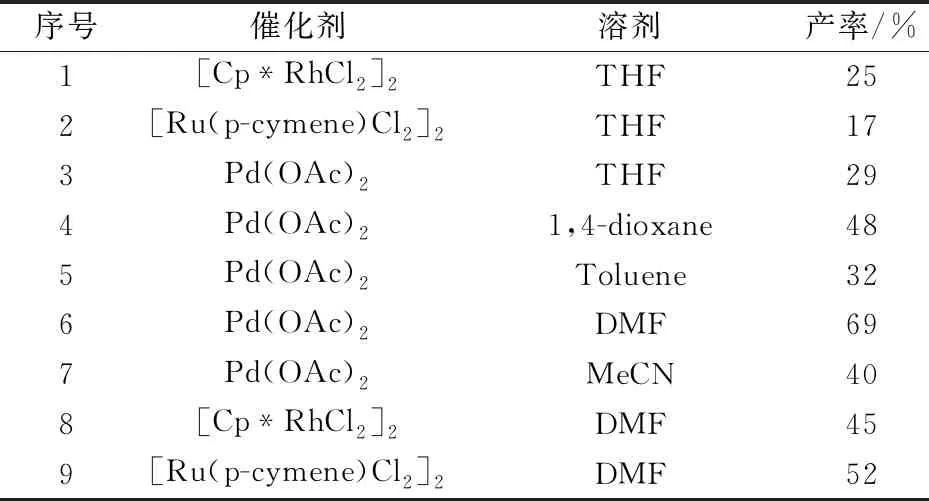
表1 反应条件优化
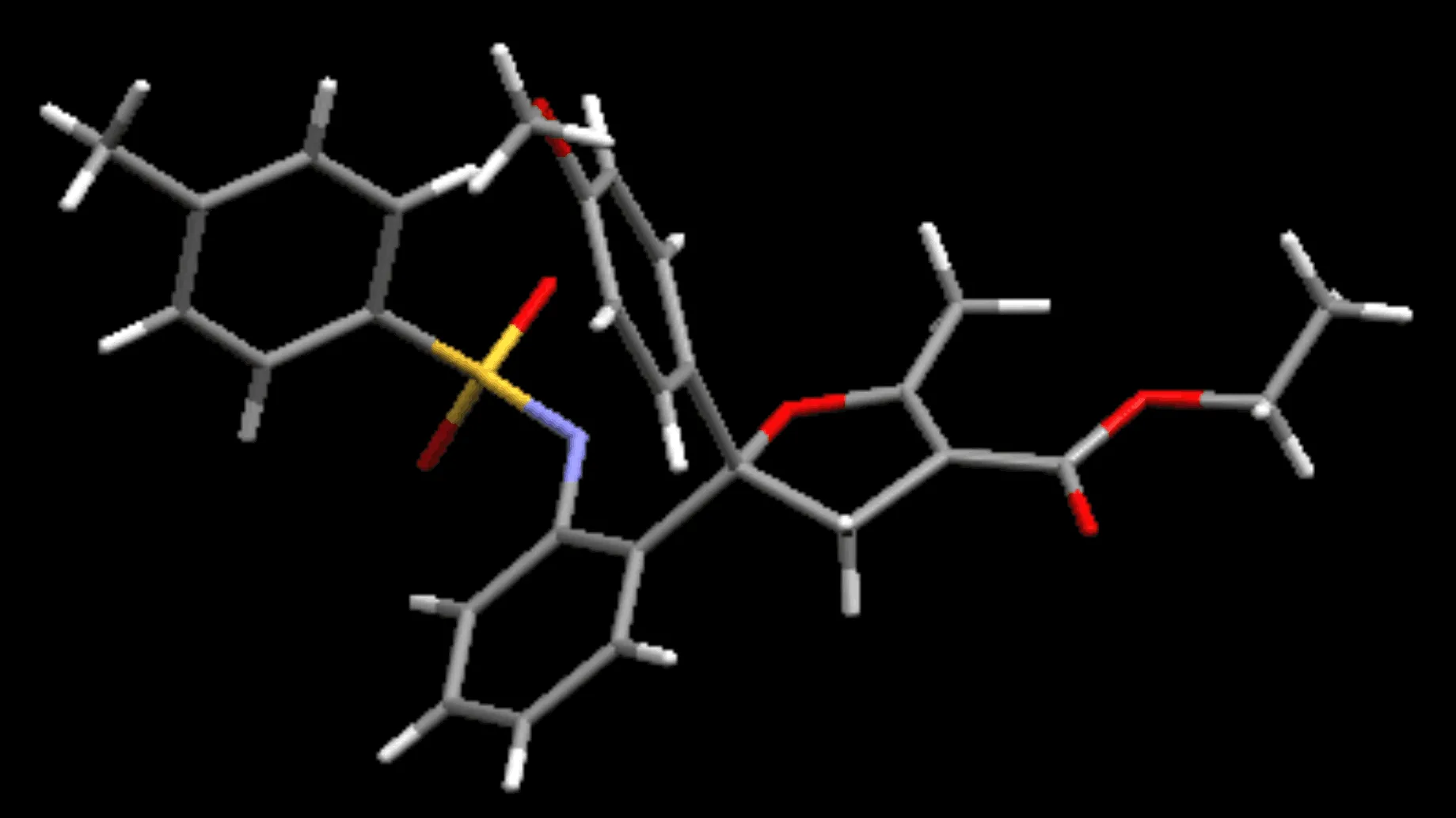
图3 化合物3a的单晶衍射图
2.2 底物适用性考察
在上文探索的反应条件下,本文对底物的适用性范围进行了考察.首先以重氮化合物2a为标准底物,对不同的底物1进行了考察.
如表2所示,当-Ar为对甲氧基苯基时,反应可以得到69%的收率.将苯基替换为噻吩芳香杂环,产率依然能达到52%,尽管噻吩的引入导致产率稍有下降.接着本文继续对R1所在的苯环进行不同取代基的尝试,当引入吸电子取代基Br原子时,仍然以60%的产率给出产物.随后本文又以2-乙烯基苯磺酰胺衍生物1a为标准底物,对底物2进行了拓展.将R3由Et替换为Me,反应仍能很好的发生,产率为65%.本文还尝试了将R2替换为C6H5、p-OCH3-C6H4、p-F-C6H4这类电子效应不同的基团,反应结果表明该类底物都能很好的兼容,分别以53%、56%、51%的产率给出产物3e、3f和3g,说明电子效应对反应的效率影响不大.最后,本文将-NHTs替换为-NHBn,实验结果表明并不能生成相应的产物3h,说明-NHTs可能是该类反应的必要导向基团.
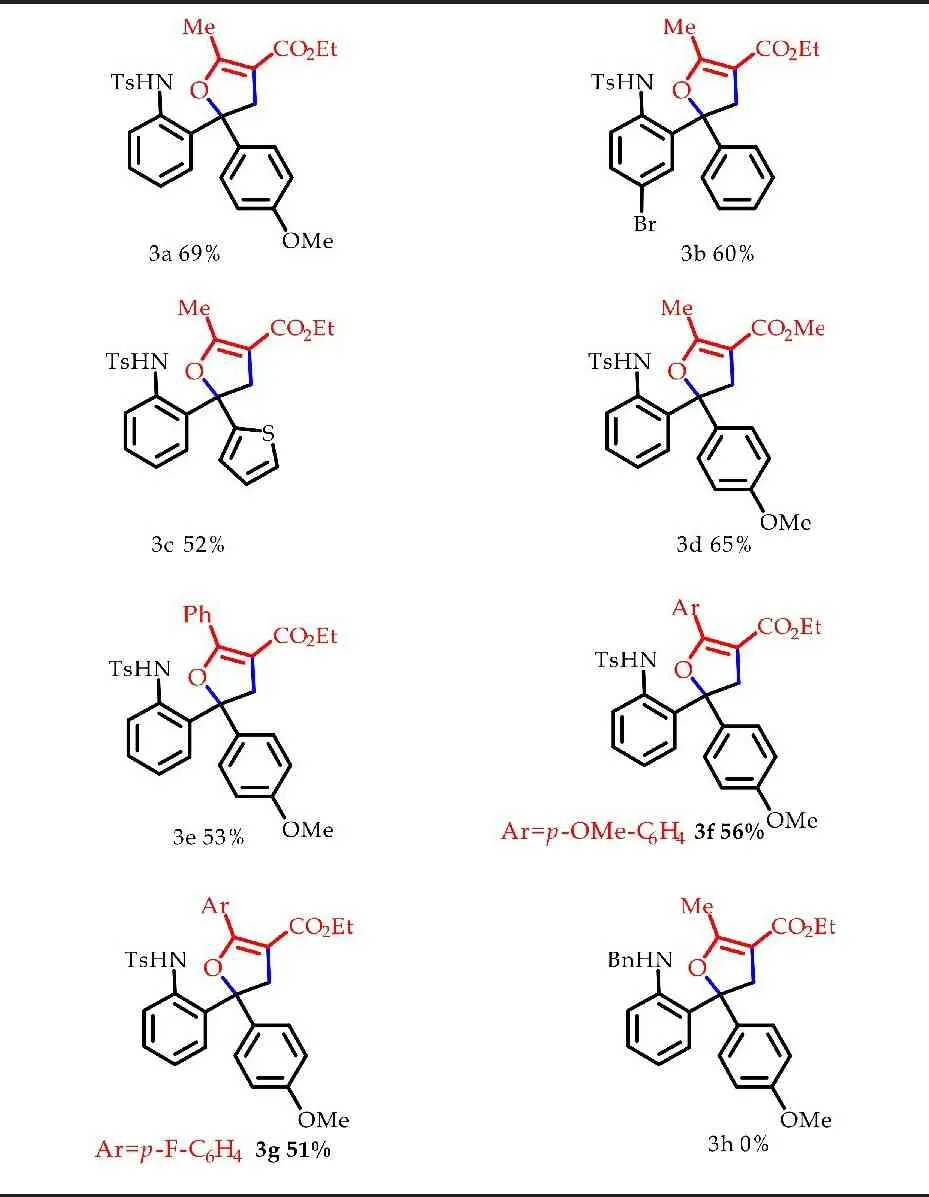
表2 Pd催化[3+2]环化构建二氢呋喃衍生物
2.3 控制实验与可能性反应机理
为了探究该转化的反应机理,本文依次选用结构相似的2-(1-苯基乙烯基)苯胺1i与1,1-二苯乙烯1j作为底物和重氮羰基化合物2a在标准条件下进行反应.如图4所示,反应均未得到目标化合物3i与3j.该结果充分表明:目标转化通过-NHTs作为导向基团,进而实现目标转化.

图4 导向基团的必要性探究
结合上述实验结果与相关文献[13]的报道,如图5所示,本文推测该反应首先在Ts导向作用下,PdⅡ活化烯基碳氢键生成中间体A,随后化合物2进行卡宾插入生成烷基钯物种B,烯醇互变与双键发生亲核加成获得五元杂环中间体C,最后该中间体通过醋酸分子进行质子化生成目标化合物3.
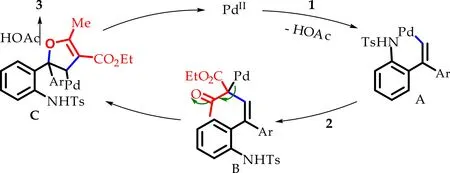
图5 可能性的反应机理
3 结论
综上所述,本文开发了一种重氮化合物在过渡金属Pd催化下作为3原子片段与2-乙烯基苯磺酰胺衍生物发生[3+2]环化反应,以51%~69%的产率得到七种含有季碳中心的二芳基取代二氢呋喃衍生物,该方法具有较好的底物适用性,不仅为二氢呋喃衍生物的合成提供新的思路,同时也发展拓宽了重氮羰基化合物作为3原子偶联片段为数不多的方法研究,为该类化合物的多样化转化提供了有效的依据.

