维持性血液透析患者握力与营养指标的相关性
胡美玲, 罗棉, 覃勋, 蒙如庆 △
1右江民族医学院研究生院(广西百色 533000); 2河池市人民医院肾内科(广西河池 547000)
肌肉力量(muscle strength, MS)是反映健康的重要预测因子,比肌肉质量更能预测临床结果。MS下降在慢性肾脏病(chronic kidney disease,CKD)患者早期即可出现[1],而终末期肾脏病(end stage renal disease, ESRD)患者由于微炎症状态、血液透析、贫血、年龄、缺乏运动等因素更易出现MS降低,导致维持性血液透析(MHD)患者的生存质量下降、死亡率增高[2]。握力(handgrip strength, HGS)是评估整体MS的可靠指标,对全身MS具有良好的代表性,与各种并发症如:高血压、糖尿病、心血管疾病、慢性阻塞性肺疾病等有关,可对健康人群的全因死亡及心血管死亡风险进行评估[3]。握力测量简单、快速、廉价、无创且客观,可以在患者床边轻松地进行,能持续、动态地监测患者的MS,更适用于临床。大量研究显示握力与MHD患者的营养状况、临床不良结局及全因死亡率密切相关[4-6]。然而。遗憾的是目前国内与MHD患者握力相关的研究报道较少。本研究拟通过横断面调查,分析MHD患者握力及相关营养指标的关系,为握力测量在透析患者中的应用及推广提供一定的理论基础。
1 资料与方法
1.1 一般资料 本研究为单中心横断面调查,选取2018年3—9月在河池市人民医院血液透析中心规律透析治疗的患者,所有研究对象的透析方式均采用一次性聚砜膜透析器,膜面积1.4~1.5 m2,每周2~3次,每次3.5~4.5 h;均使用碳酸氢盐透析,透析液钙浓度1.5 mmol/L,透析液流量500 mL/min,血流量200~250 mL/min;抗凝方式为普通肝素或低分子肝素,血液透析机为金宝AK95S、费森尤斯4008S。纳入标准:(1)规律血液透析治疗3个月及以上的患者;(2)年龄18~80岁;(3)无心、脑、肺手术史,无瘫痪及抽搐史;(4)患者自愿参加本研究。排除标准:(1)不配合握力测量,握力数据缺失者;(2)有明显精神疾病及认知功能障碍;(3)合并恶性肿瘤、肝硬化、慢性阻塞性肺疾病、活动性炎症性疾病、手部外伤和畸形、低钾和低钠血症;(4)由腹膜透析、肾移植转为血液透析;(5)无法和(或)不能配合完成研究所需流程者。本研究方案获得该院伦理委员会审查批准,所有患者均签署知情同意书。最终纳入受试者124例,其中男80例(64.5%),女44例(35.5%),年龄(18~80)岁,平均年龄(54.35±15.22)岁,身高(138.0~180.0)cm,平均身高(161.34±7.75)cm,体重(40.0~99.8)kg,平均(54.97±11.51)kg,透析年龄(6~116)个月,中位透析年龄26(12,45)个月。握力水平整体均值为(22.95±7.81)kg,其中男(25.88±7.15)kg,女(17.62±5.96)kg。相对握力整体均值为(1.029±0.135)kg/体质指数(BMI),其中女(0.814±0.122)kg/BMI,男(1.444±0.135)kg/BMI。汉族41例(33.06%),壮族76例(61.29%),其他民族7例(5.65%)。内瘘80例(64.52%),深静脉导管41例(33.06%),其他3例(2.42%)。慢性肾小球肾炎39例(31.71%),糖尿病肾病(DN)17例(13.82%),高血压肾损害12例(9.76%),梗阻性肾病10例(8.13%),免疫相关性肾损害5例(4.07%)(其中ANCA相关性肾损害2例,狼疮性肾炎3例),多囊肾4例(3.25%),慢性间质性肾炎3例(2.44%),其他原因33例(26.83%)。
1.2 研究方法 (1)患者基本信息:包括姓名、性别、年龄、民族、透析年龄、超滤量、吸烟史、肾脏原发疾病、血管通路方式等。(2)实验室指标:所有患者于透析前、后留取血标本,透析前均空腹8 h以上,使用全自动生化检测仪(德国Roche Elecsys 2010)测定患者血红蛋白(hemoglobin, Hb)、血清白蛋白(serum albumin, Alb)、空腹血糖(fast plasma glucose, FPG)、血肌酐(serum creatinine, Scr)、血尿素氮(blood urea nitrogen, BUN)。高灵敏免疫比浊法测定高敏C反应蛋白(high sensitivity C-reactive protein, hs-CRP)。尿素清除指数(urea clearance index, Kt/V)的计算公式为:Kt/V=-ln(R-0.008t)+(4-3.5R)×UF/W,其中ln为自然对数,R为透析后与透析前的血尿素比值,t为透析时间(h),UF为超滤量(L),W为透析后患者的体重(kg)。(3)人体测量指标:所有患者均由同一研究人员于透析前5~10 min采用国家体育总局研发的CWL-I型握力计进行握力测定。测力者以透析前非造瘘手(插管者优势手)持握力计,据患者手型适当调整握距,掌心向内,表盘朝外,身体直立,双臂自然下垂,避免握力计与身体和衣物接触,共测量3次,每次测量时间间隔10 s及以上,记录平均值。按握力水平大小将握力四分位分组(Q1、Q2、Q3、Q4组)并进行比较。同时,在评估患者无明显水肿及临床症状时测量其体重、身高。计算BMI为体重(kg)/身高2(m2)。由于握力水平与患者的身高和体重密切相关,目前在肌肉健康的研究中建议使用BMI调整MS[7],故本研究亦用相对握力(relative handgrip strength)来衡量患者的MS,相对握力计算为握力(kg)/BMI。

2 结果
2.1 MHD患者握力的四分位组间比较 4组年龄、体重、BMI、少数民族比率、DN比例、动静脉内瘘比率、hs-CRP组间比较差异无统计学意义(P>0.05);随着握力水平的升高,患者的身高、Alb、Hb、Scr水平出现逐渐升高趋势,差异有统计学意义(P<0.05),而从不吸烟人数比例出现逐渐降低趋势,差异有统计学意义(P<0.05)。见表1。
2.2 MHD患者握力及相对握力的相关性分析 Spearman相关性分析显示,性别、身高、体重、Hb、Alb、Scr与患者握力呈正相关(P<0.01),透析年龄、Kt/V、FPG与患者握力呈负相关(P<0.01),其中性别与握力的相关性最强(r=0.500 0),其次为体重(r=0.449)。调整BMI后相对握力的相关性分析显示,Hb、Alb、Scr与患者相对握力呈正相关(P<0.05),年龄、透析年龄、Kt/V、FPG与患者相对握力呈负相关(P<0.05),见表2。


项目握力四分位(kg)Q1组Q2 组Q3组Q4组(7.40~17.1)kg(17.16~22.16)kg(22.43~29.30)kg(29.43~40.07)kgP值性别[男,例(%)]10(32.26)17(54.84)24(77.42)29(93.55)<0.001年龄(岁)57.55±11.9656.29±16.6052.16±15.3351.39±16.360.300身高(cm)157.81±7.65159.29±8.52162.87±6.65165.39±5.84<0.001体重(kg)54.89±10.1058.55±12.8461.55±12.9462.41±10.260.051BMI(kg/m2)21.92±2.7922.97±4.2823.07±3.6822.83±3.650.582少数民族[例(%)]21(67.74)20(64.52)25(80.65)17(54.84)0.280透析年龄(月)∗34.00(25.00, 50.00)33.00(21.00, 59.50)16.00(9.00, 29.00)20.00(10.00, 32.00)0.049从不吸烟[例(%)]23(74.19)19(61.29)12(38.71)8(25.81)0.005DN[例(%)]8(25.81)7(22.58)3(9.68)6(19.35)0.408动静脉内瘘[例(%)]25(31.25)18(22.5)23(28.75)14(17.5)0.534Alb(g/L)37.51±2.6539.34±3.0939.52±2.2040.50±2.69<0.001Scr(μmol/L)958.83±237.03992.00±343.431 186.52±357.991 258.45±430.310.002FPG(mmol/L)∗8.27(7.29, 10.76)6.56(5.54, 7.33)7.27(5.85, 8.14)6.85(5.85, 8.07)0.024hs-CRP(mg/L)∗5.60(3.05, 12.53)6.80(1.75, 14.05)3.65(1.40, 11.15)3.70(1.70, 12.90)0.637Hb(g/L)90.66±23.91103.23±13.76102.19±19.44109.10±17.010.003Kt/V1.59±0.311.39±0.391.32±0.341.36±0.410.030
*M(P25,P75)
2.3 MHD患者相对握力的多元线性回归分析 以调整BMI后相对握力为因变量,性别、年龄、透析年龄、Kt/V、Hb、Alb、Scr、FPG为自变量进行多元线性回归分析,发现性别、年龄、Hb、Alb、Scr、FPG是所有患者相对握力的影响因素(P<0.05),其中性别与相对握力的回归系数最大(β=0.074)。以性别分层后分别进行多元线性回归分析显示,年龄、Hb、Alb与男性和女性患者相对握力均有关,而Scr(β=0.000)和FPG(β=-0.018)仅与男性患者相对握力有关。见表3。

表2 MHD患者握力及相对握力与变量的相关性分析
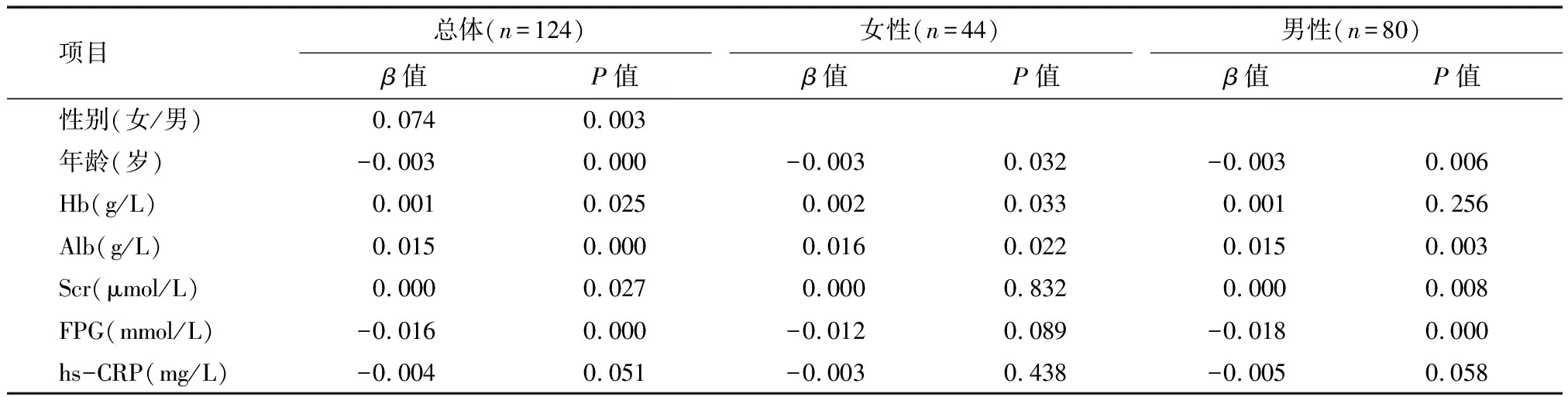
表3 MHD患者相对握力的多元线性回归分析
3 讨论
营养不良在终末期CKD患者中普遍存在,ESRD患者接受透析治疗后,尿毒症毒素引起的厌食、恶心、呕吐等症状出现缓解,但由于透析过程本身等因素患者的营养不良发病率仍居高不下。营养状况被认为与MHD患者的高死亡率、高心血管发病率、持续的微炎症状态等密切相关,是透析患者死亡率的强预测指标[8]。因此,积极的筛查和动态监测MHD患者的营养状况,早期识别和适当干预营养状况降低的透析患者,是提高MHD患者的生存质量及生存率的关键。
MS与机体的营养状况、功能减退、代谢综合征及心血管疾病风险等有关[9-11],营养不良中蛋白质的丢失会对MS和肌肉功能造成负面影响,美国肠内与肠外营养学会推荐用于诊断成年人营养不良的标准中包括肌肉质量和MS的减少[12]。在MS的测试中,握力测量简单、快速、廉价、无创,在肌肉减少症的诊断中亦被广泛接受。握力作为反映MS的可靠指标,有研究显示其对营养状况的丧失和补充均有反应[13]。近年来,国内外均有研究发现握力与MHD患者的营养状况有关[14-16],而低握力似乎预示着MHD患者的高发病率和高死亡率。根据美国国立卫生研究院(The Foundation for the National Institute of Health, FNIH)制定标准[9],低握力被定义为:男性<26 kg,女性<16 kg,高握力被定义为:男性 ≥26 kg,女性≥16 kg。据此截点标准,本研究中46.25%的男性患者和43.18%的女性患者符合该低握力标准,与前期Matsuzawa等[17]的研究报道结果相似。国内彭晓艳等[6]的研究发现握力预测男性患者全因死亡的最理想值为35.0 kg,女性为18.9 kg,若以此为截点,本研究中84.09%的男性患者和54.56%的女性患者出现低握力现象,稍高于国外研究报道。
Hb和Alb是反映患者长期营养状况的有效指标,MHD患者由于尿毒症毒素蓄积、持续的微炎症状态、促红细胞生成素抵抗、蛋白分解增强等原因易出现低白蛋白血症和贫血。目前,多数学者认为Alb水平、Hb水平与MHD患者的死亡率有关。Lukowsky 等[18]发现Alb<35 g/L是透析患者的死亡危险因素。DOPPS(Dialysis Outcome and Practice Pattern Study)研究表明[19],透析患者的Hb每降低 10 g/L,死亡风险升高 6%。低白蛋白血症患者抵抗力低下,感染概率高,从而导致其死亡率升高;贫血患者血流动力学的变化,引起心血管负荷加重,最终导致心血管事件发生率升高。然而,研究显示透析患者低白蛋白血症和贫血的发生均与体内持续的微炎症状态密切相关[20],炎症因子可直接或间接抑制食欲并造成肌肉蛋白质分解增强,而蛋白质摄入减少、分解增强与患者的MS下降密切相关,最终导致低白蛋白血症和贫血患者的握力下降;同时,这亦可能是握力预测透析患者全因死亡、心血管死亡的机制之一。
尽管Alb常被认为是一种营养标记物,并被证明可以预测透析患者的预后,但越来越多的证据表明它可能与慢性炎症而不是营养状况相关[21],并发现Alb与死亡率之间的关联可能是由于炎症而不是营养摄入不足引起。所以,我们可能需要一种更可靠地反映透析患者营养状况的营养标记物。本研究中,相对握力和握力均与营养指标密切相关,但却与hs-CRP未呈现出关联性,可见握力与Alb相比并未受到炎症状况的影响,可能是比Alb更为可靠的营养状况指标。Garagarza等[22]研究发现Alb与握力的关系仅在男性患者中存在,但该研究亦显示,身体组成成分瘦组织质量(lean tissue mass, TLM)和体细胞数量(body cell mass, BCM)对患者握力的预测贡献较大;本研究中男性及女性患者的Alb均与相对握力相关,但我们使用的相对握力是对与身体组成成分密切相关的BMI进行调整后的数值。
DN是发达国家ESRD患者最常见的病因。糖尿病患者的动脉粥样硬化病变患病率高,发病率早,病情进展快,易出现肢体动脉硬化和周围神经病变,最终造成肌肉组织的营养不良。合并糖尿病透析患者的骨骼肌蛋白质和肌肉萎缩明显,骨骼肌病发病率和患病率高于非糖尿病患者[23]。研究表明,肌肉健康是2型糖尿病发展的重要预测因子[24]。虽然肌肉健康与葡萄糖代谢的关联机制尚未得到很好的认识,但目前我们认为肌肉健康与胰岛素抵抗和葡萄糖代谢相关,低肌肉健康是葡萄糖耐量受损的一个重要危险因素[25]。本研究中FPG与握力呈负性关系,随着FPG水平升高,握力水平逐渐下降,但多元回归分析中FPG仅对男性患者的相对握力有影响,而与女性患者无关,这可能与雌激素对女性代谢的益处有关,雌激素可能克服或减弱握力水平下降对葡萄糖代谢的不利影响[26]。
Scr是人体肌肉组织中储能物质肌酸(creatine)的代谢终产物。Scr包括内源性肌酐和外源性肌酐,内源性肌酐由肌酸代谢产生,与肌肉容量和肌肉活动情况有关;外源性肌酐与饮食密切相关,主要来自动物的骨骼肌,饮食中摄入的肌酸可转变为肌酐,食用加热后的动物肌肉(其中肌酸转变为肌酐,肌酐在胃肠道中被迅速吸收)会导致Scr水平迅速增高。有研究表明[27],食物中摄入的肌酐可达肌酐排泄总量的30%。可见,Scr不仅是尿毒症毒素的标志物,还是患者营养状态的预测因子,可在一定程度上反映患者的肌肉储备和蛋白质摄入情况。其实Scr不仅与肌肉质量有关,还可能与测量握力的肌肉力量有关;有研究[28]显示Scr是透析患者握力的影响因素,与本研究结果一致。
本研究为一横断面调查,由于未能动态监测患者握力变化与营养状况之间的关联,且研究受样本量及研究人群限制,未来还有待相关的前瞻性及大样本量研究。综上所述,MHD患者握力及相对握力与Alb、Hb、Scr及FPG营养指标密切相关,是筛查和动态监测营养状况的潜在标记物,值得在透析患者中进一步应用。

