青藤碱对兔膝骨关节炎模型组织形态学及关节液炎性细胞和聚集蛋白聚糖酶含量的影响
郑洁 赵莉平 胡亚莉 袁普卫
摘要:目的 观察不同剂量青藤碱对兔膝骨关节炎(OA)模型关节软骨和滑膜组织形态学及关节液白细胞介素(IL)-6、IL-17及聚集蛋白聚糖酶(ADAMTS)-4、ADAMTS-5含量的影响。方法 采用Hulth法建立OA模型。将50只新西兰大白兔随机分为空白组、模型组和青藤碱低、中、高剂量组。空白组不予任何处理,模型组给予生理盐水、给药组给予盐酸青藤碱注射液膝关节腔注射,共干预10次,青藤碱给药量分别为0.2 mL(5 mg)、0.35 mL(8.75 mg)和0.5 mL(12.5 mg)。干预结束后取关节软骨行番红O染色,取滑膜组织行HE染色,进行组织学评分;ELISA检测关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量。结果 模型组软骨Mankins评分和滑膜组织病理学评分显著高于空白组(P<0.01),青藤碱中、高剂量组软骨Mankins评分和滑膜评分显著低于模型组(P<0.05,P<0.01);模型组关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量较空白组显著升高(P<0.01),青藤碱中、高剂量组关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量较模型组显著降低(P<0.05,P<0.01)。结论 中、高剂量青藤碱对OA模型病变软骨具有保护作用。
关键词:青藤碱;骨性关节炎;白细胞介素-6;白细胞介素-17;聚集蛋白聚糖酶;兔
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)06-0051-04
Abstract: Objective To observe the effects of different concentrations of sinomenine (SIN) on morphology of synovium and cartilage and contents of IL-6, IL-17, ADAMT-4 and ADAMT-5 in synovial fluid of rabbit knee osteoarthritis model. Methods After establishing the knee osteoarthritis model by Hulth method, the New Zealand white rabbits were randomly divided into control group, model group, SIN low-, medium- and high-dosage groups. Control group did not receive any treatment. Model group and other administration group received saline and SIN knee joint injection, for 10 times. The dosages of SIN were 0.2 mL (5 mg), 0.35 mL (8.75 mg), and 0.5 mL(12.5 mg), respectively. After intervention, the articular cartilage was stained with Safranin O, and the synovium was taken for HE staining and histological scoring. The levels of IL-6, IL-17, ADAMTS-4 and ADAMTS-5 in joint fluid were detected by ELISA. Results Mankins scores of articular cartilage and histological scores of synovium in model group were significantly higher than control group (P<0.01), and the Mankin's score and synovial score in SIN medium- and high-dosage groups were significantly lower than those in the model group (P<0.05, P<0.01). The levels of IL-6, IL-17, ADAMTS-4 and ADAMTS-5 in the model group were significantly higher than those in the control group (P<0.01). The levels of IL-6, IL-17, ADAMTS-4 and ADAMTS-5 in SIN medium- and high-dosage groups were significantly lower than those in the model group (P<0.05, P<0.01). Conclusion SIN medium and high dosage can delay the degradation of articular cartilage of osteoarthritis model.
Keywords: sinomenine; osteoarthritis; IL-6; IL-17; ADAMTS; rabbits
骨性關节炎(osteoarthritis,OA)通常被视为因增龄及生物力学机制改变等因素引起的,以关节软骨损伤为中心并累及关节周围多种组织的退行性关节病。近年研究发现,包括滑膜炎性反应在内的生物学因素在OA进程中发挥重要作用,滑膜炎不仅是引起OA患者关节肿痛、关节功能障碍的重要因素,且与软骨退变程度及骨赘形成密不可分[1]。应用高分辨率成像模式及关节镜可视化技术的研究发现,滑膜炎在OA关节软骨退变发生之前就已出现[2]。对有临床症状但无影像学改变的OA患者动态膝关节镜检查显示,滑膜炎与膝关节内侧软骨丢失的未来发展联系紧密[3]。磁共振成像研究也得出类似结果,即滑膜炎性反应程度与OA进程密切相关[4]。青藤碱是从防己科藤本植物青风藤中提取的生物碱单体,为青风藤的主要活性成分。我们前期实验研究发现,青藤碱具有抑制木瓜蛋白酶诱导的兔膝OA滑膜炎性反应及保护关节软骨的作用[5]。本研究进一步观察不同剂量青藤碱对Hulth法诱导膝OA模型兔关节液炎症因子白细胞介素(IL)-6、IL-17及带有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶家族成员中聚集蛋白聚糖酶(ADAMTS)-4、ADAMTS-5含量,以及关节滑膜和软骨组织形态学的影响,为青藤碱在OA的临床应用提供依据。
1 材料与方法
1.1 动物与分组
新西兰大白兔50只,雌雄各半,体质量2.0~2.4 kg,西安交通大学医学院实验动物中心提供,动物合格证号SCXK(陕)2014-003。标准饲料、单笼喂养,室温20~25 ℃,相对湿度45%~60%,每日正常光照,自由摄食饮水。适应环境1周后,随机分为空白组、模型组和青藤碱低、中、高剂量组,每组10只。
1.2 药物、试剂与仪器
盐酸青藤碱注射液,湖南正清制药集团股份有限公司,批号1607405;IL-6、IL-17、ADAMTS-4和ADAMTS-5 ELISA试剂盒,北京诺博莱科技有限公司;Bio-Tec ELX808型酶标仪(美国Bio-Tec公司),超薄切片机(德国LEICA公司),ZEISS研究级正置数码显微镜(德国ZEISS公司)。
1.3 造模
采用Hulth法[6]建立兔膝OA模型。10%水合氯醛(300 mg/kg)腹腔注射麻醉,将兔仰卧后固定右膝关节于屈曲位,膝关节剪毛、常规消毒,采用内侧切口暴露关节腔,直视下切除内侧半月板,切断前、后交叉韧带,生理盐水冲洗切口,使用4-0号缝线逐层关闭切口,术后注射青霉素预防伤口感染。术后6周随机处死2只兔行关节软骨病理学检查,结果显示典型软骨退变,同时行为学观察发现兔右膝关节出现肿胀、跛行,表明造模成功。按盐酸青藤碱注射液成人用药剂量(2 mL/次),按Meeh-Rubner公式计算人兔等效剂量。青藤碱低、中、高剂量组膝关节腔注射盐酸青藤碱注射液,用量分别为0.2 mL(5 mg)、0.35 mL(8.75 mg)、0.5 mL(12.5 mg),模型组膝关节腔注射0.2 mL生理盐水,每3 d干预1次,共干预10次,空白组不予处理。
1.4 组织形态学观察
1.4.1 软骨组织
干预结束后,切取右膝内侧胫骨平台软骨,15%中性甲醛溶液固定72 h后,EDTA脱钙,石蜡包埋,进行番红O染色。光学显微镜下对软骨组织结构进行观察,每张切片选择3个不同的视野,参照Mankins关节软骨病理评分标准[7]进行评分。
1.4.2 滑膜组织
取右膝髌骨下滑膜组织,10%中性甲醛固定,石蜡包埋,HE染色。每张切片选择3个不同的视野,对滑膜里衬层细胞及滑膜下组织进行观察并评分。滑膜里衬层细胞观察内容为增生、肥大和炎性细胞浸润,滑膜下组织观察内容为肉芽组织增生、血管组织长入和炎性细胞浸润,均按无、轻、中、重分别计0、1、2、3分[8]。
1.5 关节液相关因子含量测定
干预结束后,右膝关节腔生理盐水冲洗法取关节液,ELISA测定关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量,严格按试剂盒说明书进行操作。
1.6 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以±s表示,多组数据间比较用方差分析。P<0.05表示差异有统计学意义。
2 结果
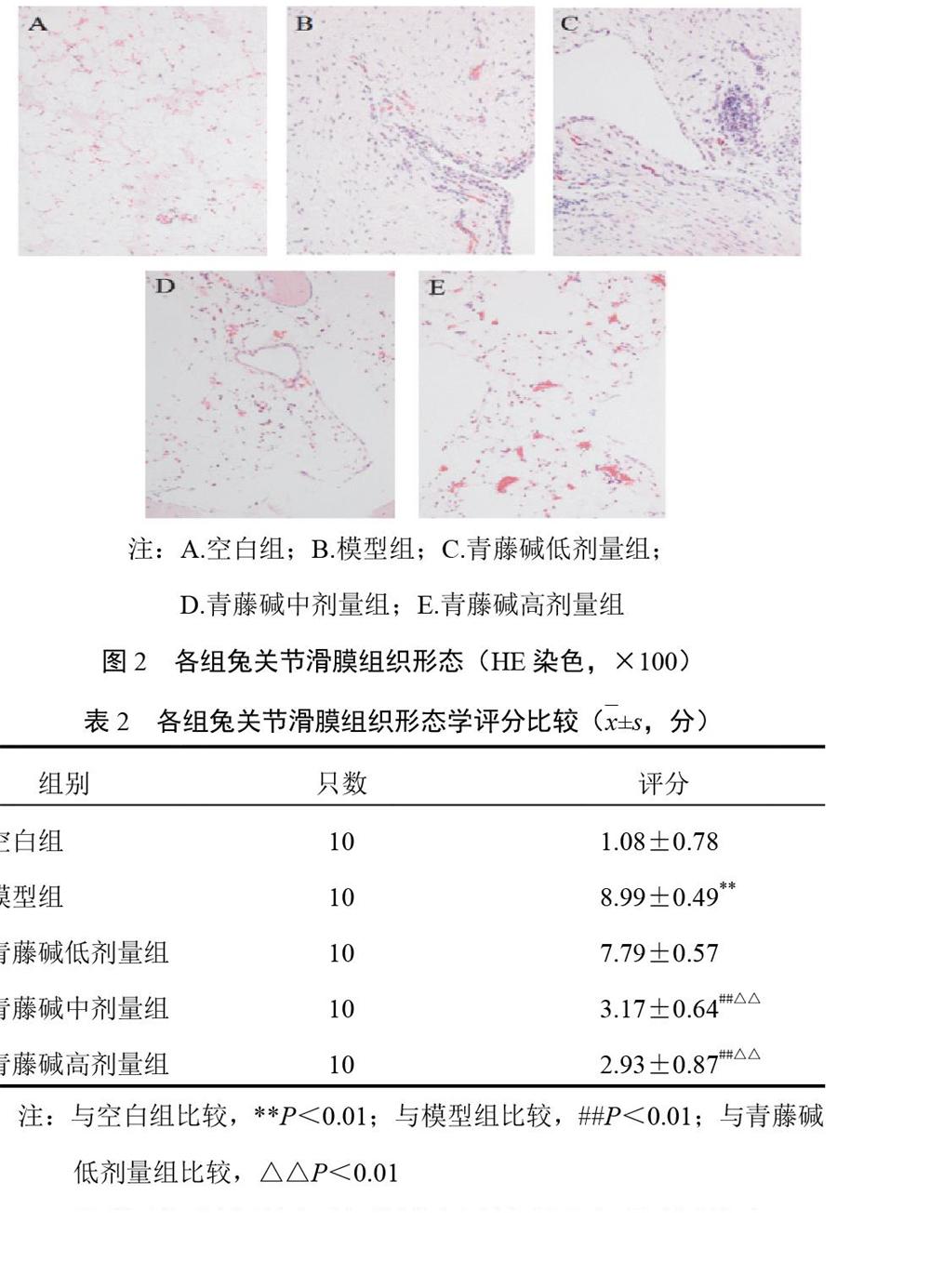
2.1 软骨组织形态学观察及Mankins评分结果
空白组软骨表面平整光滑,软骨结构层次清晰,着色均匀,软骨细胞分布均匀;模型组软骨坍塌,结构层次严重紊乱,细胞数显著减少甚至消失,潮线模糊不清;青藤碱低剂量组软骨表面粗糙不平整,软骨自表层出现多处裂隙深达放射层,软骨细胞明显减少,潮线无法辨识;青藤碱中、高剂量组软骨结构完整,表层粗糙不平整,软骨细胞数弥漫性增多,潮线清晰完整。见图1。与空白组比较,模型组Mankins评分显著升高(P<0.01);与模型组和青藤碱低剂量组比较,青藤碱中、高剂量组Mankins评分明显降低(P<0.05,P<0.01)。见表1。
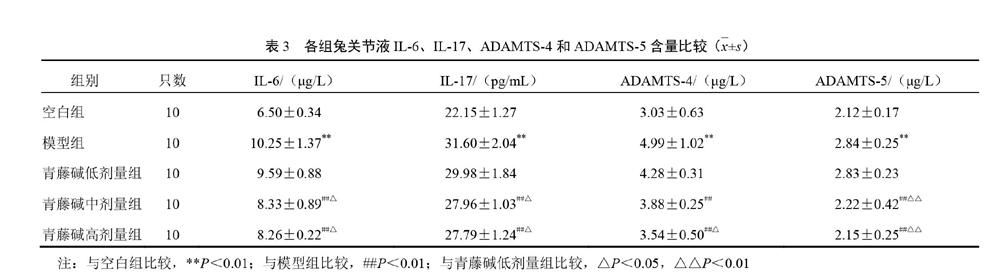
2.2 滑膜组织形态学观察及评分结果
空白组滑膜薄而细胞数少,无炎性细胞浸润;模型组滑膜里衬层显著增厚,全层均有炎性细胞浸润,滑膜下层有肉芽组织生成,伴血管增生;青藤碱低剂量组滑膜里衬层增厚,滑膜细胞肥大,炎性细胞浸润明显;青藤碱中、高剂量组里衬层少许炎性细胞浸润。见图2。与空白组比较,模型组滑膜评分显著升高(P<0.01);与模型组和青藤碱低剂量组比较,青藤碱中、高剂量组滑膜评分显著降低(P<0.01),2组评分无显著差异(P>0.05)。见表2。
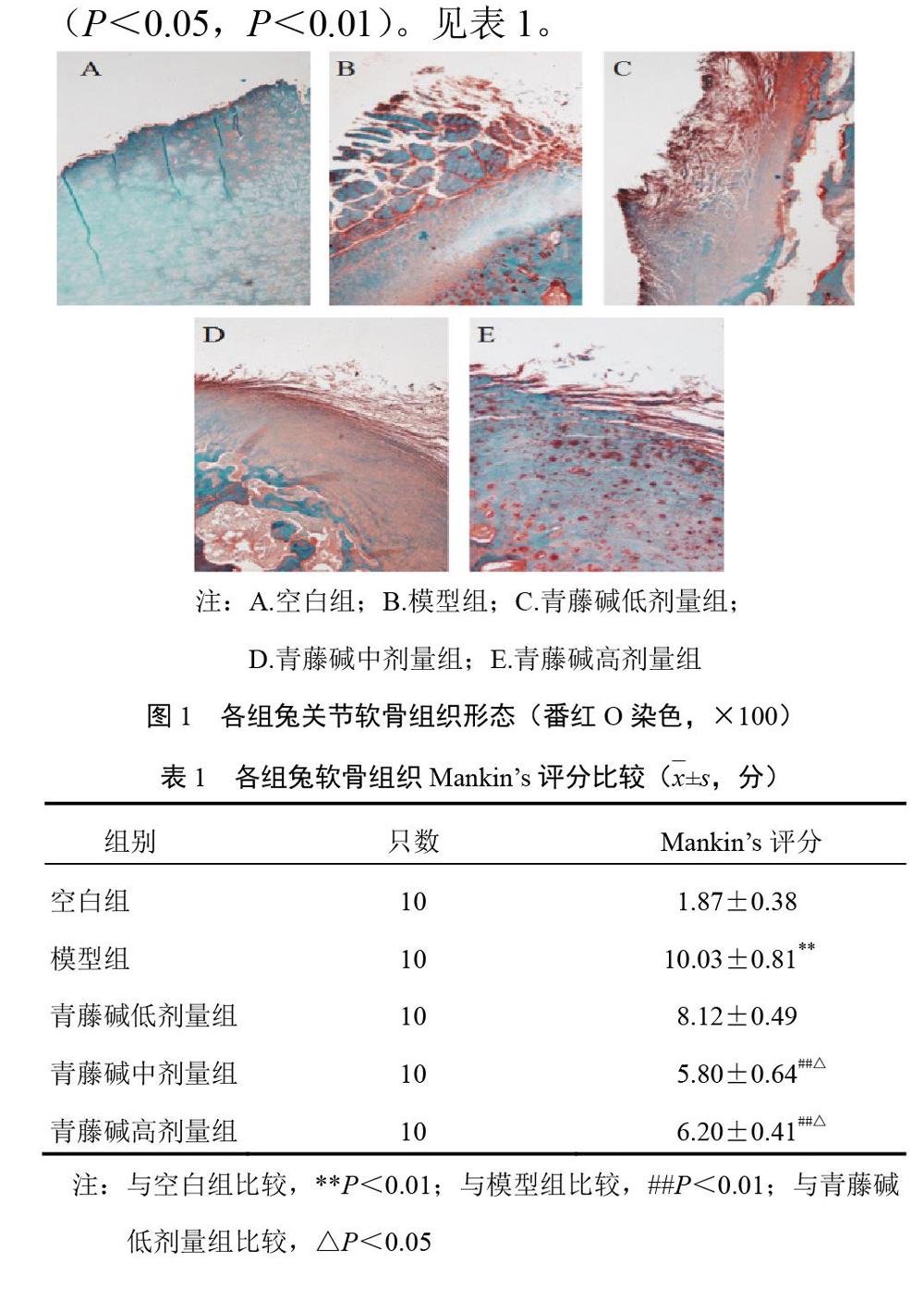
2.3 青藤碱对模型兔关节液相关因子含量的影响
与空白组比较,模型组兔关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量显著升高(P<0.01);与模型组和青藤碱低剂量组比较,青藤碱中、高剂量组兔关节液IL-6、IL-17、ADAMTS-4和ADAMTS-5含量显著降低(P<0.05,P<0.01)。见表3。
3 讨论
OA是与增龄、肥胖、机械压力和损伤等多种因素相关的复杂性关节疾病,其具体发病机制仍不明确。目前普遍认为,关节软骨微环境变化导致的软骨细胞合成代谢与分解代谢的不平衡是造成软骨退变的核心问题,软骨细胞分解代谢超过合成代谢,导致构成细胞外基质胶原的破坏和蛋白聚糖的流失[9]。近年来滑膜炎性反应在OA病理生理中作用日益受到关注,并被认为与力学因素发挥着同等重要的作用[10]。炎性环境下,肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6、IL-17等促炎细胞因子含量显著提高,这些炎性细胞因子进而促进基质金属蛋白酶(MMPs)和ADAMTS含量及活性显著上调,导致软骨细胞外基质分解代谢超过合成代谢[11]。IL-17作为促炎细胞因子,在自身免疫性疾病发病中发挥着重要作用。有研究发现,IL-17在类风湿关节炎患者滑膜中呈高表达[12],IL-17能促进软骨细胞、滑膜细胞、巨噬细胞和骨细胞分泌TNF-α、IL-1β和IL-6等炎性细胞因子,还可促进MMPs的合成,提高破骨细胞活性,抑制成骨细胞活性[13-15]。近年研究表明,IL-17在OA病理中也发挥着重要作用。OA患者關节液IL-17显著升高,且IL-17水平与膝关节疼痛严重程度呈正相关,阻断IL-17信号通路可以缓解关节疼痛[13]。MMPs和ADAMTS是在成年软骨中参与软骨细胞外基质降解的主要蛋白酶,OA病理生理中,MMPs主要参与胶原的降解,而ADAMTS则与聚集蛋白聚糖的流失密切相关,其中尤以ADAMTS-4和ADAMTS-5的表达量和分解效率最高[16]。
青风藤为防己科植物青藤及毛青藤的干燥藤茎,具有通络、止痛、祛风湿之功效,主治风湿及类风湿关节炎、关节肿大、肢体疼痛、麻木等[17]。现代药理研究表明,青藤碱是青风藤中主要活性生物碱,具有祛风镇痛、消炎、免疫抑制、降压及抗心律失常等作用[17]。课题组前期研究表明,青藤碱可抑制木瓜蛋白酶诱导的膝OA模型兔滑膜炎性反应,降低关节液中MMP-13的含量,对软骨具有保护作用[5]。本实验病理学观察显示,中、高剂量青藤碱干预后,软骨Mankins评分及滑膜评分均明显降低;ELISA检测发现,中、高剂量青藤碱可明显降低关节液IL-6、IL-7、ADAMTS-4和ADAMTS-5含量,而低剂量青藤碱上述作用并不明显,表明青藤碱抑制膝OA滑膜炎和保护关节软骨的作用与剂量密切相关,其中以中、高剂量青藤碱作用更显著。
参考文献:
[1] SCANZELLO C R, GOLDRING S R. The role of synovitis in osteoarthritis pathogenesis[J]. Bone,2012,51(2):249-257.
[2] KRASNOKUTSKY S, BELISKAYA-LEVY I, BENCARDINO J, et al. Quantitative magnetic resonance imaging evidence of synovial proliferation is associated with radiographic severity of knee osteoarthritis[J]. Arthritis Rheum,2011,63(10):2983-2991.
[3] SCANZELLO C, PLAAS A, CROW M. Innate immune system activation in osteoarthritis:is osteoarthritis a chronic wound[J]. Curr Opin Rheumatol,2008,20(5):565-572.
[4] ROEMER F, GUERMAZI A, FELSON D, et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up:the MOST study[J]. Ann Rheum Dis,2011,70(10):1804-1809.
[5] 郑洁,王瑞辉,寇久社.青藤碱关节腔注射对膝骨关节炎兔软骨和滑膜组织形态学及基质金属蛋白酶-13和软骨寡聚基质蛋白的影响[J].中国中医药信息杂志,2016,23(1):74-77.
[6] 熊元,赵振国,李传郡,等.兔膝骨关节炎模型的制备及鉴定[J].实验动物科学,2013,30(3):31-34,63.
[7] MANKIN H J, DORFMAN H, LIPPIELLO L, et al. Biochemical and metabolic abnormalities in articular cartilage from osteoarthritic human hips Ⅱ. Correlation of morphology with biochemical and metabolic data[J]. Bone Joint Surg,1971,53(3):523- 531.
[8] PRITZKER K P, GAY S, JIMENEZ S A, et al. Osteoarthritis cartilage histopathology:grading and staging[J]. Osteoarthritis Cartilage, 2006,14(1):13-29.
[9] GOLDRING M B. Articular cartilage degradation in osteoarthritis[J]. HSS Journal,2012,8(1):7-9.
[10] KLEIN T, BISCHOFF R. Active metalloproteases of the A Disintegrin and Metalloprotease (ADAM) family:biological function and structure[J]. J Proteome Res,2011,10(1):17-33.
[11] AKESON G, MALEMUD C J. A role for soluble IL-6 receptor in osteoarthritis[J]. J Funct Morphol Kinesiol,2017,2(3):27.
[12] KOSHY P J, HENDERSON N, LOGAN C, et al. Interleukin17 induces cartilage collagen breakdown:novel synergistic effects incombination with proinflammatory cytokines[J]. Annals of the Rheumatic Diseases,2002,61(8):704-713.
[13] LIU Y S, PENG H, MENG Z, et al. Correlation of IL-17 level in synovia and severity of knee osteoarthritis[J]. Med Sci Monit, 2015,21:1732-1736.
[14] KIM Y G, PARK J W, LEE J M, et al. IL-17 inhibits osteoblast differentiation and bone regeneration in rat[J]. Archives of oral biology,2014,59(9):897-905.
[15] KOTAKE S, UDAGAWA N, TAKAHASHI N, et al. IL-17 in synovial fluids from patients with rheumatoid arthritis is a potent stimulator of osteoclastogenesis[J]. The Journal of Clinical Investigation,1999,103(9):1345-1352.
[16] MORT J S , GENG Y Q, FISHER W D, et al. Aggrecan heterogeneity in articular cartilage from patients with osteoarthritis[J]. BMC Musculoskeletal Disorders,2016,17:89.
[17] 曹吉慧,趙桂森,冯延江.青风藤的化学成分与药理作用[J].国外医药:植物药分册,2008,23(2):62-66.

