宫颈癌细胞通过下调miR-301b表达促进基因组DNA损伤修复
杨 磊,穆 红,谢莉丽
(天津市第一中心医院检验科,天津 300192)
细胞的生存与基因组的完整性紧密相关,应用离子射线、氧化剂以及基因组毒性药物破坏细胞基因组DNA是杀伤肿瘤细胞的重要手段。然而,这些外界刺激会激活细胞内特异的信号通路启动DNA损伤修复反应清除外源刺激物在基因组上造成的损伤,使肿瘤细胞对治疗方法产生抵抗力[1-2]。微小RNA(MiRNA)是一种长度约20个核苷酸组成的小片段RNA分子,基于种子序列与靶基因mRNA非编码区的特异性结合,在Ago蛋白复合物加工元件的作用下,实现靶基因mRNA的快速降解以及蛋白的翻译阻滞,降低靶基因在细胞内的水平,进而影响细胞表型[3-4]。近期报道显示,microRNA分子通过调控靶基因的表达参与了细胞中基因组DNA的损伤修复过程。E3泛素化蛋白连接酶(Ndfip1)和蛋白磷酸酶调控亚基B′α(PPP2R5A)具有修复DNA、维持DNA稳定性的功能,在神经胶质瘤细胞中过表达miR-388-5p可以干扰上述2种蛋白分子的表达,进而干扰细胞修复DNA损伤[5]。在前列腺癌细胞中,miR-890和miR-744-3p分别通过抑制有丝分裂静息蛋白缺陷2样蛋白2(MAD2L2)和Rad23核剪切修复蛋白同源物B(Rad23B)阻碍离子辐射诱导性DNA损伤修复过程[6]。MiR-301b基因位点位于人类第22条染色短臂1区2带,该基因首先转录加工成长度为78 bp的发卡状前体RNA分子,进一步加工后形成成熟体非编码RNAmiR-301b。MiR-301b在细胞增殖、侵袭以及凋亡等细胞生命活动中都发挥着重要作用[7-9]。C末端结合蛋白作用蛋白(Ctip)基因位点位于人类第18条染色体短臂1区2带,其表达产物是一种内源性核酸内切酶,可以特异性识别和结合分叉DNA分子的5′端折叠结构,与Mre11双链断裂修复核酶、Rad50重组酶和Nbs11烟草花叶病毒抗性N样蛋白结合后以同源重组(HR)的形式修复损伤DNA分子[10-11]。新辅助化疗联合放射治疗是目前治疗宫颈癌的常用手段,在治疗中,化学药物通过诱导DNA损伤、抑制细胞分裂增殖、促进细胞凋亡的方式杀伤癌细胞。但细胞中存在参与DNA修复的生物分子,这些分子阻碍了化学药物对细胞的杀伤作用[12]。因此,揭示宫颈癌细胞中DNA修复机制,可以为探索干扰DNA损伤修复的方法奠定基础,最终为克服宫颈癌细胞耐药性及疾病治疗提供帮助。在本项研究中,笔者探讨了miR-301b与Ctip基因表达的作用关系及其机制、以及这种作用关系对基因组DNA损伤修复过程的影响,并以此为基础提出了宫颈癌细胞修复DNA损伤的机制。
1 材料与方法
1.1材料 宫颈癌细胞株Siha购自于中国科学院典型培养物保藏委员会细胞库。
1.2仪器与试剂
1.2.1仪器 EnSpire Mutilabel Reader酶标仪,芬兰PerkinElmer公司;Alpha Innotech FluroChem FC2凝胶成像分析系统,美国Alpha Innotech公司;LightCycle96 荧光定量PCR仪,瑞士Roche 公司;BD Accuri C6 Plus流式细胞仪,美国BD Sciences公司。
1.2.2试剂 miR-301b模拟物、miR-301b抑制物以及阴性对照核酸N.C.和抑制物N.C.由苏州吉玛基因股份有限公司合成;质粒构建、实时定量聚合酶链反应实验中用到逆转录、实时定量聚合酶链反应(PCR)扩增引物均由北京天润奥科生物科技有限公司合成;RNA/DNA X-fect转染试剂、PrimeScriptTM逆转录酶以及SYBR Premix Ex Taq Ⅱ荧光定量PCR试剂盒购自日本 Takara生物技术有限公司;兔抗人Ctip、 GADPH抗体以及HRP标记羊抗兔IgG Fc抗体购自美国Proteintech公司;鼠抗人γ-H2AX蛋白抗体及Alexa Fluor®488 dye 标记兔抗鼠抗体购自美国 Abcam有限公司;mirVana RNA提取试剂盒来源于美国Ambion公司;Annexin-V 凋亡检测试剂盒来源于美国BD Sciences公司。
1.3方法
1.3.1质粒构建 本项目构建的质粒包括靶基因过表达质粒pcDNA3.1/Ctip;荧光报告质粒pcDNA3.1/EGFP-Ctip-wtUTR和pcDNA3.1/EGFP-Ctip-mutUTR。质粒构建时逆转录条件:42 ℃,1 h,70℃,15 min;PCR扩增条件:94 ℃,2 min; 94 ℃,30 s、57 ℃,30 s、72 ℃,3 min,32个循环;72 ℃,10 min;UTR核酸模拟物退火条件:100 ℃,5 min,水浴缓慢降至37 ℃。寡核苷酸引物序列请见表1。

表1 实验中用到的寡核苷酸片段
注:5′,3′分别代表核酸片段的5′和3′末端
1.3.2细胞培养及转染 将细胞在含有10%胎牛血清、1%青霉素-链霉素双抗的1640细胞培养液,于37 ℃,5% CO2的细胞培养箱中培养,将细胞以约5×104个/毫升的密度种于培养板,待细胞贴壁后,用RNA/DNA X-fectTM转染试剂将寡核苷酸miR-301b模拟物、miR-301b抑制物、N.C.、抑制物N.C.、以及质粒pcDNA3.1/Ctip、pcDNA3.1/EGFP-Ctip-wtUTR和pcDNA3.1/EGFP-Ctip-mutUTR转染至细胞。
1.3.3细胞药物刺激 将TNF-α粉末溶解于磷酸缓冲液(PBS)中制备成200 μg/mL的药物原液,置于-80 ℃条件下储存。用时取一定体积的药物原液加入至细胞培养液,稀释成100 ng/mL的工作液刺激细胞1.5、3和6 h。
1.3.4实时定量聚合酶链式(PCR)反应 对目标基因miR-301b、Ctip mRNA以及内参基因U6小RNA、β-actin mRNA的进行荧光半定量,反应条件:95 ℃预变性3 min,95 ℃ 10 s、60 ℃ 15 s、72 ℃ 15 s,扩增35个循环后进行熔解曲线分析并应用2-ΔΔCt方法,按公式:Folds=2-ΔΔCt,ΔΔCt=(Ct1-Ct2)-(Ct3-Ct4),其中Ct1为处理样品中待测基因(miR-301b和Ctip)的临界循环数,Ct2为处理样品中待测基因对应的内参基因(U6和β-actin)的临界循环数,Ct3为对照样品中待测基因的临界循环数,Ct4为对照样品中待测基因对应的内参基因的临界循环数,计算出每组细胞中目标基因的相对表达水平。寡核苷酸引物序列请见表2。
1.3.5Western-blot蛋白印迹实验 对目的Ctip蛋白及其内参蛋白GADPH进行电泳分离、抗体标记及化学显影步骤。实验条件:上样量,25 μg每孔;转膜电流及时间,260 mA、2 h;抗体加入量,1∶500(1抗)、1∶2 000(2抗);抗体孵育时间,1 h(1抗)、2 h(2抗)。影像捕捉后,根据目的样本灰度值(目的蛋白条带亮度-背景值)与对应内参蛋白灰度值(内参看白GADPH条带亮度-背景值)的比值,得到目的蛋白的相对表达量。
1.3.6γ-H2AX免疫荧光实验 灭活固定细胞后,用磷酸化H2AX蛋白抗体标记细胞内的靶蛋白、流式细胞术检测靶蛋白荧光强度。实验条件:1%甲醛细胞灭活15 min;70%乙醇细胞固定3 h;抗体加入量,1∶100(1抗)、1∶100(2抗);抗体孵育时间,2 h(1抗)、30 min(2抗);流式细胞采集量,10 000个。在研究中,依据药物处理条件、转染寡核酸、质粒种类不同,每个实验组都对应着各自对照组。对应关系如下:磷酸盐缓冲液对照组与TNF-α处理实验组;N.C.转染对照组与miR-301b模拟物转染实验组;抑制物N.C.转染对照组与抑制物转染实验组;pcDNA3.1与miR-301b模拟物共转染对照组与pcDNA3.1/Ctip与miR-301b模拟物共转染实验组。实验组和对照组细胞经抗体标记后,可以直接在流式细胞术平台上进行检测,上样检测后,各组细胞群的γ-H2AX蛋白的平均荧光强度会显示在平台上,每组细胞各做3个平行样。
1.3.7彗星实验 将400 mL含有8 000个细胞的磷酸盐缓冲液与1.2 mL 1%的低熔点琼脂糖凝胶混合,平铺在载玻片上。胶凝固后,将载玻片置于裂解液(2%肌氨酰,0.5 mol/L乙二胺四乙酸二钠,0.5 mg/mL蛋白酶K)中37 ℃孵育过夜。用电泳液(90 mmol/L三羟基氨基甲烷,90 mmol/L硼酸,2 mmol/L乙二胺四乙酸二钠)浸洗载玻片3次,每次20 min。浸洗后,在电压为14 V的条件下,电泳25 min。用浓度为2.5 μg/mL的溴化乙锭水溶液浸泡载玻片20 min。染色后,用400 mL去离子水浸洗载玻片20 min。然后在荧光显微镜下进行观察和拍照。利用彗星实验成像工程软件(CASP)计算DNA尾距,每个实验组计算50个DNA尾距。

表2 实时定量聚合酶链式反应用到的引物序列
注:5′、3′分别代表核酸片段的5′和3′末端
1.4统计学处理 采用SPSS 16.0软件对数据进行统计学分析,计数资料以百分数或率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1宫颈癌Siha细胞修复基因组DNA损伤的分析 用TNF-α试剂(处理组)和等体积的磷酸盐缓冲液(对照组)作用Siha细胞后,测定各组细胞内γ-H2AX表达的平均水平以及DNA彗星状平均尾距,监测胞内DNA损伤程度。与对照组细胞相比,TNF-α处理组细胞经药物刺激1.5和3 h后,胞内γ-H2AX蛋白平均表达水平分别上升了0.26和0.48倍,同时平均尾距增加了0.58和0.96倍(P<0.05),而药物刺激细胞6 h后,TNF-α处理组细胞中的γ-H2AX蛋白平均表达水平以及平均尾距与对照组相比无明显差异(图1A和B)。
2.2miR-301b模拟物、miR-301b抑制物对宫颈癌细胞中Ctip基因表达的影响 应用PCR实验分别检测TNF-α处理组和对照组细胞中miR-301b、Ctip mRNA相对表达水平。在药物刺激1.5和3 h后,与对照组相比,TNF-α处理组细胞中miR-301b表达水平分别下降了25.33%和38.63%(P<0.05)(图2),同时Ctip mRNA的水平分别上升了0.19和0.37倍(P<0.05)(图3)。分别转染miR-301b模拟物(miR-301b模拟物组)、miR-301b阴性对照核酸N.C.(N.C.组)、miR-301b抑制物 (抑制物组)以及抑制物对照核酸抑制物N.C.(抑制物N.C.组)至细胞,应用PCR和Western-blot实验检测各组细胞中Ctip mRNA和蛋白表达水平。与N.C.组细胞相比,miR-301b组细胞中Ctip mRNA和蛋白表达水平分别下降44.60%和30.53%(P<0.05);与抑制物N.C.组细胞相比,抑制物组细胞中Ctip mRNA和蛋白水平分别上升0.34和0.27倍(P<0.05)(图4)。TargetScanHuman、miRBD、DIANA TOOL以及Pictar 4种生物信息学软件预测结果显示,Ctip mRNA上3208至3214核苷酸位点的核酸序列与miR-301b的2到8核苷酸位点的种子序列反向互补,是miR-301b潜在的靶定位点(图5);荧光报告实验结果显示,与N.C.组细胞相比,嵌合有野生型Ctip mRNA3′UTR的报告载体(pcDNA3.1/EGFP-Ctip -wtUTR)上的绿色荧光蛋白报告基因在miR-301b模拟物组细胞中的表达水平下降19.53%(P<0.05);与抑制物N.C.组细胞相比,报告基因在抑制物组细胞中的表达水平上升0.15倍(P<0.05);然而嵌有突变型3′UTR载体(pcDNA3.1/EGFP-Ctip-mutUTR)上的报告基因表达水平在上述各组细胞中的表达水平无明显差异(图6)。
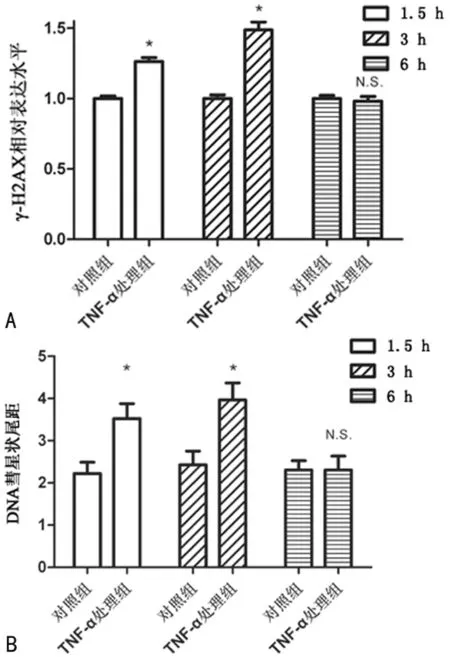
注:A为TNF-α刺激对γ-H2AX蛋白水平的影响;B为TNF-α刺激对DNA彗星状尾距的影响
图1TNF-α刺激对γ-H2AX蛋白水平和DNA彗星状尾距的影响
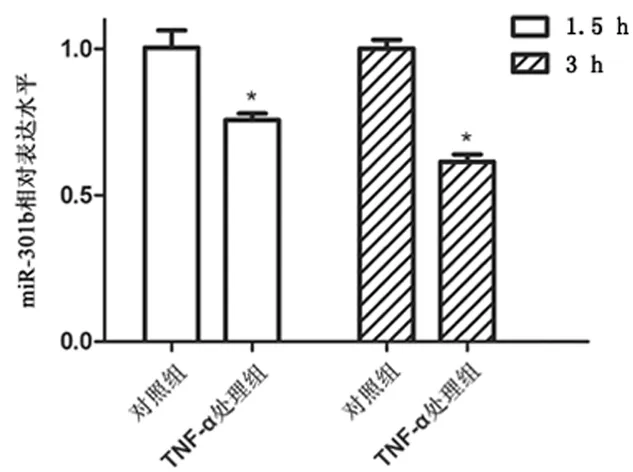
图2 TNF-α刺激对miR-301b表达水平的影响
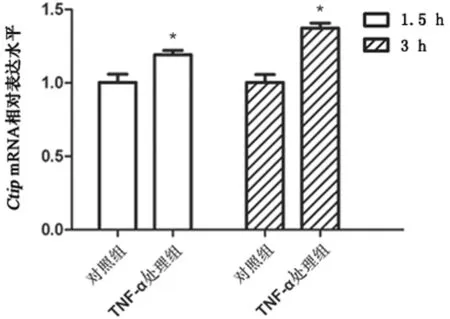
图3 TNF-α刺激对Ctip mRNA表达水平的影响
2.3miR-301b对宫颈癌细胞修复DNA损伤的影响 分别向细胞转染miR-301b模拟物、miR-301b抑制物以及它们各自的阴性对照核酸N.C和抑制物N.C.后,测定各组细胞内γ-H2AX蛋白平均表达水平和DNA彗星状平均尾距。TNF-α刺激细胞6 h后,与N.C.组细胞相比,miR-301b模拟物组细胞中γ-H2AX平均表达水平和平均尾距分别上升0.78倍和0.42倍(P<0.05);刺激细胞3 h后,与抑制物N.C.组细胞相比,抑制物组细胞中γ-H2AX蛋白平均表达水平和平均尾距分别下降22.13%和26.09%(P<0.05)(图7A和B)。

图4 转染miR-301b模拟物、抑制物对Ctip

图5 miR-301b与Ctip mRNA 3′UTR及其突变体
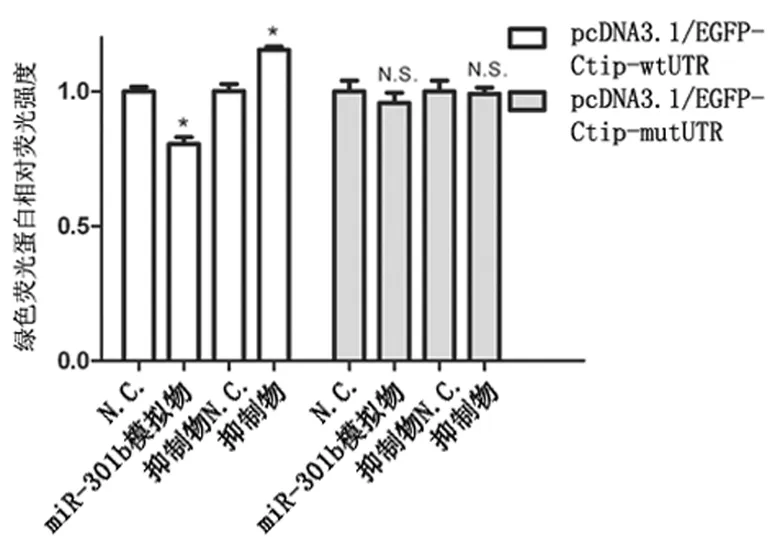
图6 miR-301b与Ctip mRNA 3′UTR及其突变体
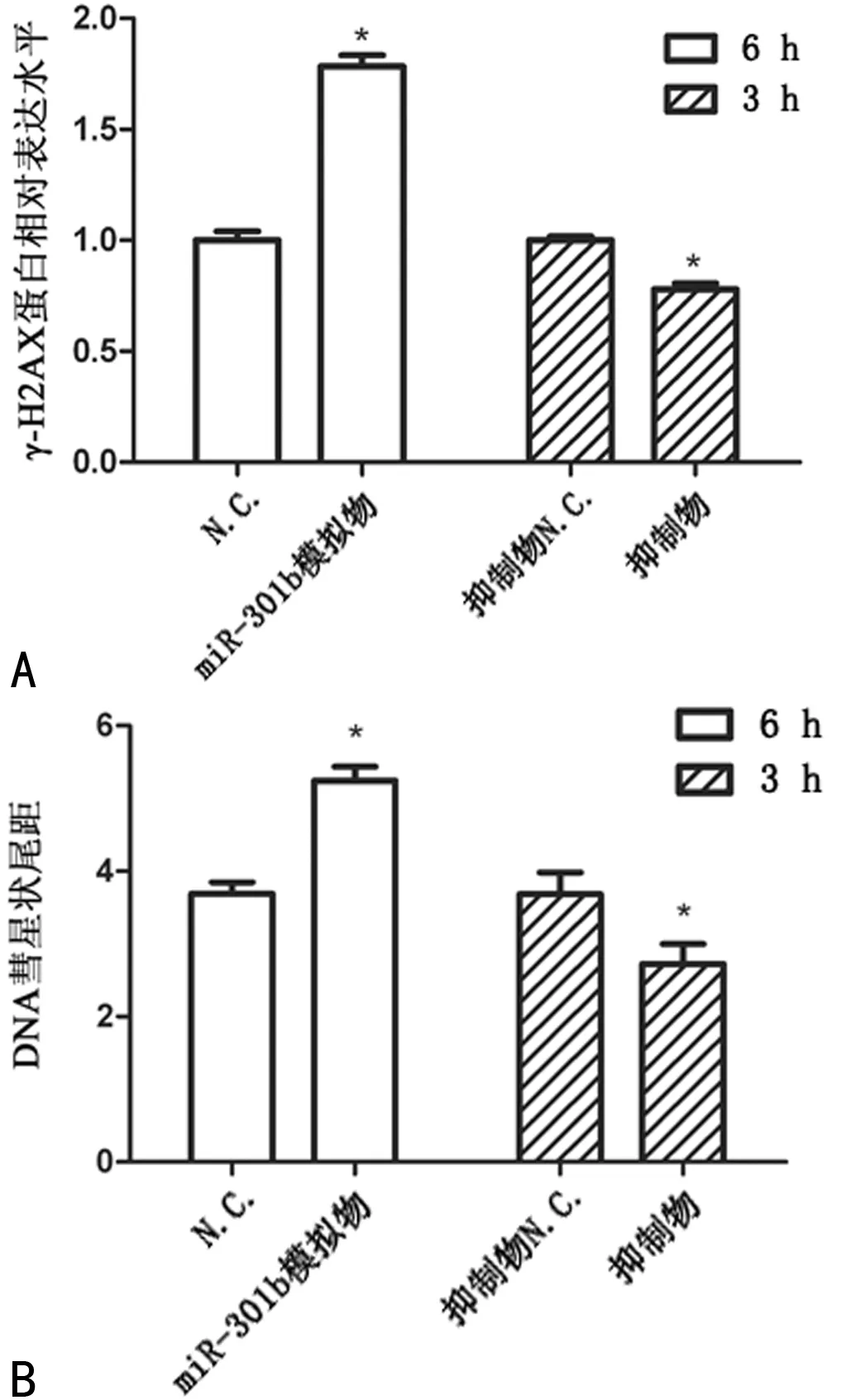
注:A为转染miR-301b模拟物、抑制物对γ-H2AX蛋白表达水平的影响;B为转染miR-301b模拟物、抑制物对DNA彗星状尾距的影响
图7转染miR-301b模拟物、抑制物对γ-H2AX蛋白表达水平和DNA彗星状尾距的影响
2.4Ctip基因表达对miR-301b干扰宫颈癌细胞修复DNA损伤的影响 分别将pcDNA3.1/Ctip或其对照载体pcDNA3.1与miR-301b模拟物共转染至靶细胞,测定各组细胞内γ-H2AX蛋白平均表达水平和DNA彗星状平均尾距。TNF-α刺激细胞1.5和3 h后,与共转染miR-301b模拟物和pcDNA3.1的细胞相比,共转染miR-301b模拟物和pcDNA3.1/Ctip质粒的细胞中γ-H2AX蛋白平均表达水平分别下降39.02%和44.35%,与此同时,平均尾距分别下降33.60%和38.12%(P<0.05)(图8A和B)。

注:A为过表达Ctip基因对miR-301b模拟物转染组细胞中γ-H2AX蛋白表达水平的影响;B为过表达Ctip基因对miR-301b模拟物转染组细胞中彗星状DNA尾距的影响
图8过表达Ctip基因对miR-301b模拟物转染组细胞中γ-H2AX蛋白表达水平和彗星状DNA尾距的影响
3 讨 论
TNF-α是一种相对分子质量为26×103的跨膜蛋白,经金属转换酶的作用后,可由跨膜型蛋白转换为可溶性型细胞因子,在不同的炎症反应中发挥重要作用[13]。TNF-α处理细胞后,会使细胞线粒体内产生大量胞内活性氧中间分子(ROI),这些分子经金属离子催化后能形成具有强氧化活性的羟基自由基,产生的这些自由基可以通过氧化反应氧化DNA分子中核苷酸,造成DNA损伤[14-15]。文献记录显示,用浓度为1、10和100 ng/mL的TNF-α试剂处理淋巴细胞1 h后,细胞内DNA损伤标志物的水平即可出现显著升高,而药物处理4 h后,损伤标志物水平出现下降。在药物处理24 h后,浓度为1、10 ng/mL TNF-α试剂造成标志物水平升高的现象消失,100 ng/mL TNF-α试剂造成标志物水平升高的现象仍存在。这些文献中报道的数据说明2个问题:(1)TNF-α处理细胞后能够诱发DNA损伤修复反应;(2)100 ng/mL TNF-α试剂对细胞DNA损伤作用更持久[16]。目前还没有利用TNF-α试剂诱导宫颈癌细胞DNA损伤修复反应的文献记录,因此,本研究依据现有文献报道,将TNF-α试剂浓度设定为100 ng/mL,分别在药物处理后,1.5、3 h 2个时间点观察DNA损伤标志物的水平确定TNF-α能否造成宫颈癌细胞中DNA的损伤,6、24 h 2个时间点观察损伤标志物的水平确定TNF-α诱导性DNA损伤可否被宫颈癌细胞修复。本研究的实验结果显示,与对照组细胞相比,用TNF-α刺激Siha细胞1.5和3 h后,细胞中的DNA损伤标记物γ-H2AX蛋白的平均表达水平以及DNA彗星状平均尾距均出现明显升高,然而当TNF-α刺激时间延长至6 h,γ-H2AX蛋白平均表达水平及DNA平均尾距却未出现显著差异。这说明TNF-α可以造成Siha细胞内基因组DNA的损伤,但该损伤在6 h内就可以被细胞完全修复。TNF-α刺激造成了miR-301b的上升和Ctip mRNA水平的下降。为探索miR-301b和Ctip mRNA表达水平变化之间有无关联,笔者利用转染技术,对TNF-α处理细胞进行了信号通路干预。与相应对照核酸相比,转染miR-301b模拟物会导致Ctip mRNA和蛋白水平的降低,而转染miR-301b抑制物会使Ctip mRNA和蛋白水平升高。该结果说明,miR-301b可能影响Ctip基因表达。生物信息学分析预测出了Ctip mRNA 3′UTR上miR-301b的靶定位点。与相应对照组细胞相比,pcDNA3.1/EGFP-Ctip-wtUTR载体上报告基因的表达强度在miR-301b模拟物组细胞中显著降低、在抑制物组细胞中明显升高;而pcDNA3.1/EGFP-Ctip-mutUTR载体上报告基因表达强度在上述两组细胞中无显著变化。 这些说明,miR-301b是通过直接结合Ctip mRNA 3′UTR上预测出的靶定位点来抑制Ctip基因表达的。TNF-α作用后,细胞内miR-301b、Ctip mRNA表达水平的变化说明这两种分子可能参与了基因组DNA的损伤修复过程。此外,该基因产物还可以通过微同源介导末端连接的方式(MMEJ)完成损伤DNA分子的修复[17]。因此,miR-301b对Ctip基因表达的调控可能会影响细胞中DNA损伤修复过程。与相应对照组细胞相比,miR-301b模拟物组细胞中γ-H2AX蛋白平均表达水平以及DNA彗星状平均尾距的上升以及抑制物组细胞中γ-H2AX蛋白平均表达水平和平均尾距的下降说明miR-301b会干扰DNA的损伤修复。而与转染pcDNA3.1的细胞相比, pcDNA3.1/Ctip质粒与miR-301b模拟物共转染导致细胞内γ-H2AX蛋白平均表达水平下降则说明miR-301b可通过抑制Ctip基因表达干扰DNA的损伤修复。
4 结 论
宫颈癌Siha细胞通过下调miR-301b增强Ctip基因表达促进基因组DNA的损伤修复。

