电针调控SIRT1/FoxO1对肥胖大鼠胰岛素敏感性及脂联素的影响❋
杨亚南,舒 晴,陈 丽,周焕娇,梁凤霞△
(1.华润武钢总医院中医科,武汉 430081; 2. 武汉大学中南医院康复医学科,武汉 430071; 3. 湖北中医药大学针灸骨伤学院,武汉 430061)
胰岛素抵抗(insulin resistance, IR)是指胰岛素的效应器官(如肝脏、骨骼肌、脂肪组织、血管内皮细胞及动脉平滑肌细胞等)对正常剂量的胰岛素产生低于正常生物学效应的一种病理生理状态[1]。胰岛素抵抗在男性和女性肥胖人群中的发生率分别约为64.9%和73.2%[2],且在腹型肥胖人群中的发病率较高[3],因此肥胖是发生2型糖尿病和胰岛素抵抗的重要危险因素之一[4]。脂联素(Adiponectin)是白色脂肪组织分泌的一种重要脂肪因子,具有促进脂肪酸氧化、抑制糖异生、增加胰岛素敏感性、抑制慢性炎症的作用,是与胰岛素抵抗关系最紧密的一个特异性因子。大量研究显示,肥胖个体脂肪组织分泌的脂联素减少,而血清脂联素水平与胰岛素抵抗指数呈显著负相关[5-6]。脂联素的基因表达受到多种转录因子的调控,叉头状转录因子1(forkhead box transcription factor 1, FoxO1)作为调节能量代谢的重要转录因子之一,参与脂联素基因转录水平的调控,而该复合物的激活则依赖于去乙酰化酶沉默信息调节因子1(silent mating type information regulation 2 homolog 1, SIRT1)的活性[7]。中医针灸作为一种绿色治疗方案,已越来越多地在临床上应用于肥胖和胰岛素抵抗的治疗。前期研究显示,电针能够通过调控下丘脑中SIRT1/FoxO1信号通路,发挥抑制食欲、改善肥胖和胰岛素抵抗的作用[8]。本实验以脂联素的基因调控为切入点,观察电针通过调控白色脂肪组织SIRT1/FoxO1发挥改善肥胖胰岛素抵抗的作用,现报道如下。
1 材料与方法
1.1 动物造模与分组
40只SPF级Wistar雄性大鼠均由湖北省实验动物中心提供(许可证号42000600013006),适应性喂养1周。其中10只大鼠给予普通饲料总热能(3.8kcal/g,含70%碳水化合物,20%蛋白质,10%脂肪)喂养8周,直接纳入正常组。另外30只大鼠给予高脂饲料(5.4kcal/g,38.5% 碳水化合物, 15% 蛋白质, 46.5% 脂肪)喂养8周[9]。以高脂喂养大鼠体质量高于普通饲料喂养大鼠体质量平均值的20%以上作为肥胖标准[10]。最终有26只大鼠符合肥胖模型标准,随机挑选20只分为模型组和电针组各10只。大鼠喂养及干预期间自由进食饮水,12 h明暗周期,动物房温度(22±2) ℃,相对温度(50±10)%。每天更换垫料、饮水、清洗大鼠饮水器。动物处理及饲养条件遵照动物福利的相关规定及《中华人民共和国实验动物管理条例》和《实验动物质量管理办法》实施。
1.2 主要试剂与仪器
脂联素ELISA检测试剂盒(南京建成);胰岛素检测试剂盒(Elabscience);脂肪组织蛋白提取试剂盒(百奥莱博);SDS凝胶配制试剂盒(碧云天);BCA蛋白浓度测定试剂盒(碧云天);Anti-SIRT1抗体(ab110304, Abcam);Anti-FoxO1抗体(ab52857, Abcam);Anti- Adiponectin抗体(ab22554,Abcam);RNA提取试剂盒(Takara);RNA逆转录试剂盒(TOYOBO);SYBR© Green Realtime-PCR Master Mix(TOYOBO)。
一次性无菌针灸针(0.30×20 mm,苏州环球);韩氏电针仪(HANS LH202H);快速血糖仪(美国强生);酶标仪(BIO-RAD);Western电泳仪(BIO-RAD);半干转膜仪(BIO-RAD);凝胶扫描成像系统(BIO-RAD);核酸测定仪(德国IMPLEN);普通PCR仪(西安天隆);实时荧光定量PCR仪(BIO-RAD)。
1.3 干预方法
电针治疗取穴丰隆、中脘、关元、足三里。穴位定位、针刺方向、深度参考2003年1月出版的《实验动物学》及相关权威文献[11]。采用0.3×25 mm不锈钢毫针,进针后针柄连接HANS LH202H型电针治疗仪,参数设定为频率2 Hz,强度1 mA,连续波。同侧足三里和丰隆穴连接同一输出的2个电极,关元和中脘连接另一输出的2个电极,足三里和丰隆左右两侧交替使用。每日电针10 min,每周治疗3次,连续治疗8周。以上采取的电针参数均参考相关文献并进行前期预试验后决定[12]。
电针组大鼠在造模成功后继续采用高脂饲料喂养8周,同时接受电针治疗;正常组大鼠在普通饲料喂养8周后继续采用普通饲料喂养8周;模型组大鼠在造模成功后继续采用高脂饲料喂养8周,正常组和模型组大鼠在电针组进行治疗期间采用同样的方法进行抓取和固定。
1.4 指标检测
1.4.1 体质量、血糖、血清胰岛素、血清脂联素 用电子天平在治疗前后分别测量所有大鼠的体质量;用快速血糖仪在治疗前后分别采用尾尖取血的方式采集大鼠撤食12 h后空腹血糖及大鼠未撤食状态下上午8AM的餐后血糖。处死大鼠前用10%水合氯醛腹腔注射麻醉,采用心尖采血方法获取血清样本,严格按照试剂盒使用说明书操作,采用ELISA法检测大鼠血清中的胰岛素和脂联素水平。
1.4.2 腹腔糖耐量(IPGTT)、腹腔胰岛素耐量(IPITT) 在治疗7周后测量IPGTT:大鼠空腹12 h注射前测空腹血糖(0 min),随后根据大鼠体质量腹腔注射相应体积的50%葡萄糖(2 g/kg),分别在注射后30、60、90、120 min尾尖取血测血糖。IPITT:大鼠空腹8 h,注射前测空腹血糖(0 min),随后根据体质量腹腔注射相应体积的胰岛素生理盐水稀释液(0.5U/ml),给药剂量为1U/kg,分别在注射后30、60、90、120 min尾尖取血测血糖。采用近似梯形法计算曲线下面积(area under the curve, AUC)[13]。AUC (min · mg/dL)=30 min × [1/2 × (BG0 + BG120) + 1 × (BG30 + BG60 + BG90)]。
1.4.3 脂肪组织SIRT1、FoxO1、Adiponectin的蛋白表达水平 采用Western blotting(WB)法检测白色脂肪组织中的SIRT1、FoxO1、Adiponectin蛋白含量。具体方法:大鼠麻醉后快速断头处死,取新鲜白色脂肪组织放入液氮中速冻,再转至-80 ℃冰箱中保存备用。提取脂肪蛋白BCA法进行蛋白浓度检测,8%~10% SDS凝胶电泳中进行蛋白分离,半干转膜法转膜,5%脱脂牛奶封闭2 h,一抗4°过夜。第2天二抗孵育1 h,洗膜后在显影仪中成像。各组大鼠随机挑选3只进行WB蛋白定量。以目的蛋白条带的光密度值(IOD)与β-Actin的比值作为蛋白的相对表达量。
1.4.4 脂肪组织SIRT1、FoxO1、Adiponectin的基因表达水平 采用实时荧光定量PCR法检测脂肪组织SIRT1、FoxO1、Adiponectin的mRNA水平。取100 mg新鲜白色脂肪组织提取脂肪总RNA,每组取2 μL进行核酸浓度检测,以RNA纯度(OD260/OD280)在1.9~2.2为可用,浓度以0.1~0.9 μg/μL为宜。配制逆转录体系获取cDNA,保存于-20 ℃。配制荧光定量扩增体系,每个样本3个副孔,以β-Actin作为对照,检测目的基因SIRT1、FoxO1、Adiponectin的相对表达水平,引物自主设计、生物公司合成,序列如下。

表1 PCR引物序列
1.5 统计学方法

2 结果
2.1 各组大鼠干预前后体质量、血糖、胰岛素敏感性比较
图1显示,在治疗前肥胖模型大鼠体质量显著高于正常组(P<0.01),电针组与模型组比较差异无统计学意义(P>0.05)。治疗8周后,各组大鼠的体质量均较治疗前上升(P<0.01),模型组大鼠体质量的上升幅度显著高于电针组(P<0.01)。图1显示,各组大鼠治疗前后的空腹血糖比较差异无统计学意义(P>0.05),且在正常范围内;治疗前各组大鼠的餐后血糖亦在正常范围内,但电针组的餐后血糖显著低于模型组(P<0.05),与正常组比较差异无统计学意义(P>0.05)。
图1显示,腹腔注射50%葡萄糖后,各组大鼠的的血糖迅速升高。注射后30 min后,模型组大鼠的血糖值显著高于正常组和电针组(P<0.05),正常组与电针组血糖比较差异无统计学意义(P>0.05);注射60~120 min后,各组血糖未见明显差异(P>0.05)。计算各组血糖AUC,正常组AUC低于模型组(P<0.01),与电针组比较差异无统计学意义(P>0.05),电针组AUC低于模型组(P<0.05)。腹腔注射胰岛素后,各组大鼠的血糖在60 min内出现下降,随后血糖值上升,模型组血糖水平下降幅度低于正常组和电针组(P<0.05);注射胰岛素120 min后,模型组血糖回升至注射前水平,正常组和模型组仍保持在较低的血糖水平,且与模型组比较差异有统计学意义(P<0.05)。计算3组血糖AUC,模型组显著高于正常组和电针组(P<0.05),正常组与电针组之间比较差异无统计学意义(P>0.05)。
2.2 各组大鼠血清胰岛素、脂联素水平比较
如图1D所示,与正常组比较,模型组和电针组的大鼠血清胰岛素水平显著升高(P<0.01),而脂联素水平出现明显下降(P<0.01),说明肥胖大鼠的脂联素水平与胰岛素水平呈一定的负相关;与模型组比较,电针干预后大鼠的血清胰岛素水平出现明显下降(P<0.01),脂联素水平明显上升(P<0.01)。
2.3 各组大鼠白色脂肪组织SIRT1、FoxO1、Adiponectin的蛋白表达水平比较
图1E/F显示,各组大鼠白色脂肪组织SIRT1、FoxO1、Adiponectin的蛋白电泳条带。普通饲料喂养的大鼠白色脂肪组织中的SIRT1蛋白表达水平显著高于模型组和电针组中的肥胖大鼠(P<0.01),而电针治疗后SIRT1的蛋白表达水平显著高于模型组(P<0.01);正常组大鼠白色脂肪组织中的FoxO1蛋白表达显著高于肥胖大鼠(P<0.01),电针组蛋白表达量平均值虽高于模型组,但差异无统计学意义(P>0.05),可能与样本量有关;正常组大鼠白色脂肪组织中的脂联素蛋白表达高于模型组和电针组(P<0.01),电针组高于模型组(P<0.01)。
2.4 各组大鼠白色脂肪组织SIRT1、FoxO1、Adiponectin的基因表达水平比较
图1G显示,各组大鼠白色脂肪组织中SIRT1、FoxO1、Adiponectin的相对mRNA水平。正常组大鼠的SIRT1、FoxO1的基因表达水平显著高于模型组和电针组(P<0.01),模型组与电针组组间比较差异无统计学意义(P>0.05)。与正常组比较,模型组和电针组脂联素基因表达水平出现下调(P<0.01);与模型组比较,电针组的基因表达水平出现上调(P<0.01)。
3 讨论
肥胖时脂肪组织会产生过多的非酯化脂肪酸、脂肪因子(瘦素、脂联素、抵抗素等)、促炎症因子,其通过促进慢性炎症、上调氧化应激等多个途径介导胰岛素抵抗的发生,是胰岛素抵抗发病机制中的关键因素[14]。因此,在肥胖的早期进行干预对于改善胰岛素抵抗,并预防其发展为2型糖尿病具有重要意义。近年来,针灸越来越广泛地被用于肥胖等胰岛素抵抗相关性疾病的防治中。系统评价显示,针灸治疗肥胖病安全有效,不仅可以调节肥胖患者的脂质代谢,还能够改善肥胖患者的胰岛素抵抗状态[15]。国内外学者展开了较深入的针灸治疗肥胖和胰岛素抵抗的机制研究。电针能够从控制进食、降低体质量、缓解炎症、抑制交感神经兴奋性、调节胰岛素信号通路、促进脂质代谢等多个环节影响和治疗肥胖与胰岛素抵抗[16]。
胰岛素抵抗肥胖属于现代医学概念,中医并无与其相对应的病名。临床上胰岛素抵抗肥胖与糖耐量异常具有一定的相似性,是介于健康与患病之间的一种亚健康状态。患者多表现为形体肥胖、倦怠懒言,或伴有脘腹胀满、口淡无味或黏腻,舌淡有齿痕、舌苔白腻或厚腻,故可将其归入“脾瘅”范畴。《素问·奇病论篇》曰:“此五气之溢也,名曰脾瘅……此肥美之所发也,此人必数食甘美而多肥也。肥者令人内热……转为消渴”,强调从过食肥甘导致的肥胖到脾瘅,再由脾瘅到消渴的发病过程及病机。脾主运化水湿,脾虚失健运,津液不布、水液不化,导致湿浊内困、痰浊内生,而本虚标实是脾瘅的发病特征。中医发病学理论认为,“正气存内,邪不可干”,强调人体正气在疾病发生中的重要作用,治则上注重鼓舞人体正气以扶正祛邪。针灸“标本配穴”,“标”即针对病邪选取“标穴”,局部选穴或随证选穴疏导经气以利导邪气排除;“本”是指以正气为本,选用“本穴”,即选取固护先天之气(元气)和后天之气(胃气)的穴位,以调动机体正气,增强机体抵抗病邪能力[17]。肥胖胰岛素抵抗中医病机以脾虚为本,湿盛为标,因此在治疗中亦需重视扶助正气,扶正以祛邪。故在治疗胰岛素抵抗时,常选取关元、足三里为“本穴”,以固护先天之肾气及后天脾胃之气,取中脘、丰隆为“标穴”以祛肥胖痰湿之邪。近年来,此4穴均被多次报道用于治疗肥胖及胰岛素抵抗,并取得较好的疗效,是临床治疗肥胖最为常用和有效的取穴[18],也是“标本配穴”理论体系在临床应用中的一大体现,同时也是针灸治未病学术思想在临床应用中的体现。
作为脂肪细胞分泌的一种对抗胰岛素抵抗的重要因子,脂联素能够通过激活腺苷酸活化蛋白激酶(amp-activated protein kinase, AMPK),刺激葡萄糖的利用和脂肪酸的氧化,进而清除血浆游离脂肪酸,改善肥胖导致的慢性炎症状态,增加胰岛素敏感性[19-20]。脂联素水平的增加能够抑制脂肪组织分泌TNF-α,抑制炎症反应,改善胰岛素敏感性[21]。脂联素还能够增加胰岛素受体酪氨酸激酶(receptor tyrosine kinase, RTKs)和 p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, p38 MAPKs)的活性,加速胰岛素受体底物1(insulin receptor substrate 1, IRS1)的酪氨酸磷酸化,从而促进葡萄糖的摄取,改善血糖[22]。最新研究发现,脂肪细胞中脂联素的基因表达受到环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB)、FoxO1等多种转录因子的调控,胰岛素受体介导FoxO1去磷酸化之后进入细胞核,能够抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)介导的脂联素基因表达[23];细胞核内的FoxO1与C/EBP形成复合后,能够与脂联素基因的启动子结合,进行促进其表达,SIRT1介导的去乙酰化能够激活FoxO1与C/EBP复合物,进而调控脂联素的基因表达[24]。
图2显示,在本实验结果中发现,肥胖大鼠血清脂联素水平明显低于正常大鼠,同时还伴随着明显的胰岛素抵抗。在接受8周的电针治疗后,肥胖大鼠的血清胰岛素水平出现下调,胰岛素敏感性明显改善,血清脂联素水平也较模型大鼠出现明显的降低。通过检测各组大鼠白色脂肪组织的蛋白表达发现,与正常大鼠比较,高脂诱导的肥胖大鼠白色脂肪组织中SIRT1、FoxO1、脂联素的蛋白表达明显下调,在接受电针治疗后SIRT1和脂联素的蛋白表达水平出现了明显上调,而FoxO1只出现了轻度的上调,但无统计学意义。通过检测白色脂肪组织中SIRT1、FoxO1、脂联素的基因表达水平,发现正常大鼠SIRT1、FoxO1、脂联素的基因表达水平仍明显高于肥胖大鼠,但电针并不能上调肥胖大鼠SIRT和FoxO1的基因表达,却能够上调脂联素的基因表达。综合以上结果说明,电针促进脂联素合成的主要靶点可能在SIRT1的转录后调控,电针可能通过上调SIRT1的蛋白表达水平,从而调节FoxO1-C/EBP复合物,进而影响下游脂联素的基因表达,最终达到促进白色脂肪组织合成脂联素、改善胰岛素抵抗的目的。但是本研究仍存在一些局限性,电针介导SIRT1蛋白表达的上调与FoxO1-C/EBP复合物激活存在何种联系需要在后期实验中进行深入研究。
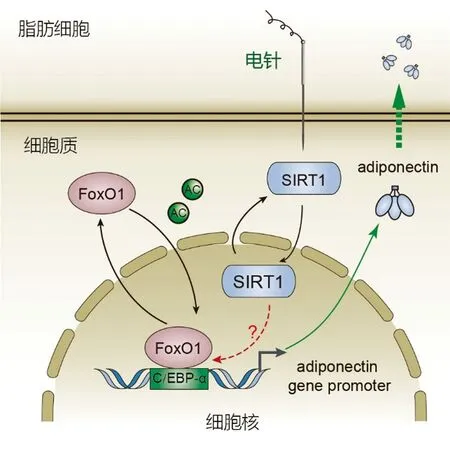
图2 电针调控白色脂肪组织脂联素基因表达的可能机制
综上所述,电针能够明显改善高脂饮食诱导的肥胖大鼠的胰岛素抵抗状态,其作用机制可能与电针调控白色脂肪组织中SIRT1/FoxO1通路进而影响脂联素的基因表达有关,为临床开展针灸防治肥胖与胰岛素抵抗提供客观的实验证据。

