HPLC法测定天山雪莲提取物固体脂质纳米粒载药量与包封率
刘桂花 刘宣麟 帕依曼?亥米提
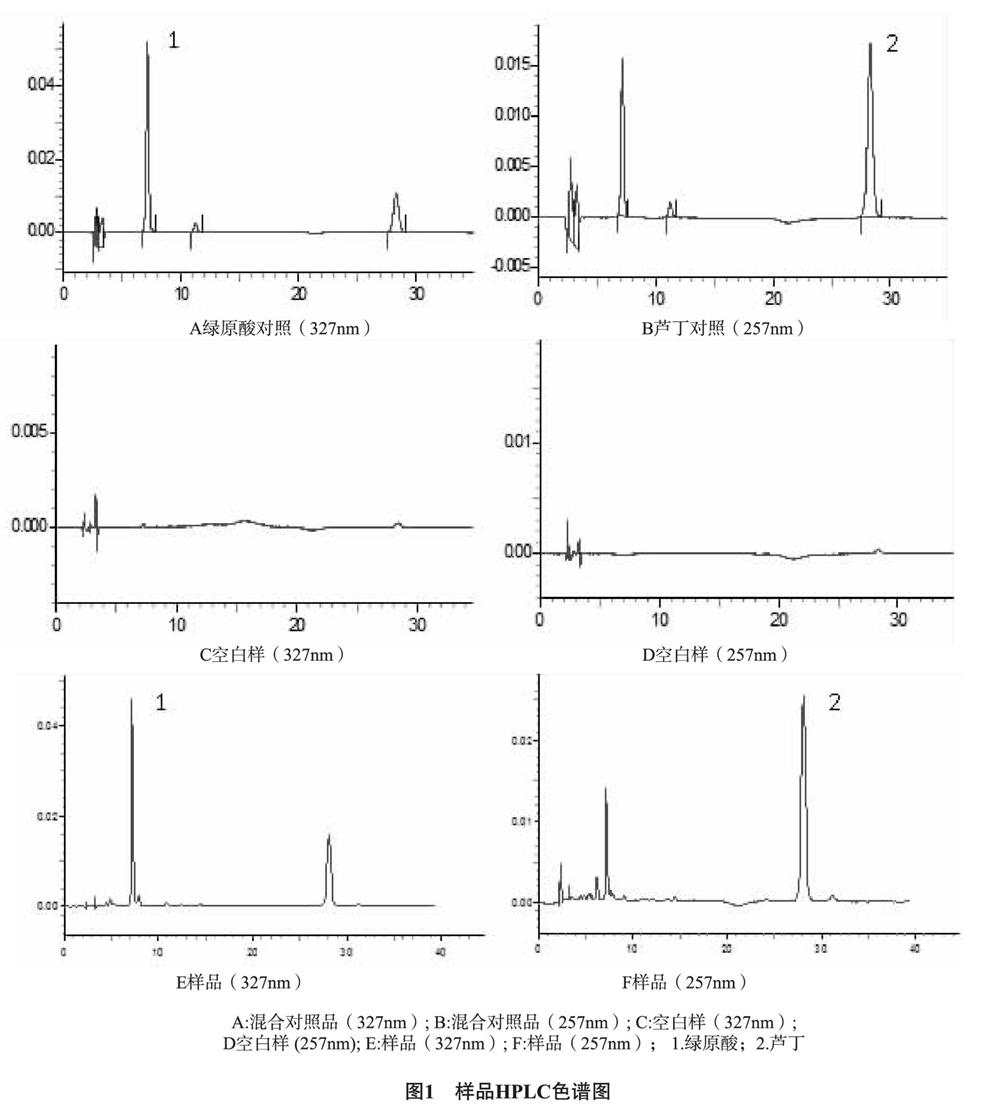

【摘 要】 目的:建立HPLC法同时测定天山雪莲提取物固体脂质纳米粒中绿原酸和芦丁的载药量和包封率的方法。方法:采用Shim-pack VP-ODS C18 (4.6mm×250mm,5μm);流动相:乙腈(A)-0.4%磷酸(B),梯度洗脱,体积流量1.0mL/min;检测波长分别为327nm、257nm,柱温35℃。采用超滤法分离天山雪莲提取物固体脂质纳米粒与游离药物测定包封率。结果:绿原酸和芦丁分离度良好,质量浓度分别在9.625~96.25μg/mL、12.87~128.7μg/mL范圍内与色谱峰面积均呈良好的线性关系,平均加样回收率分别为(98.5±0.12)% 和(99.40±0.21)%,精密度和稳定性较好。超滤法回收率分别为(99.31±0.97)%和(99.44±0.36)%。2种成分的重复性实验的RSD均小于2.0%。3批天山雪莲提取物固体脂质纳米粒中绿原酸和芦丁的包封率分别为(83.82±0.32)%和(87.78±0.80)%,载药量分别为(17.66±0.40)%和(20.14±0.33)%。结论:本法简单快速、结果准确可靠,可同时测定天山雪莲提取物固体脂质纳米粒中绿原酸和芦丁的载药量和包封率。
【关键词】 天山雪莲;固体脂质纳米粒;载药量;包封率
【中图分类号】R284.2 【文献标志码】 A【文章编号】1007-8517(2019)4-0029-05
Abstract:Objective To establish a method for simultaneous determination of drug loading and entrapment efficiency of chologenic acid and rutin from Saussureae Involucratae Herba extract(SIHE)- solid lipid nanoparticles(SLN). Methods The determination was carried out over Shim-pack VP-ODS column (250mm×4.6mm, 5μm) at the column temperature (35℃). The mobile phase consisted of acetonitrile (A)-0.4% ortho-phosphoric acid (B) solution with the gradient elution, the flow rate was 1.0 mL·min-1 and detection wavelength was set at 327 nm and 257 nm. The free drugs in Saussureae Involucratae Herba extract(SIHE)- solid lipid nanoparticles(SLN) were separated by ultrafiltration. Results Chologenic acid and rutin had a good linear relation within the concentration ranges from 9.625~96.25μg/mL,12.87~128.7μg/mL. The average recoveries were (98.5±0.12)% and(99.40±0.21)%.Results of stability and precision were good.The average recoveries of ultrafiltration were (99.31±0.97)% and(99.44±0.36)%, respectively and the RSD values of reproducibility tests for the two analytes were less than 2.0%. The entrapment efficiency and drug loading in SIHE-SLN were (83.82±0.32)% and (17.66±0.40)% for chologenic acid, (87.78±0.80)% and (20.14±0.33)% for rutin. Conclusion The method is accurate, simple, sensitive and applicable for determination of drug loading and entrapment efficiency of SIHE-SLN.
Keywords:Saussureae Involucratae Herba Extract; Solid Lipid Nanoparticles; Drug Loading; Entrapment Efficiency
天山雪莲为菊科植物天山雪莲Saussurea involucrata(Kar. et Kir.)Sch.–Bip. 的干燥地上部分,始见于藏药文献《月王药珍》,清代《本草纲目拾遗》中也有记载,维吾尔名为“塔格依力斯”,系维吾尔医习用药材。天山雪莲在医药应用已有数百年的历史,全草入药,具有补肾活血,祛风胜湿、强筋健骨,营养神经,调节异常体液等作用,用于风湿性关节炎、关节疼痛、肺寒咳嗽等症[1-3]。课题组前期研究已证实天山雪莲提取物(Saussureae Involucratae Herba extract, SIHE)中主要活性成分为绿原酸和芦丁[4-5]。但SIHE的脂溶性不高、口服吸收差,生物利用度低,从而影响药物的临床疗效。针对SIHE的这些问题,课题组开展了许多新剂型如分散片、缓释片、微乳、磷脂复合物等的研究[6-9],旨在提高其生物利用度,但结果尚不尽人意。固体脂质纳米粒(Solid lipid nanoparticles, SLN)既具备聚合物纳米粒物理稳定性高、药物泄露少的优点,又兼具脂质体、乳剂毒性低、能大规模生产的优点,是一种极具发展前景的新型给药载体系统,日益受到各国研究研究者的重视[10-11]。SLN可增强与生物膜的粘附性,延长胃肠道的粘附时间和滞留时间,有效地提高药物生物利用度。采用固体脂质纳米粒技术研究天山雪莲提取物新剂型,以期提高其溶解性、稳定性和生物利用度[12]。
包封率和载药量测定是制备固体脂质纳米粒过程中处方工艺筛选与质量评价的重要指标和处方前研究工作。因此,实验建立了HPLC法同时测定天山雪莲提取物固体脂质纳米粒中2种有效成分的方法,为该制剂的处方工艺研究奠定基础。
1 仪器与材料
1.1 仪器 日本岛津SPD-10AVP型高效液相色谱仪,AB135-S梅特勒-托利多电子天平(瑞士),BS110S型Sartorius电子天平(北京赛多利斯天平有限公司),JA-2003B电子天平(上海越平科学仪器有限公司),NS1001L Panda2K型高压匀质机(意大利Niro Soavi),R-201D旋转蒸发器(巩义市予华仪器有限责任公司),DZKW-S-A型电热恒温水浴锅(北京永光明医疗仪器厂),5415R离心机(德国Eppendorf),WP-UP-IV-10型Water Purifier实验室专用超纯水机(四川沃特尔科技发展有限公司);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司),Millipore超滤离心管(Microcon YM-10,MWCO为10KDa,USA)。
1.2 样品与试剂 芦丁对照品(批号:100080-201409)、绿原酸对照品(批号:110753-201415)购自中国食品药品检定研究院;单硬脂酸甘油酯(批号:F20151002,中国医药集团上海化学试剂公司);卵磷脂(批号:F20160322,上海国药集团化学试剂有限公司);山嵛酸甘油酯(批号:3545PPD,Compritol 888 ATO);吐温-80(批号:F20161110,上海国药集团化学试剂有限公司);乙腈(色谱纯,Fisher);甲醇(批号:20161015,天津市福晨化学试剂厂),天山雪莲提取物固体脂质纳米粒(SIHE-SLN,自制,批号:20170315-1,20170315-2,20170315-3)。
2 方法与结果
2.1 天山雪莲提取物固体脂质纳米粒的制备 采用高压匀质法(homogenization technique)制备天山雪莲提取物固体脂质纳米粒。称取处方量的山嵛酸甘油酯、单硬脂酸甘油酯、SIHE、在(80±2)℃水浴下溶于适量无水乙醇中,挥除溶剂,形成均匀的油相。取一定量的吐温-80分散于水中,形成均匀的水相,将油相与水相搅拌混合均匀,加入高压匀质机中进行两次匀质乳化(10000r/min),冰浴迅速冷却,即得SIHE-SLN。
2.2 包封率及载药量的HPLC测定方法研究
2.2.1 供试品溶液的制备 精密量取3.0mLSIHE-SLN,置于10mL量瓶中,加入甲醇于60℃水浴破坏10min,用甲醇稀释至刻度,过0.45μm微孔滤膜,作为供试品溶液。
2.2.2 对照品溶液的制备 分别精密称取绿原酸对照品和芦丁对照品19.25mg、25.74mg置于100mL量瓶中,加甲醇溶解稀释至刻度,摇匀,即得含绿原酸和芦丁质量浓度分别为192.5μg/mL和257.4μg/mL的混合对照品储备液。
2.2.3 色谱条件 采用Shim-pack VP-ODS C18色谱柱(250mm×4.6mm,5μm),流动相为乙腈(A)-0.4%磷酸(B),梯度洗脱(0~15min, A-B=13∶[KG-*3/5]87; 16~40min,A-B=15∶[KG-*3/5]85);双波长检测:257nm(检测芦丁),327nm(检测绿原酸);流速为1mL/min;柱温为35℃;进样量为10μL。
2.2.4 专属性试验 精密量取空白固体脂质纳米粒及含药固体脂质纳米粒各3mL,置于10mL量瓶中,加入甲醇于60℃水浴破坏10min,用甲醇稀释至刻度,离心,取上清液过滤。精密吸取混合对照品储备液2mL至10mL量瓶中,加甲醇至刻度。按上述色谱条件进样,结果见图1。样品色谱中与对照品色谱相同保留时间处有色谱峰,而阴性样品无相应峰,说明样品中其他成分对绿原酸和芦丁这2个成分的测定无干扰,且2个成分与相邻峰的分离度均大于1.5。
2.2.5 标准曲线的绘制 精密量取“2.2.2”项下混合对照品储备液0.5、1.0、2.0、3.0、4.0、5.0mL分别置于10mL量瓶中,加甲醇稀释至刻度,摇匀,即得系列对照品溶液。精密吸取对照品溶液,按“2.2.3”项下色谱条件進行测定,以对照品质量浓度X(μg·mL-1)对其峰面积Y进行线性回归,得回归方程。见表1。
2.2.6 稳定性考察精密 量取3.0mL SIHE-SLN,置于10mL量瓶中,按照“2.2.1”项下方法,制备供试品溶液,分别于0、2、4、6、8、10、12、24h测定。结果表明绿原酸和芦丁在24h内的RSD分别为1.24%、0.95%,说明供试品溶液在24h内稳定。
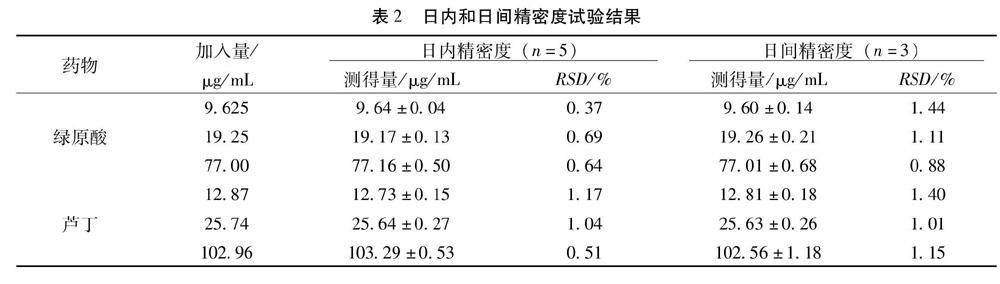
2.2.7 精密度试验 精密量取混合标准品储备液0.5、1.0、4.0mL分别置于10mL量瓶中,定容至刻度。于1d内间隔相等时间分别测定5次计算日内RSD(%);连续测定3d,进行日间精密度测试,求日间精密度的RSD(%)。结果见表2。日内、日间精密度RSD均小于2.0%,说明日内、日间精密度良好。
2.2.8 重复性试验 精密量取3.0mL SIHE-SLN,置于10mL量瓶中,共6份,按照“2.2.1”项下供试品溶液制备方法平行制备6份供试品溶液,制备成供试品溶液,按“2.2.3”项下色谱条件进行测定并计算。结果绿原酸和芦丁的含量平均值(n=6)分别为125μg/mL和173μg/mL;RSD分别为1.02%和1.14%。表明该方法重复性良好。
2.2.9 加样回收率试验 精密量取已知含量的SIHE-SLN 1.5mL,置10mL量瓶,共6份,分别精密加入“2.2.2”项下混合对照品储备液1.0mL,依照供试品溶液制备方法同法操作,按上述色谱条件测定并计算回收率,结果绿原酸和芦丁的平均回收率分别为(98.5±0.12)%和(99.4±0.21)%,RSD分别为1.06%和1.27%。
2.2.10 超滤法回收率试验 取适量处方比例的辅料与混合标准品储备液混合,配置成高、中、低3个质量浓度溶液,取200μL置于超滤离心管中(MWCO为10kDa),离心(12000r/min)15min,吸取滤液,即得,进行测定。结果见表4。
2.2.11 SIHE-SLN的载药量与包封率测定 游离天山雪莲提取物药量(WF)测定:精密量取SIHE-SLN混悬液,置超滤离心管中(MWCO为10kDa),离心(12000r/min)15min,吸取滤液,进行测定。
SIHE-SLN总药量(WT)测定:精密量取SIHE-SLN混悬液3.0mL,置10mL量瓶中,加甲醇适量,水浴加热至溶液澄清,放冷至室温,用甲醇稀释至刻度,用0.45μm微孔滤膜过滤,即得。进行测定。按公式:包封率=(WT-WF)/ WT×100%和载药量=(WT-WF)/Ws×100%(WT为SIHE-SLN总药量,WF为游离药物量,Ws为载体材料的总量),分别计算2种成分的包封率和载药量。测定3批样品,结果见表5。
3 讨论
测定药物包封率的方法主要有透析法、葡聚糖凝胶柱法、超滤法等。采用透析法虽简单,费用低,但费时。在室温条件下,透析95%以上的游离药物需要多次更换透析介质,耗时24h。采用葡聚糖凝胶柱法分离天山雪莲提取物固体脂质纳米粒中的游离药物,用蒸馏水作为洗脱剂时,对有效成分溶解能力较小,难以洗脱下来,造成游离药物的回收率低,改用对有效成分溶解能力較大的乙醇水溶解洗脱时,虽然回收率高,但葡聚糖凝胶的结构发生破坏,逐渐塌陷。超滤法是在离心力的作用下,利用筛分原理对大分子和小分子物质进行分离。由于操作准确、简便样品不必进行稀释,不存在被包封药物泄露的问题,可有效分离游离药物与固体脂质纳米粒。因此,更适合天山雪莲提取物固体脂质纳米粒制备工艺优化时包封率的测定。
试验表明该色谱方法准确可靠、简单快速、可用于天山雪莲提取物固体脂质纳米粒中不同成分的包封率和载药量的同时测定,为处方工艺研究奠定了良好的基础。
参考文献
[1]王晓玲,李启发,丁力生.天山雪莲的化学成分研究[J].中草药,2007,38(12):1795.
[2]赵莉,王晓玲.新疆雪莲的化学成分、药理作用及其临床应用[J].西南民族大学学报(自然科学版),2003,29(4):424.
[3]李燕,郭顺星,王春兰,等.新疆雪莲化学成分的研究[J].中国中药杂志,2007, 32(2):162.
[4]肖皖,李宁,波拉提·马卡比力,等.雪莲化学成分和药理活性研究进展[J].现代药物与临床,2011,26(5):344.
[5]王晓玲,李启发,丁立生.天山雪莲的化学成分研究[J].中草药,2007,38(12):1795.
[6]邢建国,谢敏,王新春,等.天山雪莲提取物平衡溶解度和表观油水分配系数的测定[J].中国医院药学杂志,2013,33(1):35.
[7]刘桂花,邢建国,王新春,等.天山雪莲亲水凝胶骨架片的制备及其体外释放度的测定[J].华西药学, 2010,25(3):308.
[8]谢敏, 邢建国, 王新春, 等. 天山雪莲透皮微乳制备处方优化[J]. 中国实验方剂学杂志,2012, 18(1): 8.
[9]张雪峰,杨轲,欧燕,等.星点设计-效应面优化天山雪莲提取物磷脂复合物制备工艺[J].中草药,2014,45(16):2326.
[10]胥娜,钟文英,朱丹妮,等.固体脂质纳米粒在提高难溶性药物生物利用度中的应用[J].中华中医药学刊,2007,25(8):1605.
[11]候冬枝,谢长生,朱长虹.固体脂质纳米粒的制备和载体结构的研究进展及其应用[J].中国医院药学杂志,2004,24(1):43.
[12]夏爱晓,宋倩倩,孙渊.固体脂质纳米粒制备及应用研究进展[J].药学实践杂志,2012,30(5):331.
(收稿日期:2018-12-24 编辑:刘斌)

