基于锁式探针的荧光定量PCR技术快速检测肉制品中鸭源性成分
满 岳/王溪桥/周小平 甘肃出入境检验检疫局检验检疫综合技术中心 甘肃 兰州 730010
Nazariyah Yahaya马来西亚伊斯兰科技大学科学与技术学院,汝来 马来西亚 71800
丁功涛 西北民族大学,甘肃 兰州 730030
李 冰 甘肃省轻工研究院,甘肃 兰州730000
肉类掺假是目前我国食品行业面临的突出问题。由于鸭肉的纹理与羊肉和牛肉近似,一些不法商家以廉价的鸭肉冒充价格较高的羊肉或牛肉进行销售,甚至加入羊牛肉精、羊牛肉粉等增加香味来掩盖掺假行为。肉类掺假行为不但严重损害消费者经济利益,还严重影响他们的身体健康[1,2]。因此,建立快速、有效、简易的鸭源成分检测方法对于监管部门高效抑制肉类掺假不法行为十分必要。
利用聚合酶链式反应(Polymerase Chain Reaction,PCR)技术检测种属特异性基因已经成为食品中肉类成分鉴别的主要手段。PCR方法最早应用于检测饲料中的羊、牛源性成分[3],现在也已经广泛应用于鸭源性成分检测。国内目前应用于鸭源性成分鉴定的PCR方法包括PCR法,荧光定量PCR法,多重实时荧光 PCR 法以及微滴数字PCR法[2,4-6]。用于检测的种属特异性基因通常采用线粒体DNA组(mitochondrial DNA, mtDNA)的基因,例如细胞色素b基因(Cytochrome B gene,Cytb)和16S 核糖体 RNA(16s rRNA)基因 16s rDNA[2,7]。
锁式探针是一种由两个末端和中间链接序列组成的单链寡核苷酸片段,两个末端含有靶标序列。在检测时,当两个末端序列和与靶标DNA高度互补时,两个末端空间位置靠近,在连接酶作用下探针被连接成环状,然后通过滚环扩增(Rolling Circle Amplification, RCA)对靶标DNA进行扩增。锁式探针检测灵敏度高,特异性强,可与分子标记、反向斑点杂交、荧光 PCR、 DNA 芯片等技术结合,应用于细胞原位检测、微生物、病原物检测鉴定等[8-10]。不过锁式探针在肉类成分检测中的应用尚未有报道。
本研究依据鸭源线粒体DNA组的16s rDNA基因特有序列设计特异性锁式探针及扩增引物,探讨基于锁式探针的实时荧光PCR在肉制品中鸭源性成分快速检测中的实际应用效果,以期为肉类质量监控检测提供新的技术手段。
1 材料与方法
1.1 检测样品
兰州市城关区大润发超市内购买的鸭肉、猪肉,羊肉与牛肉用于本实验研究。
1.2 试剂:
Probe Premix Ex Taq II购自TaKaRa公司;DNA提取试剂盒购自上海捷瑞公司;核酸外切酶Ⅲ、核酸外切酶Ⅰ和Taq DNA连接酶均购自NEB公司。
1.3 仪器:
分析天平BT125D(德国赛多利斯集团);控温磁力搅拌器(金坛区医疗仪器厂);凝胶成像系统(美国Bio-Rad公司);高速冷冻离心机(德国SIGMA公司);旋涡混合器(海门市其林贝尔仪器制造有限公司);电泳仪(美国Bio-Rad公司);Real Time PCR仪(美国Bio-Rad公司);微量分光光度计(杭州奥盛仪器有限公司)。
1.4 锁式探针设计:
锁式探针、扩增引物和荧光探针(表1)均由合创(广州)生物科技有限公司合成。设计思路参照已发表文献[11,12]。
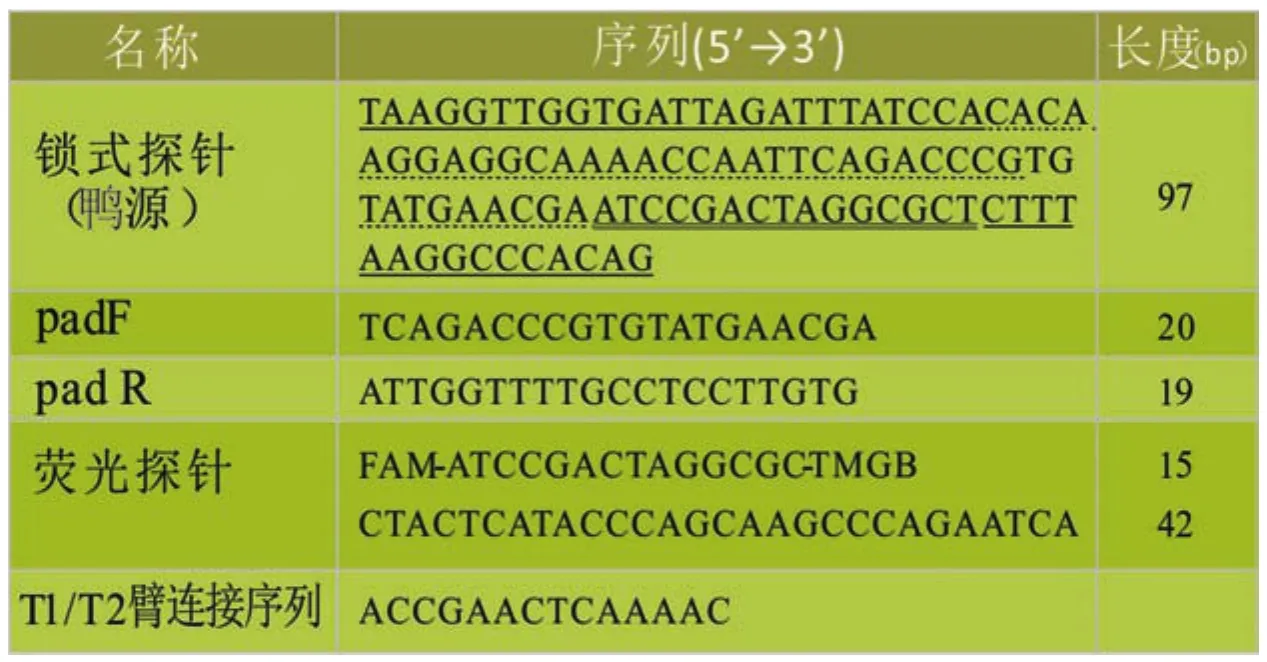
表1 锁式探针、扩增引物与荧光探针列表
1.5 DNA提取:
DNA步骤简述如下:(1)称取50-200mg鸭肌肉组织到研钵中,立即用液氮研磨,并收集到离心管中。接着加入500uL裂解液和10uL蛋白酶K(20mg/ml),55℃水浴2h;(2)将上述处理好的样本裂解液,加入等体积的苯酚:氯仿:异戊醇混合液(25:24:1),12000rpm离心10min;(3)转移上清液(约400uL)并加入等体积的无水乙醇和1/10体积的NaAc,颠倒混匀后转移至离心柱中(分2次转移),8000rpm 离心30s-60s,倒弃滤液;(4)将剩余的上清液转移到离心柱中,8000rpm 离心30s-60s,倒弃滤液,加500uL 80%的无水乙醇, 8000rpm 离心30s-60s,接着重复上述操作一次;(5)倒弃滤液,将离心柱放回离心管中,12000rpm 离心 2min;(6)丢弃离心管,将Centrifugal column转移到新的离心管中,室温放置2min,挥发剩余的乙醇;(7)加30-50uL 洗脱液室温静置2min 或55℃溶解2min,12000rpm 离心30s-60s,得到DNA。
1.6 连接与消化
将锁式探针与模板DNA进行环化连接,反应体系如表2。在PCR仪中94℃预热5min,接着以94℃ 15s、65℃ 5min 进行15个循环,然后再95℃反应15min。环化连接反应结束后,离心管立即冰浴5min。接下来,按照表3配制消化体系,并在PCR仪中以37℃ 2h、95 ℃ 2.5h进行消化反应。消化后的产物作为qPCR模板,-20℃保存备用。

表2 环化连接体系

表3 消化体系
1.7 荧光定量PCR
将连接消化后的环化锁式探针作为模板,然后用扩增引物 P1/P2 进行荧光定量PCR扩增。荧光定量PCR反应体系的配制参考TaKaRa Ex Taq试剂盒说明进行(表4),扩增曲线应用Bio-Rad CFX96 Real-Time PCR System的操作方法进行。反应程序如下:95℃预变性 10 s,然后以 95℃ 15 s,60℃ 1 min 进行 40个循环。
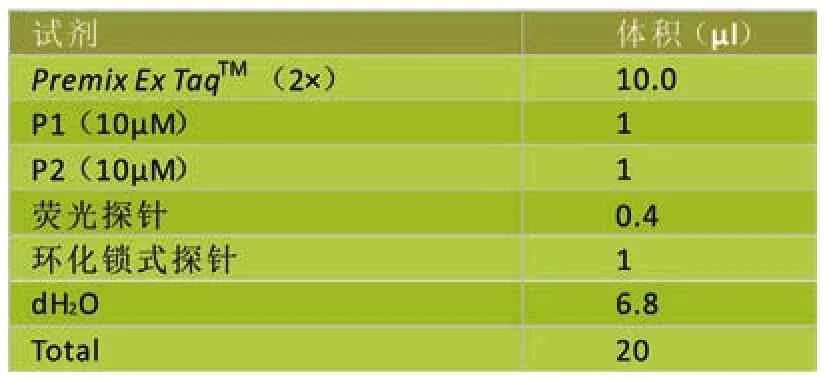
表4 荧光定量PCR反应体系(20uL)
1.8 特异性检测
以猪、羊、牛的DNA 为模板,分别与鸭源16s rDNA锁式探针进行连接、消化,然后用连接消化后的产物与扩增引物padR/padF和荧光探针进行实时荧光 PCR检测,并以无菌水设置空白对照。
1.9 灵敏度检测
确定鸭源成分DNA浓度后,经无菌水10倍浓度梯度稀释后,各取适量体积与鸭源16s rDNA锁式探针进行连接、消化,并与扩增引物padR/padF和荧光探针进行实时荧光 PCR检测。
2 结果
2.1 锁式探针连接环化验证
为确认锁式探针连接环化成功,我们采用RCA法对连接产物进行验证。通过琼脂糖凝胶电泳可以看到扩增产物具有典型的阶梯状条带分布,说明锁式探针连接和环化成功(图1)。

图1 鸭源16s rDNA RCA扩增产物电泳图Fig. 1 The electrophorogram of RCA for duck 16s rDNA
2.2 基于锁式探针的荧光定量PCR对鸭源性成分检测
为验证基于锁式探针的荧光定量PCR是否可用于鸭源性成分检测,我们以连接环化的锁式探针为模板进行荧光定量PCR实验。实验中分别以无菌双蒸水、无连接酶连接反应液和无鸭源性成分DNA连接反应液为对照。从图2结果可知,只有锁式探针连接环化成功后才能在荧光定量PCR实验中得到阳性信号,而对照组实验均没有出现信号(图2)。该结果初步证明基于锁式探针的荧光定量PCR可用于鸭源性成分的检测。
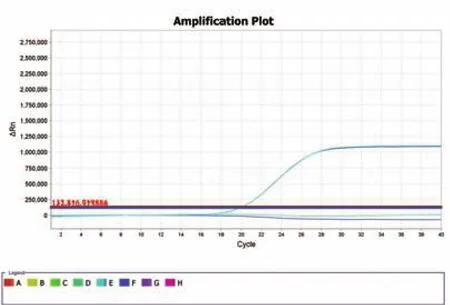
图2 基于鸭源16s rDNA锁式探针的荧光定量PCR检测Fig.2 Amplification of duke 16s rDNA by real-time PCR based on padlock probe
2.3 特异性检测
为验证2.2中实验的特异性,我们对猪源、牛源和羊源的DNA分别与鸭源16s rDNA锁式探针进行连接环化,然后再利用荧光定量PCR检测,发现只有鸭源性成分DNA-锁式探针连接环化产物才有荧光信号出现,结果为阳性,其余三组产物与和无菌双蒸水一样均为阴性结果(图3)。上述结果说明本研究中的锁式探针具有十分高的特异性,可用于鸭源性成分特异性检测。
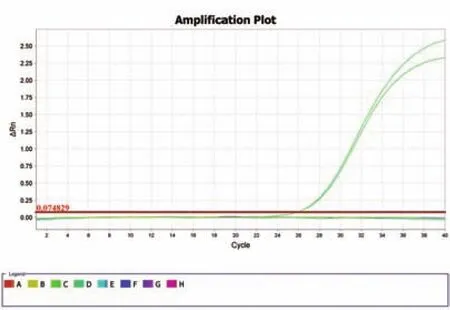
图3 基于鸭源16s rDNA锁式探针的荧光定量PCR检测的特异性Fig.3 Specify of real-time PCR based on padlock probe for duke 16s rDNA
2.4 灵敏度检测
除了特异性之外,我们也十分关心该锁式探针的灵敏度。首先,鸭源性成分DNA经过10倍浓度梯度稀释,然后再分别取7 ng·μL-1、700 pg·μL-1、70 pg·μL-1、7 pg·μL-1、700 fg·μL-1、70 fg·μL-1、7 fg·μL-17个浓度与锁式探针接连、消化并经荧光定量PCR检测。PCR 扩增的标准曲线的斜率K为-3.3286(图4),表明扩增反应正常。结果显示,除了7 fg·μL-1,上述浓度DNA的连接环化产物都能检测到阳性信号,说明该锁式探针可检测的最低鸭源性成分DNA浓度是70 fg·μL-1(图5)。

图4 荧光定量PCR扩增标准曲线图Fig.4 The amplification standard curve of real-time PCR
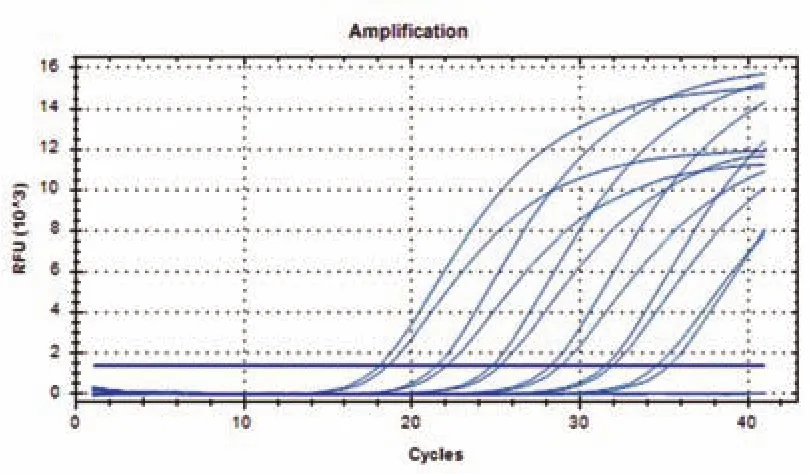
图5 基于鸭源16s rDNA锁式探针的荧光定量PCR检测的灵敏度Fig.5 Sensitivity of real-time PCR based on padlock probe for duke 16s rDNA
3 讨论
近年来,食品安全一直是国人关心的热点问题,肉制品掺假就是其中让人深恶痛绝的事件,尤以鸭肉假冒杨牛肉为甚。基于PCR技术的普及,已有多种PCR方法应用于肉类产品鸭源性成分检测,已经报道过的有PCR法,荧光定量PCR法,多重实时荧光 PCR 法以及微滴数字PCR法。不过上述方法均存在缺陷。普通的PCR方法成本高,检测时间长,耗费人力物力;荧光定量PCR法成本高,而且假阳性出现概率比其他方法要高;多重实时荧光PCR法步骤烦琐,不易操作;微滴数字PCR法作为新出现的技术,对于设备要求高,需要特定设备才能开展[5,13]。因此,本研究希望能为肉制品中鸭源性成分鉴定提供新的PCR方法。
锁式探针具有极佳的特异性和灵敏度,实用性强,因此近来广泛用于微生物、病原物种类检测与鉴定。不过目前未有使用锁式探针进行鸭源性成分检测的报道。本研究基于鸭线粒体基因组16s rDNA特异性序列设计锁式探针和PCR引物,建立了基于锁式探针的荧光定量PCR检测肉制品中鸭源性成分快速检测技术。该技术结合了锁式探针的高特异性与荧光定量PCR的高灵敏性,可在试验的鸭肉、猪肉、羊肉和牛肉中特异性地检测出鸭源性线粒体基因组的16s rDNA,而且检测浓度达到70 fg·μL-1。这些结果表明基于锁式探针的荧光定量PCR法具有高度特异性和灵敏度。
在锁式探针设计中,靶基因选择是首要考虑的问题。相比较于核基因组,线粒体基因组速度更快,种内遗传稳定,种间高度变异,即使亲缘关系较近的种属也存在有特异的线粒体组基因[3,14]。其次,在所有细胞中均有大量的线粒体,保证可大量获得模板DNA[15]。另外,在肉制品制作过程中核基因组经常被破坏,然而线粒体基因组经过特殊处理后仍能保持完整[4,15]。因此线粒体组DNA已经广泛应用于动物源性检测[3]。
另外,如何保证探针特异性也是十分重要的方面。锁式探针具有单碱基错配识别功能,如果错配位置位于探针3`末端,由于错配会导致连接失败[8,12]。因此,我们选取具有高度种属特异性的16s rDNA作为模板靶标DNA序列,将锁式探针的3`末端选择在与16s rDNA序列高度一致的碱基序列位置,保证锁式探针3`末端与靶标DNA完全互补,确保检测的特异性。
4 结论
本研究采用鸭线粒体16s rDNA作为靶基因,并以此设计特异性锁式探针,结合荧光定量PCR技术对靶基因进行扩增。经验证,本方法特异性好,灵敏度高,可有效快速检测鸭源性成分,为肉类掺假鉴定提供了新的技术手段。


