产后健康和子宫炎奶牛子宫中化脓隐秘杆菌分离鉴定
靳倩兰,王梦玲,杜孟泽,朱要宏,王九峰
(中国农业大学动物医学院,北京 海淀 100193)
奶牛分娩后子宫腔内极易受到来自环境中细菌的污染,子宫复旧、子宫防御机制的建立和子宫内膜再生能够清除这些细菌。如果致病菌不能及时被清除,持续存在的致病菌会引起多达50%的奶牛发生子宫炎症,包括子宫炎、临床型和亚临床型子宫内膜炎[1]。子宫疾病损伤奶牛繁殖力,造成受胎率降低、产后空怀期延长、不孕牛淘汰率增加,同时乳产量下降、治疗费用增加以及因抗生素治疗导致弃奶等,给奶牛产业造成极大的经济损失[2]。据国外文献报道,一个奶牛子宫炎的病例的花费可达292欧元;按20%发病率计算奶牛子宫疾病可分别造成欧盟和美国奶业每年高达14亿欧元和6.5亿美元的经济损失[1]。
革兰阳性菌化脓隐秘杆菌是最常分离到的主要子宫致病菌之一,进入牛子宫会破坏子宫内膜上皮[1]。这是由于化脓隐秘杆菌分泌一种胆固醇依赖性细溶细胞素(Pyolysin,PLO),能够插入细胞膜富含胆固醇的脂筏中形成30 nm的孔洞,导致细胞渗透性死亡[3]。虽然已经证实化脓隐秘杆菌与子宫内膜炎的严重程度存在关联性,但健康牛子宫中也能分离到该细菌[4]。plo基因作为主要的致病因子在化脓隐秘杆菌中是普遍存在的[5],因此它有可能不是唯一起决定性作用的致病因子。化脓隐秘杆菌或plo基因缺失菌株能够刺激子宫内膜上皮细胞产生炎症介质IL-1β,IL-6和IL-8,但单独PLO毒素并不会刺激子宫内膜细胞、造血细胞产生免疫应答[3]。因此化脓隐秘杆菌引起的子宫内膜炎症可能与其表达其他毒素有关。
本试验采集产后3周内健康与患子宫炎奶牛的子宫分泌物进行细菌分离与鉴定,并且对于化脓隐秘杆菌分离株进行了毒力基因检测,了解产后子宫中可培养的细菌,调查比较产后健康奶牛和患子宫炎奶牛子宫中的化脓隐秘杆菌分离情况及其携带的毒力基因,为下一步研究化脓隐秘杆菌对子宫内膜的致病机理提供依据。
1 试验试剂与设备
1.1 主要试剂 血平板所用绵羊血,购自北京奥博星生物技术有限责任公司;LB琼脂,购自北京陆桥生物技术有限责任公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;PCR体系,购自北京博迈德基因技术有限公司。
1.2 主要仪器与设备 TCYQ型恒温振荡培养箱,购自太仓市实验设备厂;SW-CJ-1FD型单人单面垂直净化工作台,购自苏州智净净化设备有限公司;DHP-9052型电热恒温培养箱,购自上海一恒科学仪器有限公司;Model#:9902型PCR仪,购自美国ABI公司;DYY-6C型电泳仪,购自北京市六一仪器厂;凝胶成像仪,购自美国Alpha Innotech公司;立式高压蒸汽灭菌器YXQ-LS-50SⅡ,购自上海博讯实业有限公司医疗设备厂。
2 试验方法
2.1 样本采集与处理 于北京市某奶牛场选定产后3周内的奶牛采集子宫分泌物,并记录奶牛个体的年龄、病史、用药、体况评分等信息,并对子宫分泌物进行评分。曾有抗生素、中草药治疗病史的奶牛未采样。由兽医采用直肠把握法,将带有固定探针的子宫分泌物采集导管从阴门插入到子宫颈口内。导管顶端冲破外层保护薄膜后穿过子宫颈口进入宫腔内,使气囊充气从而固定导管位置防止子宫分泌物外流。随后取出固定探针后用50 mL注射器抽取子宫分泌物,收集于灭菌的50 mL离心管中,冰上运输4 h内达到实验室进行微生物培养。
2.2 子宫分泌物评分 对产后21 d内奶牛子宫分泌物的评分依据[6]如下:1分:没有恶臭气味的恶露,无色、红色或棕色;2分:浑浊且含有絮状脓黏液的分泌物;3分:含有<50%粘脓性物质的分泌物,没有恶臭气味;4分:含有≥50%粘脓性物质的分泌物,没有恶臭气味;5分:恶臭,红色或者褐色的水性分泌物。子宫分泌物评分在4分及以下的奶牛被诊断是健康的,子宫分泌物被评为5分的奶牛且直肠温度≥39.5℃被诊断为患子宫炎。
2.3 细菌分离鉴定 (1)将子宫分泌物涂于血平板:取样品以原液和10倍稀释的浓度分别接种于血平板上均匀涂布,37℃培养箱需氧培养48 h;(2)取血平板中单一菌落,进行16S rDNA通用引物PCR后,测序。 上游引物序列:5′-AGA GTT TGA TCM TGG CTC AG-3′,下游引物序列:5′-TAC GGY TAC CTT GTT ACG ACT T-3′,目的条带 1 465 bp;(3)利用NCBI中BLAST数据库对测序结果进行比对。
2.4 DNA提取与毒力基因鉴定 单一菌落多次分离纯培养后,使用天根生化科技(北京)有限公司细菌基因组DNA提取试剂盒提取细菌DNA。取1 μL模板使用北京博迈德基因技术有限公司PCR Mix体系进行常规PCR。扩增循环执行条件如下:95℃10 min(15 s循环40次),退火30 s,延伸72℃30 s:72℃扩增4 min。利用电泳凝胶技术将分离出来的化脓隐秘杆菌进行毒力基因鉴定,引物由天一辉远试剂公司合成,参考Silva合成引物[5],引物序列见表1。
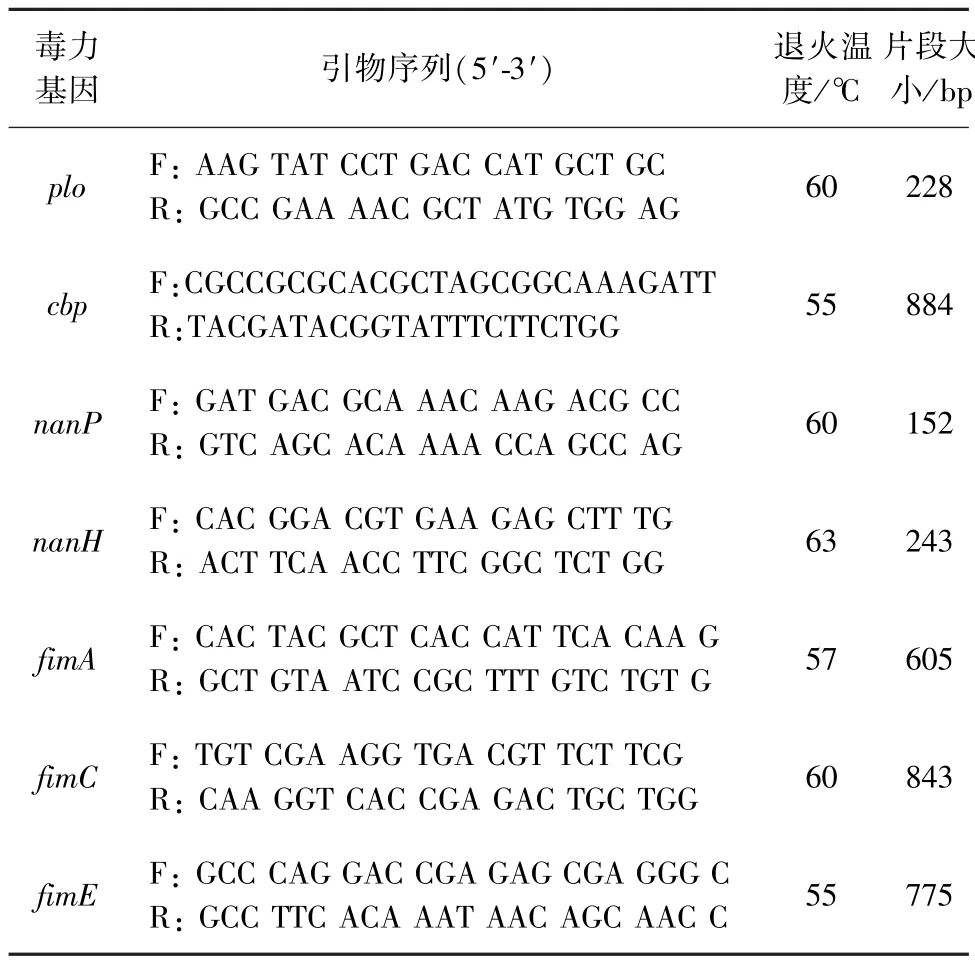
表1 化脓隐秘杆菌的毒力基因引物序列
3 结果
3.1 奶牛个体信息 根据临床诊断结果,健康奶牛有15头,平均年龄为3.8岁,子宫分泌物评分为2.143±0.312,体况评分为3.15±0.036,其中8头牛子宫分泌物分离到化脓隐秘杆菌;子宫炎奶牛11头,平均年龄为5岁,子宫分泌物评分为4.091±0.315,体况评分为3±0.097,其中7头牛子宫分泌物分离到化脓隐秘杆菌。
3.2 细菌分离结果 根据血平板培养结果、单菌落16S rRNA鉴定结果,本试验从26份子宫分泌物样品中共分离出87株细菌,共10个属。对结果进行分类统计(表2),其中分离到大肠杆菌最多,共分离到34株,分别从8头患子宫炎奶牛、13头健康牛中分离得到。化脓隐秘杆菌分离得到17株,来自7头子宫炎病牛和9头健康牛。芽孢杆菌共分离到15株,包括蜡样芽孢杆菌(6株),地衣芽孢杆菌(4株),短小芽孢杆菌(2株),枯草芽孢杆菌(2株)等。结果表明,大肠杆菌、化脓隐秘杆菌、芽孢杆菌是产后3周内奶牛子宫中最常分离到的细菌,而葡萄球菌、梭杆菌、咸海鲜球菌、海藻希瓦菌、食酸菌、创伤球菌及彭氏变形杆菌也在个别牛子宫中偶见分离。分析每头牛感染情况,其中6头牛属于单一感染,包括3头健康牛(均为大肠杆菌)和3头患子宫炎牛(1头为化脓隐秘杆菌,2头牛为大肠杆菌);其他20头奶牛均为多细菌混合感染。
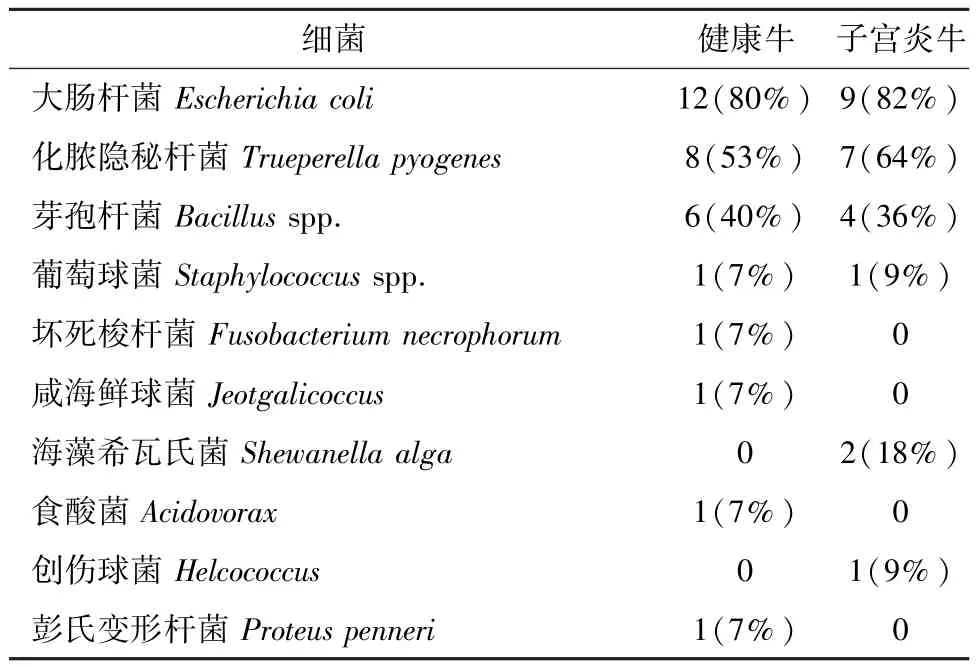
表2 子宫分泌物中细菌分离鉴定结果
3.3 化脓隐秘杆菌毒力基因鉴定 中插彩版图1示化脓隐秘杆菌在血平板上的菌落形态:菌落直径1 mm,呈白色透明、凸起、圆形、边缘整齐,周围1 mm透明溶血环。统计结果表明(表3),从11头患子宫炎的奶牛和15头健康牛的子宫分泌物中共分离得到17株化脓隐秘杆菌,且均携带plo基因和fimA基因,其中携带最多毒力基因的化脓隐秘杆菌分别在健康和子宫炎奶牛中分离到1株和3株。图2示化脓隐秘杆菌毒力基因电泳凝胶结果。

表3 化脓隐秘杆菌毒力基因结果
4 分析与讨论
根据近年来子宫内细菌分离培养并结合细菌致病性,Sheldon等人将常分离到的子宫细菌归纳总结为以下3类:第一类,公认的致病菌,包括化脓隐秘杆菌、大肠杆菌、产黑色素普菌、坏死梭杆菌以及具核梭杆菌;第二类,潜在的致病菌,包括不动杆菌、地衣芽孢杆菌、粪肠球菌、多杀巴氏杆菌、嗜血杆菌、凝固酶阳性金黄色葡萄球菌、乳房链球菌、拟杆菌、厚壁菌门和所菌门某些细菌种等;第三类,非子宫致病菌包括克雷伯菌、微球菌、变形杆菌,以及某些葡萄球菌属等[6]。
从产后3周内健康和患子宫炎奶牛采集的26份子宫分泌物中发现大肠杆菌、化脓隐秘杆菌、芽孢杆菌是最常分离到的细菌,这与前人的研究结果基本一致[7,9]。通常认为产后一周内大肠杆菌的大量繁殖是子宫感染和炎症的第一步,子宫稳态被破坏后更利于其他厌氧致病菌的侵袭感染,包括化脓隐秘杆菌、坏死梭杆菌、拟杆菌等[8]。然而本试验还发现3头健康牛和2头患子宫炎牛子宫中存在大肠杆菌单一感染的情况,这可能与大肠杆菌容易成为优势细菌有关。目前本试验中应用的细菌培养方法导致营养要求苛刻或未知培养条件的细菌无法被培养分离到,将来采用细菌16S rNA基因高通量测序可以反映子宫完整的细菌组成。另外,芽孢杆菌也是子宫分泌物中较常分离到的细菌,包括短小芽孢杆菌、地衣芽孢杆菌、腊样芽孢杆菌、枯草芽孢杆菌等,这与Wagener K.的研究结果一致[9]。但黄启震等人发现北京区域奶牛子宫内膜炎的主要致病菌是蜡样芽孢杆菌[10]。因此,芽孢杆菌某些种有可能是潜在的致病菌从而引起子宫内膜损伤及炎症,是否存在北京地区特有的强致病力芽孢杆菌菌株,有待进一步分离鉴定。
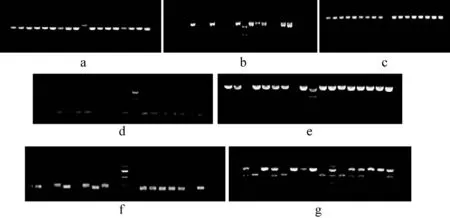
图2 化脓隐秘杆菌毒力基因电泳凝胶结果
化脓隐秘杆菌能够表达粘附宿主细胞的多种毒力基因,包括神经氨酸酶(Neuraminidases,nanH and nanP),胶原结合蛋白(Collagen-binding protein,cbpA),菌毛蛋白(Fimbriae expression,fimA,fimE,fimC,fimG)。据报道在产后1~3 d检测到化脓隐秘杆菌的plo基因和fimA基因与子宫炎发生有一定关联,而产后8~10 d和34~36 d检测到则与子宫内膜炎发生相关[11]。本试验发现化脓隐秘杆菌在健康牛子宫中均可以分离得到,所有菌株均携带plo基因和fimA毒力基因。说明化脓隐秘杆菌存在且携带plo基因和fimA毒力基因,并不一定会导致奶牛子宫炎的发生。虽然本试验中奶牛个体数量较少无法明确反映群体发病规律,但该现象说明其他非化脓隐秘杆菌的致病因素参与奶牛子宫炎的发展过程。致病菌的存在是否会导致子宫感染及炎症,与细菌的致病力和载量也有关,但本试验并未进行定量检测和比较。
文献中指出,化脓隐秘杆菌激活的子宫内膜免疫应答具有菌株特异性,分离患子宫内膜炎和健康牛菌株携带不同的毒力基因,且前者引起子宫内膜上皮细胞和免疫细胞促炎因子(PTGS2,CXCL3,IL1A和IL6)表达水平更高[12]。本试验中认为携带所有检测的毒力基因的菌株具有潜在的强致病力,这样的菌株在健康和患子宫炎奶牛中均有分离到,各菌株携带多种毒力基因的情况并不完全一致。这些分离株的致病力有待于通过感染子宫内膜上皮和基质细胞进行验证。不同健康状态的奶牛子宫内环境是否会导致细菌致病力差异有待进一步研究,这为明确化脓隐秘杆菌致炎反应菌株特异性的产生机制提供参考。
本研究结果表明,大肠杆菌、化脓隐秘杆菌、芽孢杆菌是产后3周内奶牛子宫分泌物中最常分离培养的细菌;从15头健康奶牛和11头患病奶牛的子宫分泌物中分离到17株化脓隐秘杆菌,所有菌株均携带plo基因和fimA基因;携带最多毒力基因的菌株在健康和子宫炎奶牛中均可以分离到。

