Box-Behnken设计-响应面法优化三棱总黄酮的分离纯化工艺研究Δ
匡宇,赵永艳,何沛煜,张军银,周燕,彭腾#,余成浩(.成都中医药大学药学院/中药资源系统研究与开发利用省部共建国家重点实验室培育基地/中药材标准化教育部重点实验室,成都 637;.成都中医药大学基础医学院,成都 637)
三棱药材是指黑三棱科植物黑三棱(Sparganium stoloniferumBuch.-Ham.)的干燥块茎[1],其性平、味苦,归肝、脾经,具有破血行气、消积止痛的功效,主治癥瘕痞块、痛经、瘀血经闭、胸痹心痛、食积胀痛等疾病。现代临床研究表明,三棱水煎液及其他炮制品具有抗血栓[2]、抗动脉粥样硬化[3]、抗炎镇痛[4]及改善脑缺血缺氧[5]等作用,三棱黄酮还具有抗肿瘤作用[6-7]。三棱化学成分复杂,结构多样,目前三棱中已知的化学成分按其结构分类主要有挥发油、苯丙素类、黄酮类和生物碱类等,此外,还含有少量蒽醌、甾体及其他类化学成分[8]。
三棱中的黄酮成分是其重要有效成分之一[9],已知三棱总黄酮类化合物有芒柄花素、山柰酚、四羟基黄酮醇-3-O-β-D-吡喃葡糖糖苷和异鼠李素-3-O-芸香糖苷[10-11]等成分。近年来,三棱被广泛地应用于妇科疾病的治疗中[12-13]。本课题组前期试验研究表明,三棱总黄酮对大鼠卵巢囊肿有一定的抑制作用[14],因此,以三棱总黄酮为主要活性成分研究其治疗妇科疾病的效果,对提高其临床疗效和研究其作用机制具有重要意义;但试验过程中课题组发现三棱总黄酮在生药中含量过低,仅为生药量的0.1%~0.4%[15]。笔者在此基础上,以三棱总黄酮纯化率为考察指标,在单因素试验的基础上采用Box-Behnken设计-响应面法优化三棱总黄酮的纯化工艺,从而提高三棱总黄酮纯化率,为三棱药材的深入研究提供一定参考。
1 材料
1.1 仪器
BP211D电子天平(德国赛多利斯公司);UV2600紫外-可见分光光度计(上海天美科学仪器有限公司);RE-2000B旋转蒸发仪(上海亚荣升华仪器厂);BUJ25-12超声仪(昆山市超声仪器有限公司);DZKW-4电子恒温水浴锅(北京中兴伟业仪器有限公司);SHE-D循环水式真空泵(巩义市予华仪器有限公司)。
1.2 药品与试剂
三棱药材(批号:20180214)于2018年2月购于荷花池药材市场,经成都中医药大学龙飞教授鉴定为Sparganium stoloniferumBuch.-Ham.的干燥块茎;芦丁对照品(中国食品药品检定研究院,批号:2T25-JYG5,纯度:91.9%);大孔吸附树脂(型号:DM130、HPD100、X-5、NKA-9、AB-8、HP20、D101)均购自沧州市同轩商贸有限公司;硝酸铝、亚硝酸钠、氢氧化钠、无水乙醇等为分析纯,水为超纯水。
2 方法
2.1 三棱总黄酮提取液的制备
精密称取三棱药材适量,粉碎,过2号筛;称取三棱粗粉40.0 g,置于500 mL圆底烧瓶中,加入8倍量70%乙醇,加热至微沸状态回流提取1.5 h,趁热抽滤,重复提取2次,合并滤液得三棱提取液,备用;另按上述方法制备三棱总黄酮干浸膏(纯度为4.25%)。
2.2 三棱总黄酮的含量测定
2.2.1 芦丁对照品溶液的制备 精密称取芦丁对照品0.010 3 g,置于100 mL量瓶中,加适量70%乙醇超声(频率:50 kHz,功率:500 W,下同)溶解,放冷,再以70%乙醇补足至刻度,摇匀,即得0.103 mg/mL的芦丁对照品溶液。
2.2.2 供试品溶液的制备 取“2.1”项下制备的干浸膏适量,再用适量70%乙醇溶解该浸膏,置于200 mL量瓶中,再以70%乙醇稀释至刻度,即得供试品溶液。
2.2.3 标准曲线的绘制 分别精密量取芦丁对照品溶液5.0、6.0、7.0、8.0、9.0、10.0 mL,置于25 mL量瓶中,精密加入5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加入10%硝酸铝溶液1 mL,摇匀,放置6 min,加入氢氧化钠试液10 mL,加70%乙醇定容至刻度,摇匀,静置15 min,得系列质量浓度的对照品溶液,采用紫外分光光度法于480 nm波长处测定芦丁吸光度,以对照品系列质量浓度(x)为横坐标,吸光度(y)为纵坐标,进行线性回归,得回归方程y=0.084 2x+0.000 7(r=0.999 8)。结果,芦丁检测质量浓度线性范围为0.020 6~0.041 2 mg/mL。
2.2.4 精密度试验 精密量取芦丁对照品溶液7 mL,按“2.2.3”项下“精密加入5%……静置15 min”方法操作后,于480 nm波长处连续测定芦丁吸光度6次。结果,芦丁吸光度的RSD为0.08%(n=6),表明仪器精密度良好。
2.2.5 稳定性试验 精密量取“2.2.2”项下供试品溶液5 mL,按“2.2.3”项下“精密加入5%……静置15 min”方法操作后,于室温下放置0、15、30、45、60 min后,于480 nm波长处测定芦丁吸光度。结果,供试品溶液中芦丁吸光度的RSD为1.18%(n=5),表明供试品溶液在60 min内稳定。
2.2.6 重复性试验 精密称取三棱粗粉5 g,置于100 mL圆底烧瓶,按“2.1”项下的方法制备6份,按“2.2.3”项下“精密加入5%……静置15 min”方法操作后,于480 nm波长处分别测定芦丁吸光度。结果,芦丁吸光度RSD为1.99%(n=6),表明重复性良好。
2.2.7 加样回收率试验 精密量取6份“2.2.2”项下供试品溶液5 mL(总黄酮含量为2.97 mg),转移至50 mL容量瓶中,精密加入芦丁对照品溶液20 mL,以70%乙醇补足至刻度,按“2.2.3”项下“精密加入5%……静置15min”方法操作后,于480 nm波长处测定芦丁吸光度,计算芦丁加样回收率及RSD。结果,芦丁平均加样回收率为98.71%,RSD为1.02%(n=6)。
2.3 大孔吸附树脂型号筛选
取不同型号(DM130、HPD100、X-5、NKA-9、AB-8、HP20、D101)的大孔吸附树脂各10 g,分别置于100 mL锥形瓶中,加入三棱提取液50 mL(原液),常温振摇12 h,取出,过滤,得吸附液,旋干,用70%乙醇溶解,定容至50 mL,摇匀,测定吸光度,计算原液总黄酮含量和吸附液中总黄酮含量。将上述过滤后的各类大孔吸附树脂转置于100 mL锥形瓶中,各加30 mL无水乙醇,超声2 h,过滤,收集滤液;再将大孔吸附树脂放于锥形瓶中,再加20 mL无水乙醇,超声20 min,过滤,收集滤液,重复该步骤,直至溶液超声至无色为止;合并收集的滤液,得解吸液,旋干,用70%乙醇溶解,定容至25 mL,摇匀,测定吸光度,计算解吸液总黄酮含量。以吸附率和解吸附率为指标,筛选大孔吸附树脂型号。吸附量(mg/g)=(原液总黄酮含量-吸附液总黄酮含量)/大孔吸附树脂质量;吸附率(%)=[(原液总黄酮含量-吸附液总黄酮含量)/原液总黄酮含量] ×100%;解吸附量(mg/g)=解吸液总黄酮含量/大孔吸附树脂质量;解吸附率(%)=解吸附量/吸附量×100%。结果,型号为HP20的大孔吸附树脂的吸附率和解吸附率最优,因此选用HP20型大孔吸附树脂进行后续试验。大孔吸附树脂型号筛选结果见表1。
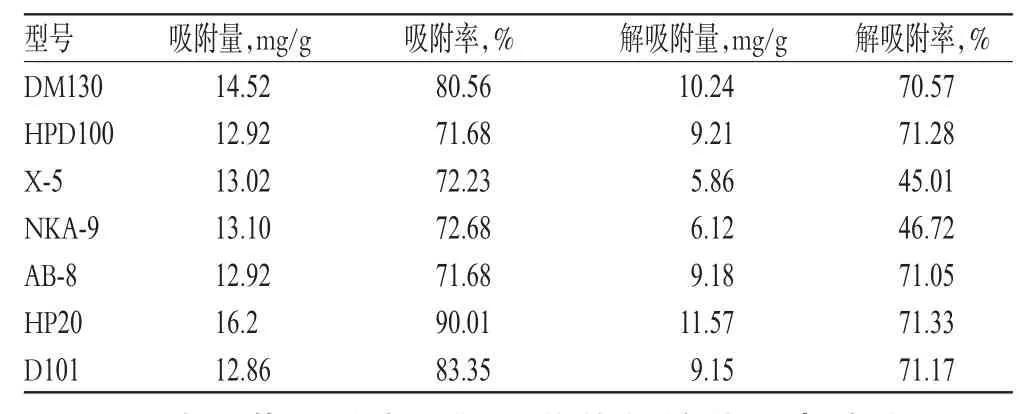
表1 大孔吸附树脂型号筛选结果Tab 1 Screening of macroporous resin types
2.4 三棱总黄酮分离纯化工艺优化的单因素试验
2.4.1 径高比 取HP20型大孔吸附树脂装于5根规格相同的柱子中,使其径高比分别为1∶6、1∶7、1∶8、1∶9,将三棱提取液浓缩成生药质量浓度为0.8 g/mL的上样液,
按照大孔吸附树脂比例分别量取三棱上样液30、35、40、45 mL,调pH为4,以0.5 BV/h的流速上样,至柱面液体略高于大孔吸附树脂,静置1 h后,用水冲柱至流出液无色,再以70%乙醇、1 BV/h流速进行洗脱,收集洗脱液,旋干,用70%乙醇溶解,定容至10 mL,摇匀,测定吸光度,计算总黄酮纯化率(洗脱液总黄酮量/上样液总黄酮量×100%,下同)。结果,当树脂径高比为1∶6、1∶7、1∶8、1∶9时,总黄酮纯化率分别为43.07%、45.74%、45.69%、45.03%,故确定最优径高比为1∶7。
2.4.2 上样液浓度 量取三棱提取液适量,分别浓缩成生药质量浓度为0.4、0.8、1.2、1.6、2.0 g/mL的上样液各50 mL,调pH为4,大孔吸附树脂径高比为1∶7,以0.5 BV/h的流速上样,同“2.4.1”项下方法“至柱面液体略高于大孔吸附树脂……计算总黄酮纯化率”。结果,当提取液上样浓度为0.4、0.8、1.2、1.6、2.0 g/mL时,总黄酮纯化率分别为53.43%、52.98%、52.19%、51.83%、51.12%,故确定最优提取液上样浓度为0.4 g/mL。
2.4.3 上样液流速 量取三棱提取液适量,浓缩成生药质量浓度为0.4 g/mL的上样液,再量取上样液50 mL,各4份,均调pH为4,大孔吸附树脂径高比为1∶7,分别以0.5、1.0、1.5、2.0 BV/h的流速上样,同“2.4.1”项下方法“至柱面液体略高于大孔吸附树脂……计算总黄酮纯化率”。结果,当上样流速为0.5、1.0、1.5、2.0 BV/h时,总黄酮纯化率分别为53.19%、53.14%、51.44%、51.12%,故确定最优上样液流速为0.5 BV/h。
2.4.4 上样液pH 量取三棱提取液适量,浓缩成生药质量浓度为0.4 g/mL的上样液,再量取上样液50 mL,各4份,调pH分别为2、4、6、8,大孔吸附树脂径高比为1∶7,以0.5 BV/h流速上样,同“2.4.1”项下方法“至柱面液体略高于大孔吸附树脂……计算总黄酮纯化率”。结果,当上样液pH分别为2、4、6、8时,总黄酮纯化率分别为44.85%、58.61%、57.09%、50.35%,故确定最优上样液pH为4。
2.4.5 洗脱液流速 量取三棱提取液适量,浓缩成生药质量浓度为0.4 g/mL的上样液,再量取上样液50 mL,各4份,调pH为4,大孔吸附树脂径高比为1∶7,以0.5 BV/h的流速上样,至柱面液体略高于大孔吸附树脂,静置1 h后,用水冲柱至流出液无色,加70%乙醇,分别以1、2、3、4 BV/h进行洗脱,收集洗脱液,旋干,用70%乙醇溶解,定容至10 mL,摇匀,测定吸光度,计算总黄酮纯化率。结果,当洗脱液流速分别为1、2、3、4 BV/h时,总黄酮纯化率分别为62.14%、57.33%、59.24%、55.58%,故确定最优洗脱液速度为1 BV/h。
2.4.6 洗脱液浓度 量取三棱提取液适量,浓缩成生药质量浓度为0.4 g/mL的上样液,再量取上样液50 mL,各7份,调pH为4,大孔吸附树脂径高比为1∶7,以0.5 BV/h的流速上样,至柱面液体略高于大孔吸附树脂,静置1 h后,用水冲柱至流出液无色,分别加30%、40%、50%、60%、70%、80%、90%乙醇,以1 BV/h进行洗脱,收集洗脱液,旋干,用70%乙醇溶解,定容至10 mL,摇匀,测定吸光度,计算总黄酮纯化率。结果,当洗脱液浓度分别为30%、40%、50%、60%、70%、80%、90%时,总黄酮纯化率分别为25.36%、30.14%、50.84%、57.72%、68.59%、62.13%、61.15%,故确定最优洗脱液浓度为70%。
2.5 三棱总黄酮分离纯化工艺响应面试验
2.5.1 试验设计 根据单因素试验,笔者发现上样液pH、洗脱液流速、洗脱液浓度3个因素对总黄酮纯化率影响最大,因此使用Design-Expert 8.06软件,根据中心组合试验Box-Behnken设计原理选择上样液pH(A)、洗脱液流速(B)、洗脱液浓度(C)作为影响因素(自变量),总黄酮纯化率(Y)作为评价指标(响应值),优化三棱总黄酮的纯化工艺,因素与水平见表2,试验设计与结果见表3。

表2 因素与水平Tab 2 Factors and levels
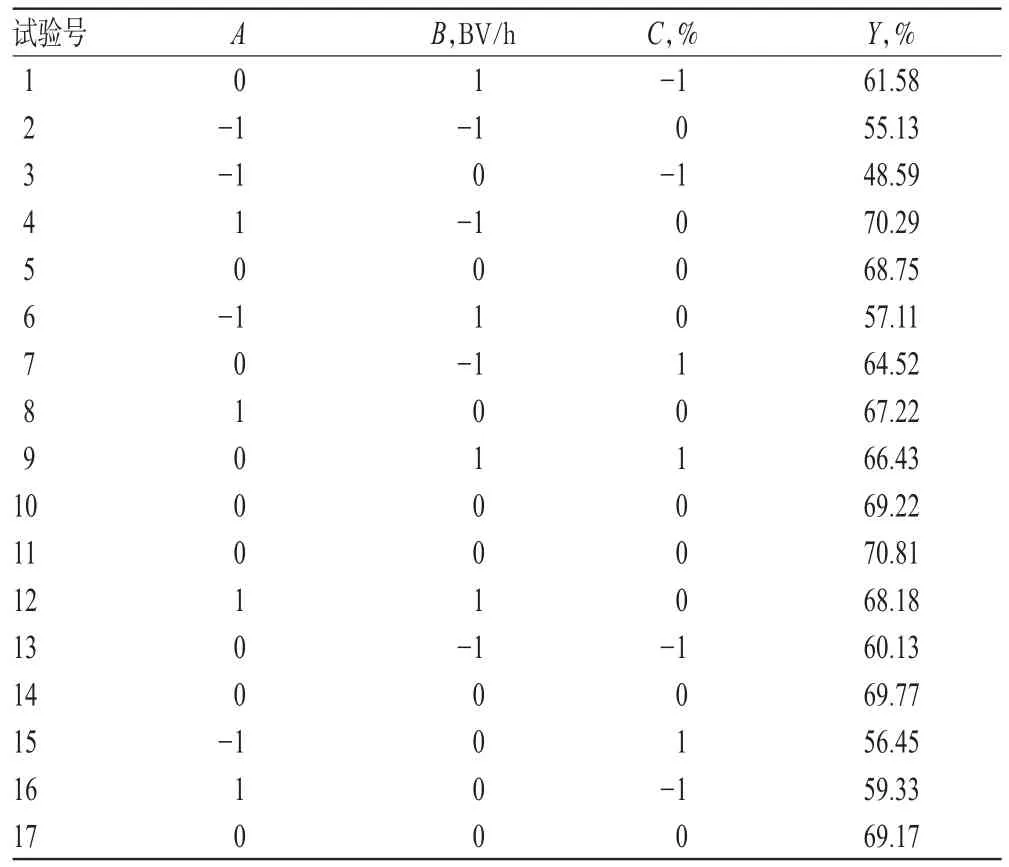
表3 试验设计与结果Tab 3 Design and results of test
2.5.2 模型建立与方差分析 采用Design-Expert V 8.0.6软件进行结果统计,并分析处理数据,得到二次多项回归方程Y=69.54+6.04A+0.40B+3.05C-1.02AB-0.14AC+0.12BC- 0.599A2- 2.17B2- 8.93C2(R2=0.824 2)。方差分析结果见表4。
由表4可知,三棱总黄酮的纯化工艺模型的P<0.000 1,表明该回归模型显著,用该模型对三棱总黄酮的纯化工艺进行分析试验是合理的。根据表4中F值大小,推测影响本试验总黄酮纯化率的因素大小顺序为A>C>B。
2.5.3 响应面分析 采用Design-Expert V 8.0.6软件分析,得出三棱总黄酮纯化率各因素交互作用的响应面图。各因素与三棱总黄酮纯化率之间的等高线图和响应面图见图1。
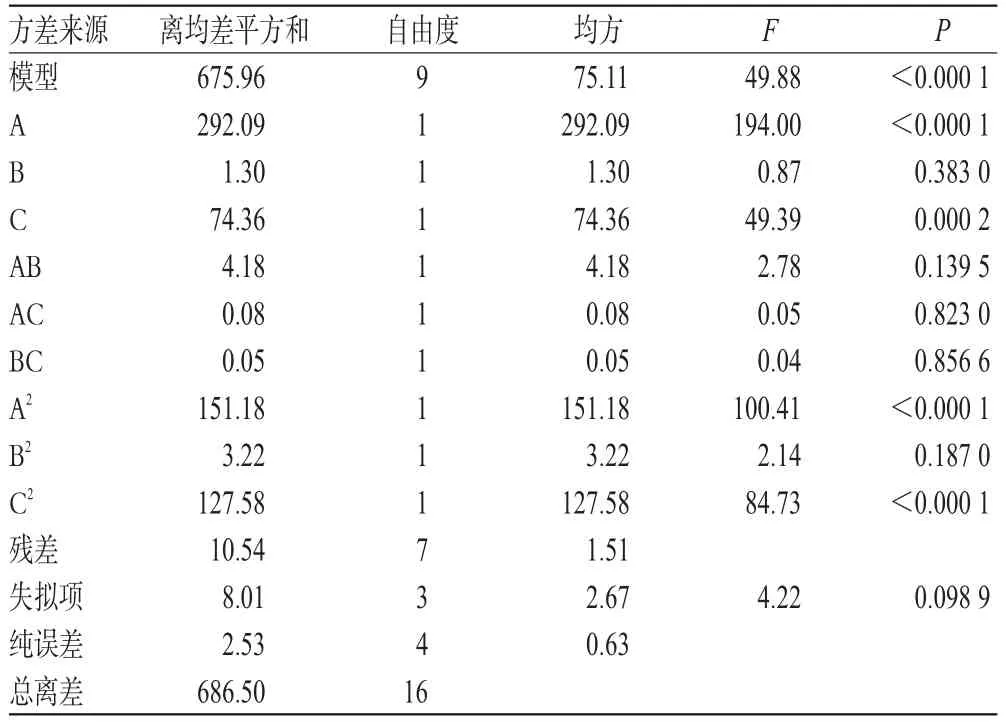
表4 方差分析结果Tab 4 Analysis of variance
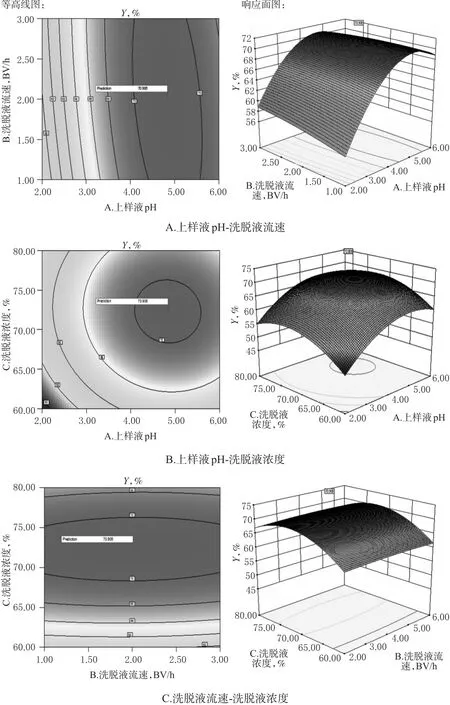
图1 各因素与三棱总黄酮得率之间的等高线图和响应面图Fig 1 Contour plot and response surface plot of each factor to the yield of total flavonoids of S.stoloniferum
由图1可知,因素A的曲面较陡峭,提示因素A对响应值影响显著,这一结果与方差分析的结果一致。最后,经Design-Expert V 8.0.6软件优化得出三棱总黄酮的分离纯化工艺条件为上样液pH 4.83,洗脱流速2.01 BV/h,洗脱液浓度为72.30%。结合可行性及实际所需,最终修正其为上样液pH 4.8,洗脱液流速2.0 BV/h,洗脱液浓度72%。
2.6 验证试验
取三棱提取液50 mL 3批,浓缩成生药质量浓度为0.4 g/mL的上样液,调整上样液pH至4.8,大孔吸附树脂径高比为1∶7,以0.5 BV/h的流速上样,至柱面液体略高于大孔吸附树脂,静置1 h后,用水冲柱至流出液无色,加72%乙醇,以2.0 BV/h进行洗脱,收集洗脱液,旋干,用70%乙醇溶解,定容至10 mL,摇匀,测定吸光度。结果,3批样品纯化后的总黄酮纯化率为72.34%(RSD=1.77%,n=3)(纯度为40.83%),与预测值(73.99%)的相对误差为2.13%,提示该优化工艺可靠。
3 讨论
目前对于三棱的药理作用已有很多研究[8],其中三棱总黄酮是其主要的有效成分,但是在本课题组前期研究中发现,三棱总黄酮的含量较少,为了深入三棱药材的研究,笔者在前期试验的基础上,对三棱总黄酮的纯化工艺进行优化。Box-Behnken设计-响应面法是优化纯化工艺条件的常用方法,具有试验次数少、精度高、预测值精准的优点,本试验采取单因素试验结合Box-Behnken设计-响应面法优化三棱总黄酮分离纯化工艺,在试验中发现三棱提取液经上样后,使用水洗脱,可去掉大部分杂质;30%、40%、50%、60%乙醇洗脱后,三棱总黄酮纯化率较低,70%、80%乙醇洗脱后,三棱总黄酮纯化率较高,由此推测,三棱总黄酮成分极性不大,可能与70%~80%乙醇极性较为接近,从而较容易洗脱;验证试验结果发现,优化后的工艺稳定,重现性与可预测性良好,有效地提高了三棱总黄酮纯化率。因此笔者在课题后续试验中,可以对纯化后的三棱总黄酮与未纯化的三棱总黄酮进行化学成分分析,并深入了解三棱总黄酮的药理药效作用,为三棱总黄酮的开发和利用提供一定的参考。

