牙鲆efhd2和tbc1d25基因的克隆和表达分析*
侯吉伦 郭亚男 付元帅 王桂兴 张晓彦 孙朝徽 司 飞 王玉芬①
(1.中国水产科学研究院北戴河中心实验站 秦皇岛 066100; 2.上海海洋大学水产与生命学院 上海 201306)
水产品是人类优质动物蛋白的重要来源。我国是世界上最大的水产动物养殖国,产量已连续多年位居世界首位。在多年的高速发展过程中,制约养殖产业健康可持续发展的不利因素逐渐显现出来,对水产养殖业的产量和效益造成严重影响。在众多传染性病害中,病毒性疾病所造成的影响尤为严重。隶属于虹彩病毒科(Iridoviridae)的淋巴囊肿病毒为重要病原之一,该病毒粒子正面观为六角形的正二十面体构造,因所依赖的宿主细胞不同,病毒粒子大小有差异,直径介于130~350 nm之间,由核心体、中间脂质层和衣壳三部分组成(Papernaet al,2001; Anders,1989)。目前,淋巴囊肿病毒呈世界性分布,造成9目42科125种以上鱼类感染此病,其中,海水鱼占30科(Wolf,1988)。病鱼在身体躯干、口等部位可见不同形状的囊肿物,虽致死率不高,但使患病鱼失去商品价值 (侯吉伦等,2017)。
牙鲆(Paralichthys oliνaceus)为底栖冷水性鱼类,具有生长迅速、肉质鲜美、营养价值高、适宜集约化工厂养殖等特点,已成为我国北方的主要海水鱼类增养殖品种之一(司飞等,2017)。1997年,我国养殖的牙鲆首次出现淋巴囊肿病,并逐渐成为危害牙鲆养殖业的重要疾病之一。针对牙鲆淋巴囊肿病,国内外学者开展了大量的研究,并取得了相应的研究进展(Fujiet al,2006; Zhenget al,2010; Hwanget al,2011; Fanet al,2014; Wuet al,2015、2018)。为了在我国选育牙鲆抗淋巴囊肿新品种以及在分子层面解析抗病机理,作者在前期利用高通量测序技术对淋巴囊肿抗病和患病牙鲆头肾组织进行了转录组分析,筛选获得了包括efhd2和tbc1d25在内的一批和抗病性紧密相关的功能基因。
EF-hand蛋白结构域D2(EF-hand domain-containing protein D2,EFHD2),又称为 Swiprosin-1,是一个高度保守的钙结合蛋白,属于EF-hand结构域家族,位于细胞膜脂肪微区域(Vuadenset al,2004)。EFHD2 在其C-端有1个保守的卷曲螺旋结构域,为蛋白质-蛋白质相互作用所必需的;在 N-末端,则具有独特的多聚丙氨酸基序(大小为6~9个丙氨酸)。EFHD2广泛表达于包括B细胞、CD4+/CD8+T细胞、自然杀伤细胞和外周血单个核细胞等各类细胞,在免疫调控起到重要的调控作用(Vega,2016)。EFHD2可通过调节适应性和先天性免疫受体信号的关键因子Src激酶的活性而参与免疫细胞活化(Kroczeket al,2010);调节未成熟 B细胞的寿命和 BCR信号阈值;同时,作为NF-kappa-B信号通路的负调节因子,通过bcl2l1丰度的调节实现自发性凋亡的调控(Avramidouet al,2007; Kimet al,2013)。
TBC1D25(TBC1 domain family member 25),又称为OATL1,属于TBC家族,含有一段长约200个氨基酸的保守TBC(Rab-GAP)结构域。TBC结构域蛋白通过特异性识别Rab小GTP酶参与到细胞信号传导、肿瘤形成及细胞内其他的活动(Fukuda,2011)。TBC1D25被鉴定为一种新的Atg8同源结合蛋白,通过与 Atg8同系物直接相互作用被招募至自噬体(Itohet al,2011)。同时,作为 Rab33B(一种结合 Atg16L1的Rab蛋白)的GTP酶激活蛋白过表达促进GTP酶RAB33B从GTP结合蛋白向GDP结合蛋白的平衡,进而调节自噬体和溶酶体之间的融合来延迟自噬体的成熟,从而实现抑制自噬的作用(Itohet al,2017; Coronaet al,2018)。
鉴于efhd2和tbc1d25在免疫调控中的重要作用,本研究首先利用 RACE 法(Rapid-amplification of cDNA ends)克隆了牙鲆efhd2和tbc1d25的cDNA全序列,并对序列特征进行了生物信息学分析,同时,通过荧光定量 PCR技术,研究了它们在牙鲆淋巴囊肿抗病和患病个体各组织、胚胎发育不同阶段的表达特征,以期为阐明efhd2和tbc1d25在牙鲆抗淋巴囊肿病中的作用奠定基础。
1 材料与方法
1.1 实验材料
牙鲆淋巴囊肿抗病和患病个体取自中国水产科学研究院北戴河中心实验站昌黎养殖基地,体重为(235.65±73.18) g,全长为(30.49±3.17) cm。选取体表无淋巴囊肿瘤状物的 3尾抗病牙鲆和有淋巴囊肿瘤状物的3尾患病牙鲆(侯吉伦等,2017),分别取全血、鳃、肝脏、头肾、肠、性腺、肌肉、心脏和脾脏等置于液氮中速冻,48 h后置于-80℃保存备用。实验所用牙鲆不同发育时期胚胎的按照刘海金等(2008)的方法进行制备,受精卵在(16.0±0.5)℃的海水中孵化,采集受精卵(受精后 0 h,下同)、4 细胞(2 h)、32 细胞(4 h)、128 细胞(5 h)、高囊胚(6 h)、低囊胚(11 h)、原肠早期(15 h)、原肠晚期(27 h)、肌节期(32 h)、心跳期(55 h)和出膜仔鱼(62 h)样品,于液氮中速冻,48 h后置于-80℃保存备用。
1.2 RNA提取及cDNA合成
采用Trizol法对本研究所需各样本的总RNA进行提取,琼脂糖凝胶电泳检测所提取总RNA质量,微量紫外分光光度计(Pultton P100+)测定RNA浓度。经检测合格后的 RNA,用 cDNA试剂盒(Thermo K1621)反转录获得cDNA模板。
1.3 基因全长序列的克隆
根据牙鲆全基因组(Shaoet al,2017; Weiet al,2017)和 GenBank数据库中登记的牙鲆efhd2(XM_ 020089176.1)和tbc1d25(XM_020089412.1)基因序列,利用 Primer Premier 6.0 设计引物(efhd2-F/efhd2-R,tbc1d25-F/tbc1d25-R,表1),以头肾cDNA为模板进行PCR扩增,验证核心片段的准确性。PCR反应体系:上下游引物各 0.6 μl,模板 cDNA 1 μl,PCR Mix 7.5 μl,加 ddH2O 至 15 μl。PCR 反应程序为:94℃预变性 5 min;94℃ 30 s,60℃退火 30 s,72℃延伸30 s,为35个循环;72℃延伸 10 min。PCR产物经琼脂糖凝胶电泳、回收纯化,克隆至pMD18-T载体,转化至Top10感受态细胞,取3个阳性克隆进行测序。
在此基础上,利用Primer Premier 6.0分别设计5'和 3'端的接头引物和特异性引物(表1),并采用RACE法,以牙鲆淋巴囊肿抗病个体头肾RNA为模板,进行降落PCR和巢式PCR。PCR产物经纯化、克隆、测序等步骤,获得5'和3'端序列。利用SnapGene4.1软件,对所获得的5'和3'RACE序列以及中间片段进行拼接,获得efhd2和tbc1d25的cDNA全长序列。
1.4 基因的生物信息学分析
氨基酸序列用 ExPASy (http://www.expasy.ch/ tools/dna.html)进行分析;蛋白质结构预测使用SMART(http://smart.embl-heidelberg.de);信号肽使用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/ SignalP/)进行寻找;用 TMHMM server v.2.0 分析氨基酸跨膜区(http://www.cbs.dtu.dk/services/TMHMM-2.0/); 采用 ClustalX2对氨基酸序列进行多重比对。使用MEGA10.0软件的 Neighbor-Joining(NJ)法构建系统进化树(Bootstrap=1000)。
1.5 荧光定量 PCR
根据牙鲆efhd2、tbc1d25和β-actin(内参基因)基因序列,分别设计目的基因和内参的引物(表1),并以淋巴囊肿抗病和患病个体不同组织以及胚胎发育 不同时期的cDNA为模板,进行荧光定量PCR检测。定量检测采用 Power SYBR Green PCR Master Mix (ABI,美国)试剂盒在 ABI 7900 PCR 仪上开展。基因的相对表达量用 2-ΔΔCt法分析(马慧鑫等,2018)。所有样品均设置 3个平行,结果以平均值±标准误(Mean±SE)表示,并利用SPSS 19.0软件进行单因素方差分析(One-way ANOVA) (P<0.05)。
2 结果与分析
2.1 牙鲆efhd2与tbc1d25基因序列分析
本研究克隆到的牙鲆efhd2基因cDNA全长5231 bp,其中,5'非翻译区(Untranslated region,5'UTR)长度 142 bp,3'UTR 长度 4390 bp。ORF 长度699 bp,编码 232 个氨基酸,预测分子量为26.4 kDa,等电点约为5.08。牙鲆efhd2基因所编码的蛋白在第89~117以125~153位氨基酸具有2个典型的EF-hand结构域(图1)。

表1 牙鲆efhd2和tbc1d25基因序列扩增和定量PCR引物信息Tab.1 Primers information for cloning and Q-PCR of efhd2 and tbc1d25 in Paralichthys oliνaceus
tbc1d25基因全长为3173 bp,其中,5'UTR长度为 108 bp,3'UTR长度为464 bp。ORF长度为2601 bp,编码866个氨基酸,预测分子量为96.4 kDa,等电点约为5.47。TBC1D25蛋白在199~431位氨基酸为典型的TBC结构域(图2)。
SignalP分析未发现EFHD2和TBC1D25蛋白具有信号肽。TMHMM分析显示,这 2个蛋白均无跨膜区。采用 ExPASy网站(http://web.expasy.org/)的GOR4工具预测EFHD2与TBC1D25蛋白质的二级结构。EFHD2 蛋白的 α-螺旋(Alpha helix,Hh)包含 150个氨基酸残基,占氨基酸残基总量的 64.38%;延伸链(Extended strand,Ee)包含 10个氨基酸残基,占氨基酸残基总量的4.29%;无规卷曲(Random coil,Cc)包含73个氨基酸残基,占氨基酸残基总量的31.33%。在TBC1D25蛋白中,α-螺旋包含274个氨基酸残基,占氨基酸残基总量的31.60%;延伸链包含 109个氨
基酸残基,占氨基酸残基总量的 12.57%;无规卷曲包含484个氨基酸残基,占氨基酸残基总量的55.82%。较之于EFHD2蛋白,TBC1D25蛋白α-螺旋含量比例少,而延伸链和无规卷曲的含量比例较高。

图1 牙鲆efhd2基因核苷酸序列及推测的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of P.oliνaceus efhd2

图2 牙鲆tbc1d25基因核苷酸序列及推测的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of P.oliνaceus tbc1d25
2.2 多序列比对与系统发育树分析
将 EFHD2蛋白分别与斑马鱼(Danio rerio)(NP_ 001313422.1)、青鳉(Oryzias latipes)(XP_023812778.1)、小鼠(Mus musculus)(NP_080270.2)和人(Homo sapiens) (NP_077305.2)的同源序列蛋白进行比较,序列一致性分别为83%、88%、73%和72%(图3)。利用NJ法对牙鲆EFHD2蛋白与其他8个物种的EFHD2蛋白氨基酸序列进行系统进化树构建,结果显示,牙鲆EFHD2 与半滑舌鳎(Cynoglossus semilaeνis)聚为一小支,随后与青鳉、大西洋鲑(Salmo salar)、鲫鱼(Carassius auratus)和斑马鱼聚为一大支,而小鼠、人和牛(Bos taurus)等哺乳动物则聚为另一支(图4)。
TBC1D25蛋白斑马鱼(NP_001121708.10)、青鳉(XP_011471287.2)、小鼠(NP_001159909.1)和人(NP_ 001335191.1)的同源序列一致性分别为 71%、74%、72%和74%(图5)。进化树结果表明,牛、小鼠和人等哺乳动物聚为另一支,6种鱼类聚为另一支,牙鲆在鱼类所构成的一支中,先与半滑舌鳎聚为一支,再与青鳉、大西洋鲑、鲫鱼和斑马鱼聚为一大支(图6)。
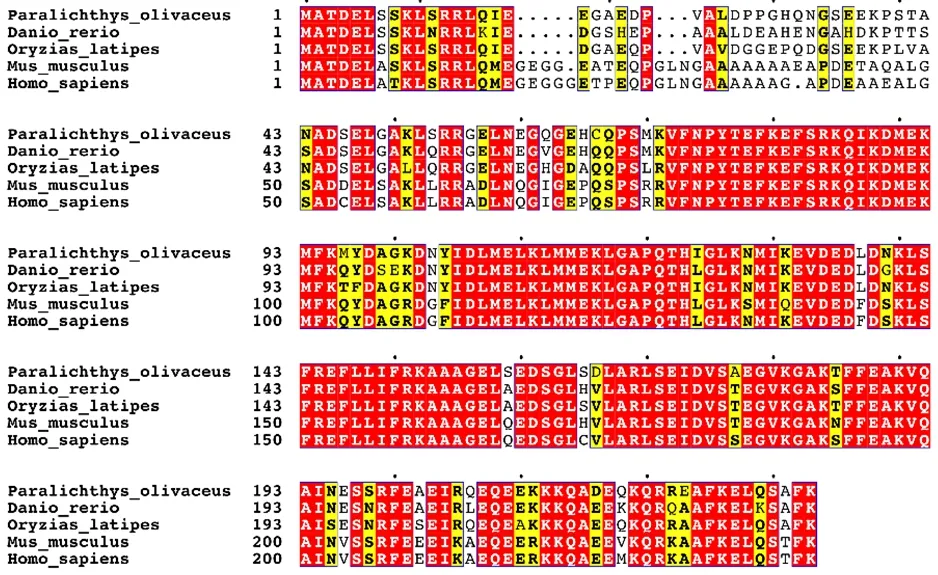
图3 牙鲆EFHD2氨基酸多重序列比对结果Fig.3 The multiple sequence alignment of the EFHD2 amino acid
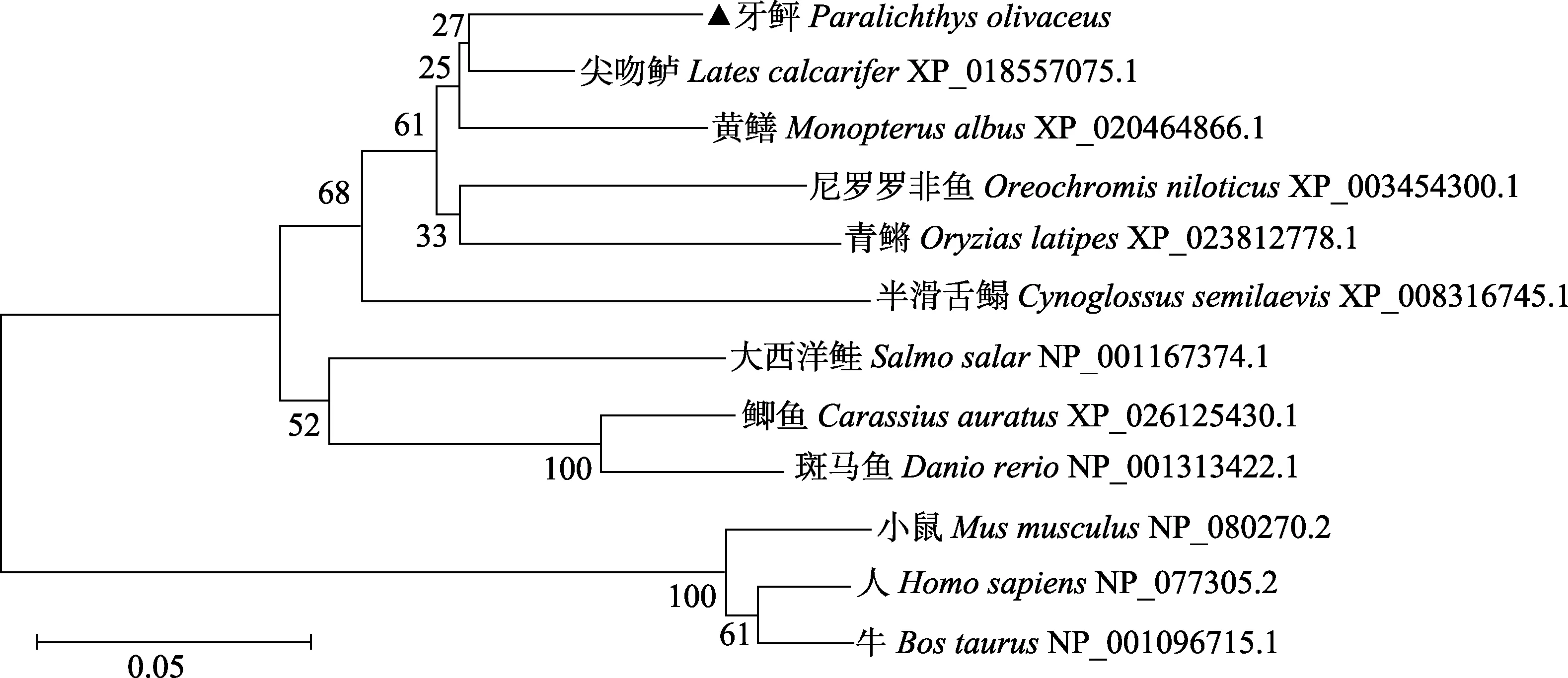
图4 牙鲆EFHD2与其他物种EFHD2系统进化分析Fig.4 Phylogenetic analysis of P.oliνaceus EFHD2 amino acid sequence with EFHD2 sequences of other species
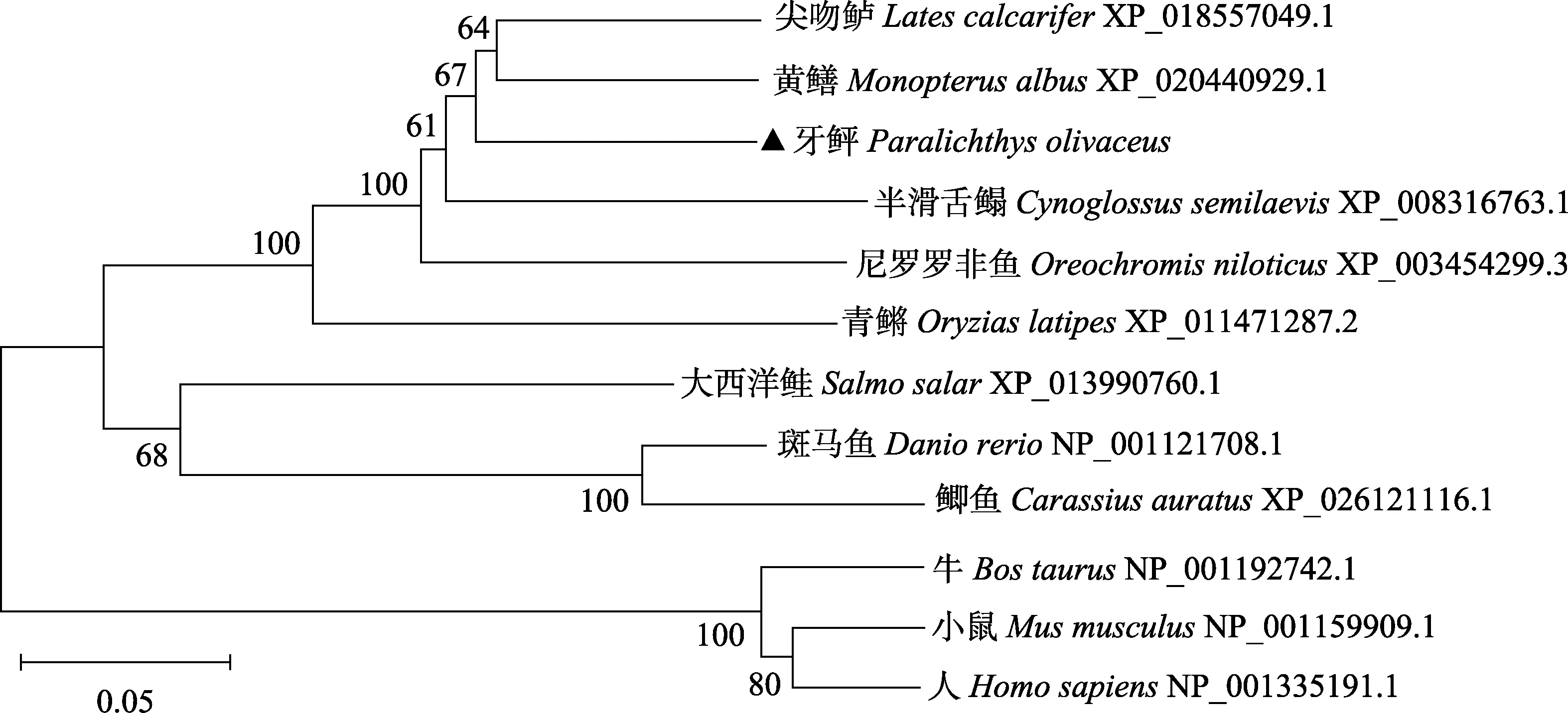
图6 牙鲆TBC1D25与其他物种TBC1D25系统进化分析Fig.6 Phylogenetic analysis of P.oliνaceus TBC1D25 amino acid sequence with TBC1D25 sequences of other species
2.3 牙鲆efhd2与tbc1d25基因在胚胎发育各时期的表达
以β-actin为内参基因,利用荧光定量PCR检测了牙鲆受精卵、4细胞、32细胞、128细胞、高囊胚、低囊胚、原肠早期、原肠晚期、肌节期、心跳期和出膜仔鱼中efhd2与tbc1d25mRNA的表达情况,并以原肠早期为基准进行相对表达量的计算。结果显示,efhd2基因在胚胎发育的各个时期均有不同程度的表达(图7),但在 4细胞、低囊胚和原肠早期的表达量相对较低,与其他时期差异显著(P<0.05);从肌节期开始,efhd2的表达量开始呈上升趋势,且在出膜仔鱼中的表达量,显著高于其他各组(P<0.05)。

图7 牙鲆efhd2基因在胚胎发育不同时期的相对表达Fig.7 The relative expression level of P.oliνaceus efhd2 in different embryo development stage
tbc1d25基因在胚胎发育的各个时期也均有不同程度的表达(图8)。其中,受精卵中的表达量显著高于其他时期(P<0.05);随着发育的进行,tbc1d25基因的表达量在原肠晚期降至最低(P<0.05);在之后的发育时期中,原肠晚期、肌节期和心跳期的表达量差异不显著(P>0.05);出膜仔鱼中tbc1d25的表达量又有一定的上升,显著高于除受精卵和32细胞之外的其他时期(P<0.05)。

图8 牙鲆tbc1d25基因在胚胎发育不同时期的相对表达Fig.8 The relative expression level of P.oliνaceus tbc1d25 in different embryo development stage
2.4 牙鲆efhd2与tbc1d25基因在淋巴囊肿抗病和患病个体中的差异表达
以患病组性腺为基准进行efhd2和tbc1d25基因相对表达量的计算。efhd2基因在所检测的淋巴囊肿抗病和患病个体的头肾、肝脏、血液、鳃、心脏、性腺、肌肉、肠和脾脏等组织中均有表达(图9)。其中,在抗病鱼的血液、鳃、性腺、肌肉和脾脏的相对表达量要高于患病鱼,特别是在血液中,抗病鱼efhd2基因的表达量高于患病鱼,差异显著(P<0.05)。
与efhd2基因相似,tbc1d25基因在所检测的各个组织中也均有表达(图10)。其中,在抗病鱼的肝脏、血液、性腺的相对表达量要高于患病鱼,特别是在血液中的表达量,二者差异极显著(P<0.01)。

图9 牙鲆efhd2基因在淋巴囊肿抗病和患病 个体不同组织的相对表达Fig.9 The relative expression level of P.oliνaceus efhd2 in different tissues of lymphocystis disease resistant and sensitive individuals
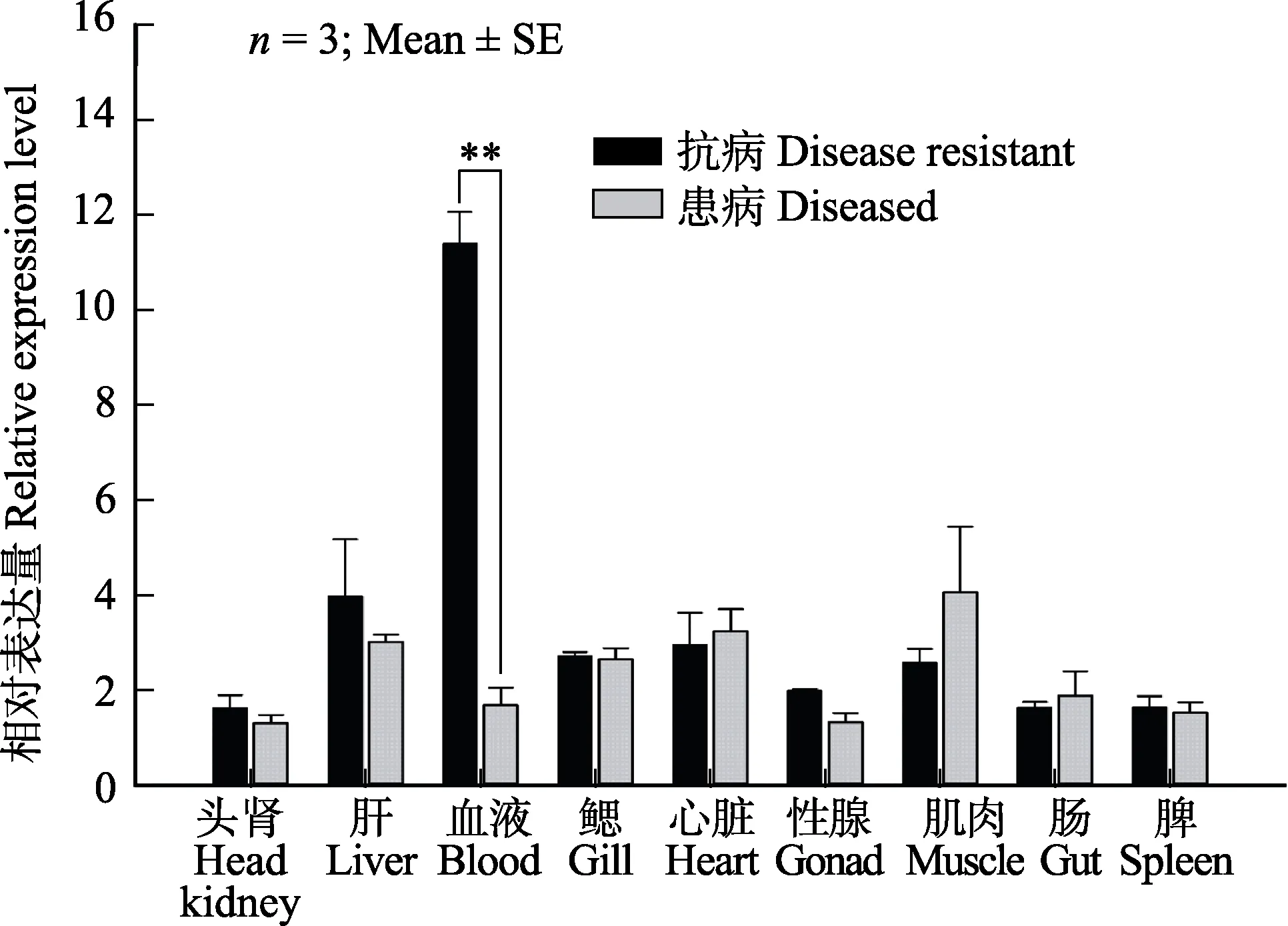
图10 牙鲆tbc1d25基因在淋巴囊肿抗病和 患病个体不同组织的相对表达Fig.10 The relative expression level of P.oliνaceus tbc1d25 in different tissues of lymphocystis disease resistant and sensitive individuals
3 讨论
本研究克隆获得了牙鲆efhd2和tbc1d25基因的cDNA全序列,序列分析表明,上述2个基因都含有各自家族典型的结构域。同源性比较和系统进化树分析显示,在鱼类中,2个基因与其他鱼种具有较高的同源性,在进化上表现出一定的保守性。目前,关于efhd2和tbc1d25基因功能的研究,开展的较少,在鱼类上尚未见报道。
本文首次对efhd2和tbc1d25基因在牙鲆胚胎发育不同时期的表达模式进行了研究,在胚胎发育的各个时期,2个基因均有不同程度的表达。efhd2基因在受精卵中有一定量的表达,表明其可能为母源效应基因。其表达量在经过卵裂期到原肠晚期的低水平表达后,从肌节期开始,又显著上升。efhd2是高度保守的钙结合蛋白,在神经和免疫细胞的Ca2+信号传导中起重要作用(Brachset al,2013)。在牙鲆的胚胎发育中,自原肠后期开始,神经胚开始逐渐形成,神经细胞被大量生成,efhd2基因在原肠后期开始所出现的表达水平提高,可能与之有关。
在所研究的胚胎发育各时期中,tbc1d25基因在受精卵的表达量最高,表明其也是母源效应基因。tbc1d25所属的TBC基因家族是真核细胞保守的膜转运蛋白,参与膜转运的各种步骤,包括囊泡形成、沿细胞骨架的囊泡运输、运输囊泡与靶膜的锚定/对接、以及运输囊泡与靶膜的膜融合等(Pereira-Lealet al,2001; Grosshanset al,2006; Schwartzet al,2007; Fukuda,2008; Stenmark,2009; Frasa,2012)。而在胚胎发育的各阶段,都离不开膜转运的参与,因此,tbc1d25在此过程中可能起到一定的作用。
本研究中,牙鲆淋巴囊肿抗病个体血液中efhd2和tbc1d25基因的表达量都显著高于患病个体。鱼类免疫相关基因在血液中高表达的现象,在以往的研究中也有所报道。例如,在罗非鱼的11个组织中,血液里TRIM16和TRIM25的表达量最高(郑建美等,2017)。血液是机体内不同器官间物质的传输介质。在牙鲆淋巴囊肿患病个体的心脏、头肾、脾脏和肠等内脏器官中均可检测到淋巴囊肿病毒颗粒(曲凌云等,2000)。Kinne(1984)认为,鳃可能是淋巴囊肿病毒感染牙鲆的一个门户。病毒进入鳃之后,就需要通过连接各内脏器官的液体介质——血液进行传播。除了作为传输介质,血液也是重要的免疫器官,是T淋巴细胞、B淋巴细胞等各类免疫细胞的天然携带者,可在体内免疫应答过程中执行关键的生理和生化功能。随着血液流经整个机体,会将大量的免疫细胞从一个器官转移到另一个器官,从而充当免疫系统管道的角色,在鱼类疾病防治中发挥着重要的作用(Dalmoet al,1997; Castilloet al,1998)。就淋巴囊肿病毒感染而言,当病毒颗粒通过血液在不同器官间传输时,可能会激活血液中相关免疫细胞的免疫反应,从而导致包括efhd2和tbc1d25等在内的一系列基因的高表达。但有趣的是,efhd2的功能是促进细胞凋亡,而tbc1d25的潜在作用则是抑制自噬。细胞凋亡和自噬之间存在着复杂的调控关系,彼此之间既可相互促进(Gorskiet al,2003),也可互为拮抗(Younget al,2006; Zenget al,2012; Hassanet al,2015; Chenet al,2016)。就本研究而言,淋巴囊肿病毒感染牙鲆后,抗病个体血液中的细胞凋亡和自噬互为拮抗关系。通过较高水平的细胞凋亡,达到对因病毒感染所损伤血液细胞的消除,从而恢复血液组成的动态平衡,这可能对维持病毒感染后鱼体的正常生理水平和实现鱼体的抗病功能具有重要的作用。
作为重要的免疫器官,头肾和脾的免疫功能已被广泛研究(Yanget al,2016; 张文婷等,2016; 郑建美等,2017)。免疫功能基因在头肾和脾的表达量,受多种因素所影响,并不一定高于其他组织。在半滑舌鳎中,TLR5S基因在肝脏中的表达量最高,而在脾的表达量最低(张文婷等,2016)。在本研究中,淋巴囊肿抗病和患病个体头肾和脾efhd2和tbc1d25基因的表达量差异不显著,其可能原因为efhd2和tbc1d25基因在淋巴囊肿病毒进入鱼体经血液向其他组织扩散的阶段起到免疫作用,但具体原因有待于深入研究。
综上所述,本研究报道了牙鲆efhd2和tbc1d25基因的分子特征,分析了它们不同胚胎发育过程以及淋巴囊肿抗病和患病不同组织的表达情况特征,为进一步研究二者的功能和牙鲆淋巴囊肿抗病机理奠定了一定的理论基础。

