二肽基肽酶-Ⅳ抑制剂通过激活ERK1/2和NF-κB信号通路促进2型糖尿病小鼠主动脉血管钙化
王 征,伍成文,陈 豪,施 森,曾 宏,刘 勇
在全球范围内,糖尿病患者人数呈快速增长趋势,其中伴有心血管疾病的糖尿病患者死亡率风险是正常人群的1.7倍[1]。糖尿病患者血管中普遍存在钙化情况,而血管钙化是引起心血管高发病率与死亡率的重要原因[2]。伴有血管钙化的糖尿病患者病情复杂,引发的并发症种类多,治疗难度大,因而对于糖尿病患者采取血管钙化预防及相关作用机制的研究十分重要。二肽基肽酶-Ⅳ(dipeptidyl peptidase-4,DPP-4)是一种腺苷脱氨酶结合蛋白,能参与胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)和抑胃肽(glucose-dependent insulinotropic polypeptide,GIP)的降解,从而维持人体血糖稳定,在糖尿病的发生及发展中发挥着至关重要的作用[3]。Choi等[4]研究显示,在给予糖尿病小鼠DPP-4抑制剂干预后,小鼠体内血糖含量明显降低,同时其血管钙化程度也显著减轻,提示抑制DPP-4能有效改善糖尿病小鼠血管钙化程度。Yang等[5]研究证实血管钙化程度与细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)通路的激活相关,而Song等[6]认为kappa基因相结合的核因子(nuclear factor-kappa gene binding,NF-κB)信号通路参与血管钙化的全过程。但是,在糖尿病中,通过抑制DPP-4改善的主动脉血管钙化是否与激活ERK1/2与NF-κB信号通路相关尚且未知。本研究在建立小鼠2型糖尿病模型后,通过对比研究DPP-4调控糖尿病小鼠主动脉血管钙化与ERK1/2、NF-κB信号通路的关系,旨在为临床预防及治疗糖尿病主动脉钙化提供理论参考。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组 C57BL/6雄性小鼠,体质量(20±2)g,购自北京维通利华生物科技有限公司,动物合格证:SYXK(京)2016-0038。动物适应环境3 d后,直接腹腔注射链脲霉素(STZ)溶液(150 mg/kg),3 d后尾静脉取血测量血糖,选择血糖浓度超过16.7 mmol/L造模成功的糖尿病小鼠进行随机分组,分为糖尿病组:糖尿病小鼠+高糖高脂饲料;西格列汀组:糖尿病小鼠+高糖高脂饲料+西格列汀饮食[高糖高脂饲料混合0.3%西格列汀,剂量为200 mg/(kg·d)];PD98059组:糖尿病小鼠+高糖高脂饲料+ERK抑制剂[腹腔注射PD98059,10 mg/(kg·d)];BAY117082组:糖尿病小鼠+高糖高脂饲料+NF-κB抑制剂(腹腔注射BAY117082,5 mg/kg,每周3次);PD+BAY组:糖尿病小鼠+高糖高脂饲料+ERK与NF-κB抑制剂[腹腔注射PD98059,10 mg/(kg·d);腹腔注射BAY117082,5 mg/kg,每周3次]。选择未进行STZ溶液腹腔注射的小鼠作为对照组:非糖尿病小鼠+高糖高脂饲料。每组6只,持续喂养4周。
1.1.2 主要试剂与仪器 4%多聚甲醛(谷歌生物科技有限公司);水合氯醛(国药集团化学试剂有限公司);品红溶液(美国AMRESCO公司);辣根过氧化物酶、BCA蛋白定量试剂盒、AB显影液、ERK/p-ERK/NF-κB抗体(美国Cell Signaling公司);凝胶成像系统(上海培清科技有限公司);光学显微镜(日本Olympus公司)。
1.2 方法
1.2.1 血糖、血清因子含量测定 直接摘取小鼠眼球进行取血,一部分直接用于血糖检测;另一部分,4 ℃静置2 h后离心10 min,3 000 r/min,移取血清,留作用于测定血清中DPP-4浓度。
1.2.2 主动脉钙离子含量测定 分离得到小鼠腹主动脉血管后,按照钙离子测定试剂盒操作说明书操作。
1.2.3 主动脉Von Kossa钙化染色 分离小鼠腹主动脉血管,4%多聚甲醛固定后进行石蜡包埋、切片、脱蜡、酒精脱水后浸泡于5%硫代硫酸钠溶液中,强阳光下光照射1 h,蒸馏水冲洗3次后加入2.5%浓度的硫代硫酸钠溶液反应5 min进行定影,依次进行中性品红复染3 min、脱水、封片,在光学显微镜下观察并拍照。
1.2.4 免疫组化测定 将组织进行石蜡包埋后切片,进行脱蜡处理,缓冲液清洗2次(每次5 min),滴加一抗液体,依次孵育ERK/NF-κB,37 ℃2 h,缓冲液重复冲洗2次,滴加PAE增强子,室温孵育20 min,缓冲液重复冲洗2次后孵育辣根过氧化物酶标记的二抗,室温下孵育0.5 h(避光),滴加DAB显色,自来水反复冲洗后复染、脱水、封片,显微镜观察并拍照。
1.2.5 Westerrn blot实验测定 将组织用手术剪尽量剪碎后,加入液氮进行研磨,加入RIPA裂解液提取蛋白。选用BCA试剂盒绘制蛋白标准曲线。依次进行加样,接通电源后,经过分离胶与浓缩胶的分离作用后,进行聚偏二氟乙烯膜转膜,5%脱脂奶粉封闭2 h,TBST缓冲液冲洗3次后,依次加入ERK/p-ERK/NF-κB一抗,4 ℃孵育过夜,TBST缓冲液冲洗3次,依次常温孵育二抗2 h,TBST缓冲液冲洗后,加入显影液,应用Image J软件进行灰度值分析。
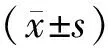
2 结果
2.1 各组小鼠体质量测定结果 从第1到第4周,各组小鼠的体质量均呈增加趋势;与对照组比较,糖尿病组小鼠体质量增加差异比较无统计学意义(P>0.05);与糖尿病组比较,其他治疗组小鼠体质量增加差异比较无统计学意义(P>0.05)。图1。
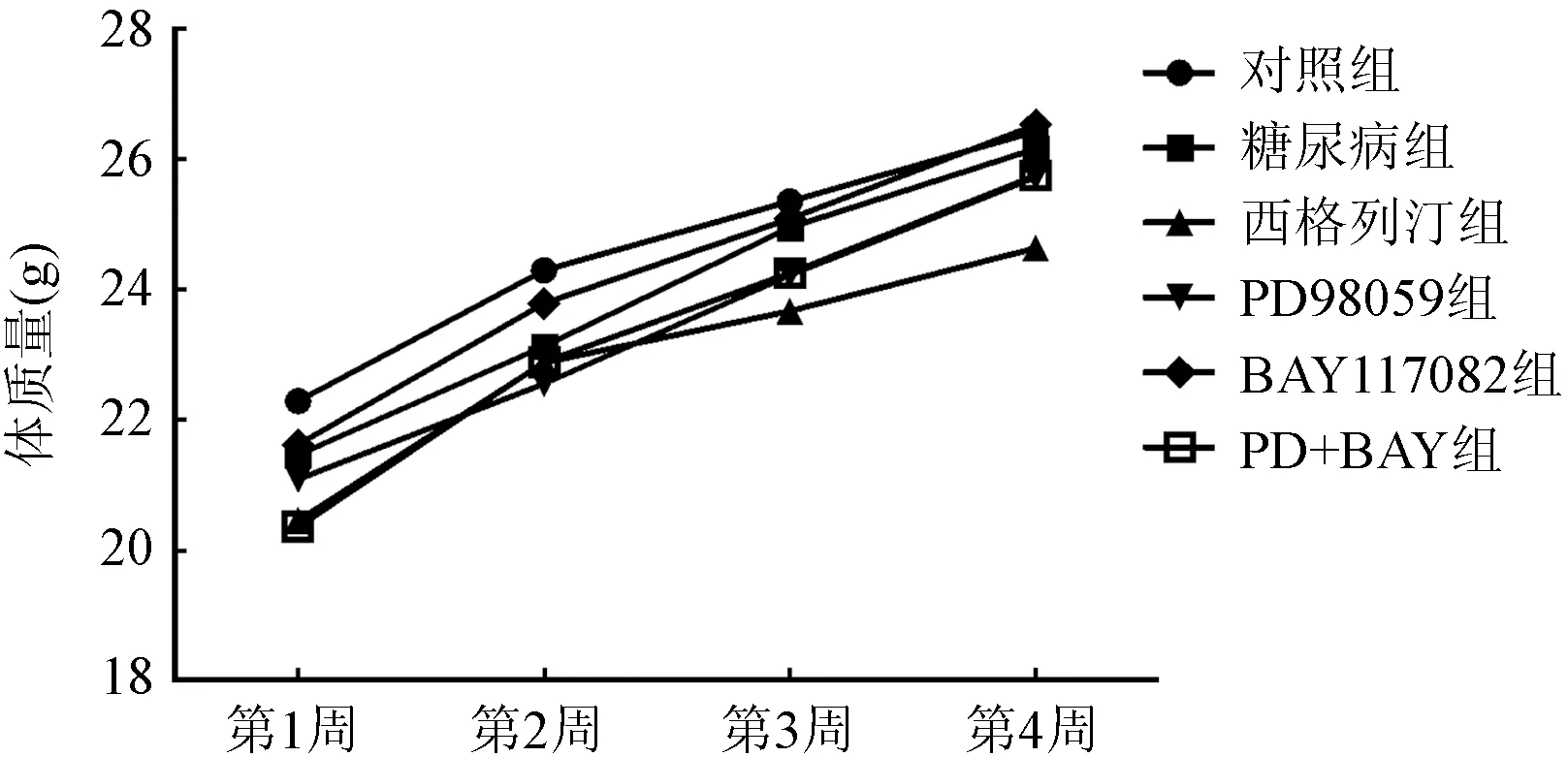
图1 各组小鼠体质量测定结果
2.2 各组小鼠血糖浓度测定结果 从第1到第4周,与对照组小鼠比较,糖尿病组小鼠血糖浓度显著升高(P<0.05);与糖尿病组比较,予以不同抑制剂及西格列汀组小鼠血糖浓度明显降低(P<0.05)。图2。
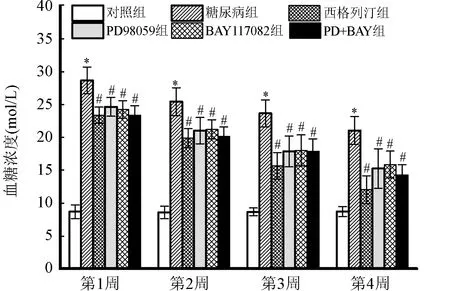
与对照组比较,*P<0.05;与糖尿病组比较,#P<0.05图2 各组小鼠血糖测定结果
2.3 各组小鼠主动脉钙离子浓度测定结果 与对照组比较,其他组小鼠主动脉钙离子浓度显著增加(P<0.05);与糖尿病组比较,予以不同抑制剂及西格列汀组小鼠主动脉钙离子浓度显著降低(P<0.05)。图3。
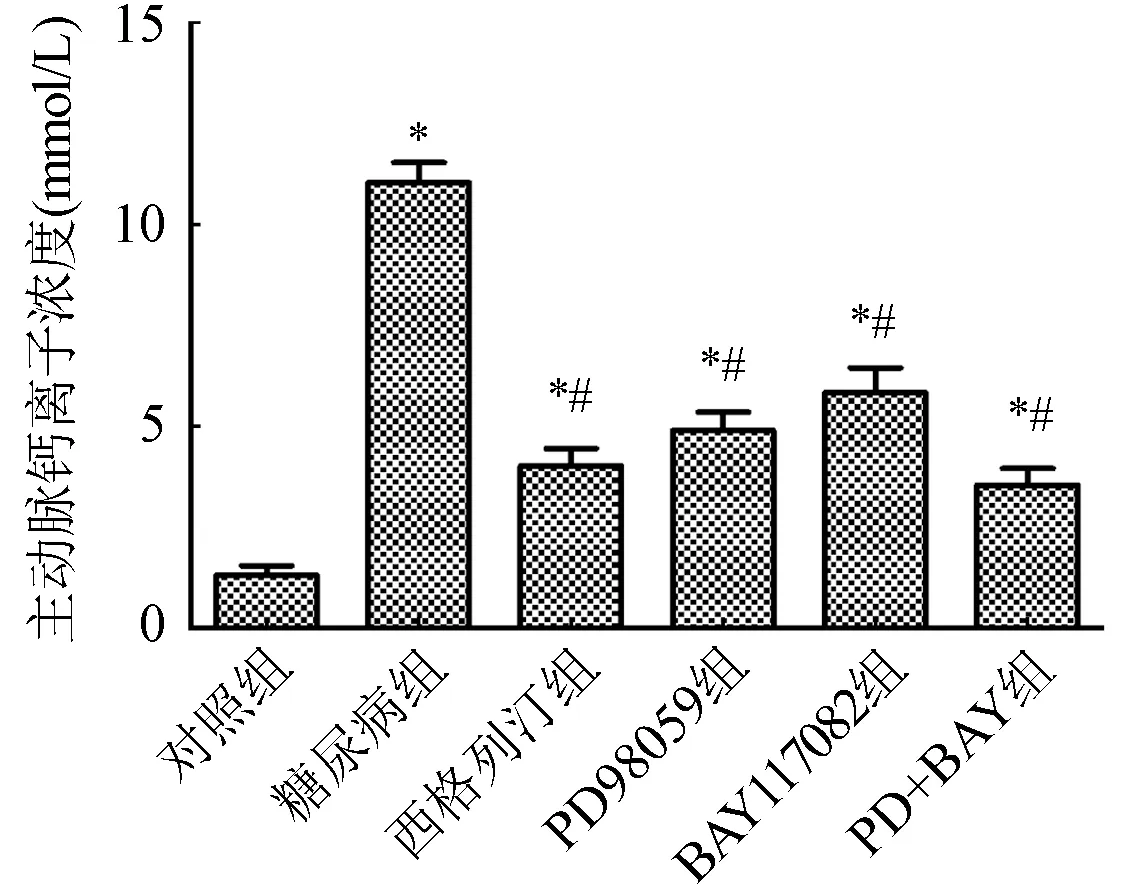
与对照组比较,*P<0.05;与糖尿病组比较,#P<0.05图3 各组小鼠主动脉钙离子浓度测定结果
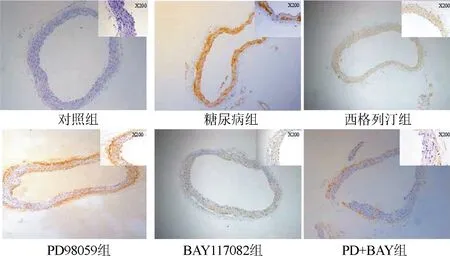
2.4 小鼠主动脉血管Von Kossa钙化染色结果 对照组与西格列汀组小鼠血管内无钙化的黑色沉积;糖尿病组小鼠主动脉血管内膜钙化的黑色非常明显;PD+BAY组血管内黑色沉积明显少于PD98059组及BAY117082组(图4)。与对照组比较,糖尿病组主动脉钙化细胞占比明显升高(P<0.05);与糖尿病组比较,西格列汀组及各抑制剂组主动脉钙化细胞占比明显降低(P<0.05)。图5。
2.5 ELISA试剂盒测定血清DPP-4浓度结果 与对照组比较,糖尿病组血清DPP-4浓度升高(P<0.05);与糖尿病组比较,西格列汀组及各抑制剂组血清DPP-4浓度降低(P<0.05)。图6。
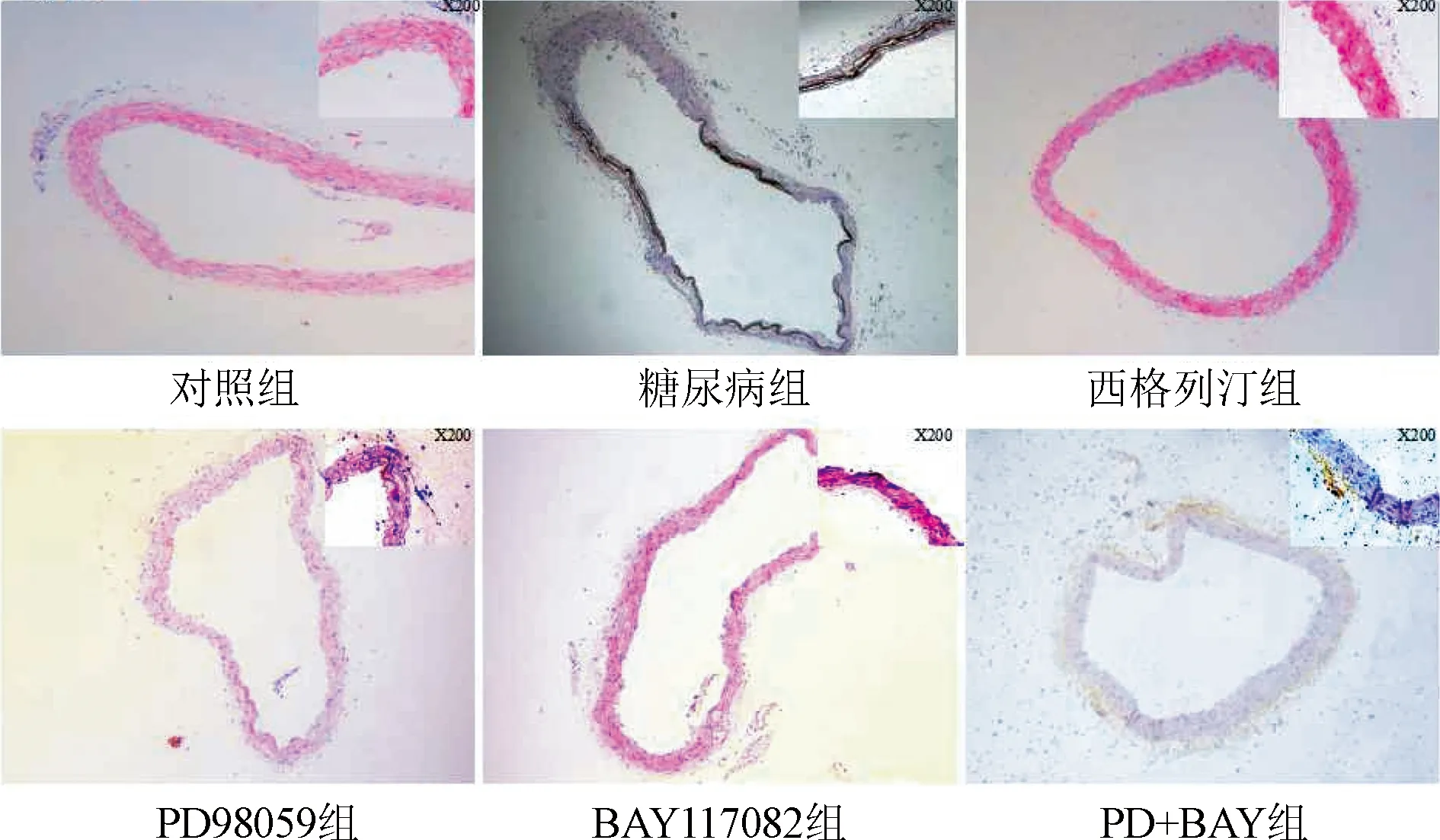
图4 小鼠主动脉血管Von Kossa钙化染色结果(×100倍)
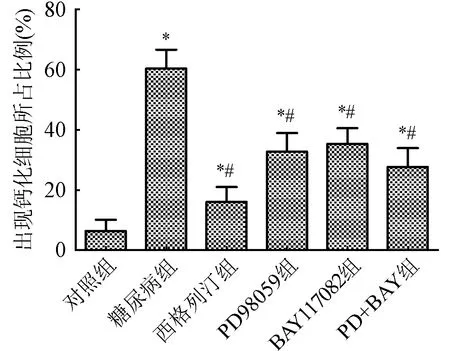
与对照组比较,*P<0.05;与糖尿病组比较,#P<0.05图5 各组小鼠主动脉钙化细胞占比比较
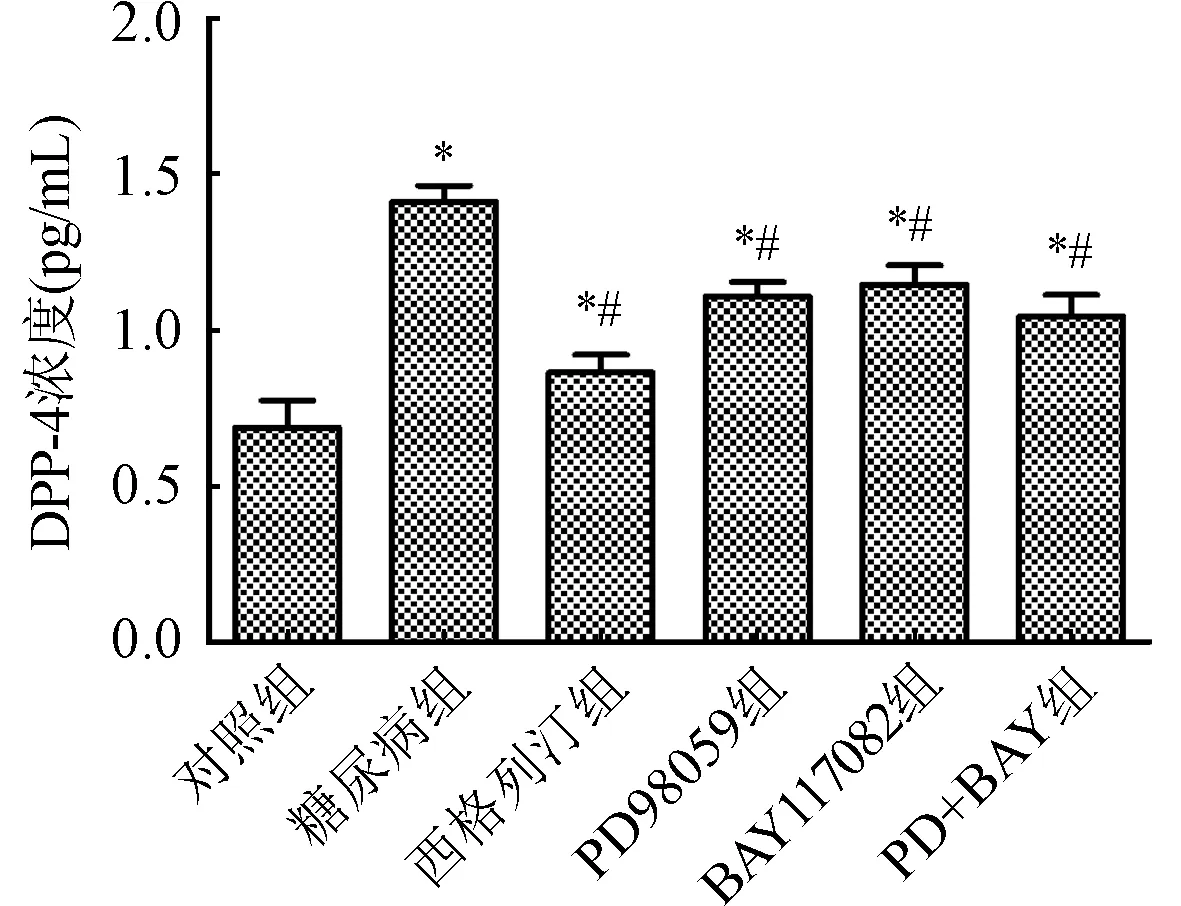
与对照组比较,*P<0.05;与糖尿病组比较,#P<0.05图6 ELISA试剂盒测定血清DPP-4浓度结果
2.6 免疫组化测定各组小鼠血管组织ERK和NF-κB蛋白表达结果 与对照组比较,糖尿病组血管ERK及NF-κB蛋白表达量均明显上升(P<0.05)。与糖尿病组比较,西格列汀组及各抑制剂组血管ERK及NF-κB蛋白表达量均明显下降(P<0.05)。图7和图8。
2.7 Western blot 实验检测结果 各组小鼠ERK蛋白表达量差异比较无统计学意义(P>0.05)。与对照组比较,糖尿病组小鼠p-ERK/ERK比值及NF-κB、OPG、RUNX2、BMP2蛋白表达量均明显升高(P<0.05)。与糖尿病组比较,西格列汀组小鼠p-ERK/ERK比值及NF-κB、OPG、RUNX2、BMP2蛋白表达量均明显降低(P<0.05);PD98059组小鼠p-ERK/ERK比值及RUNX2、BMP2蛋白表达量均明显降低(P<0.05);BAY117082组小鼠NF-κB、RUNX2、BMP2蛋白表达量均明显降低(P<0.05);PD+BAY组小鼠NF-κB、OPG、RUNX2、BMP2蛋白表达量均明显降低(P<0.05)。图9。
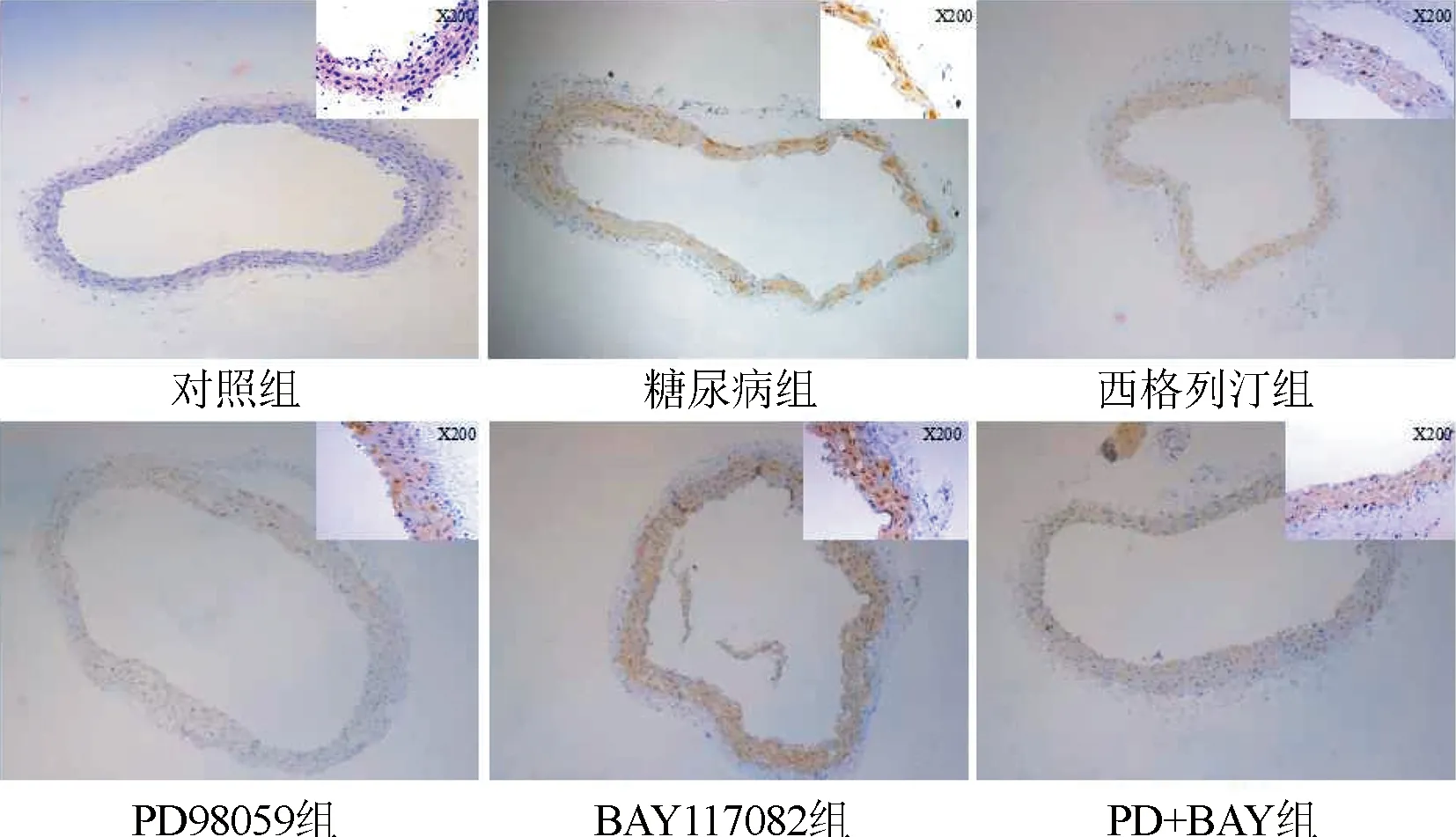
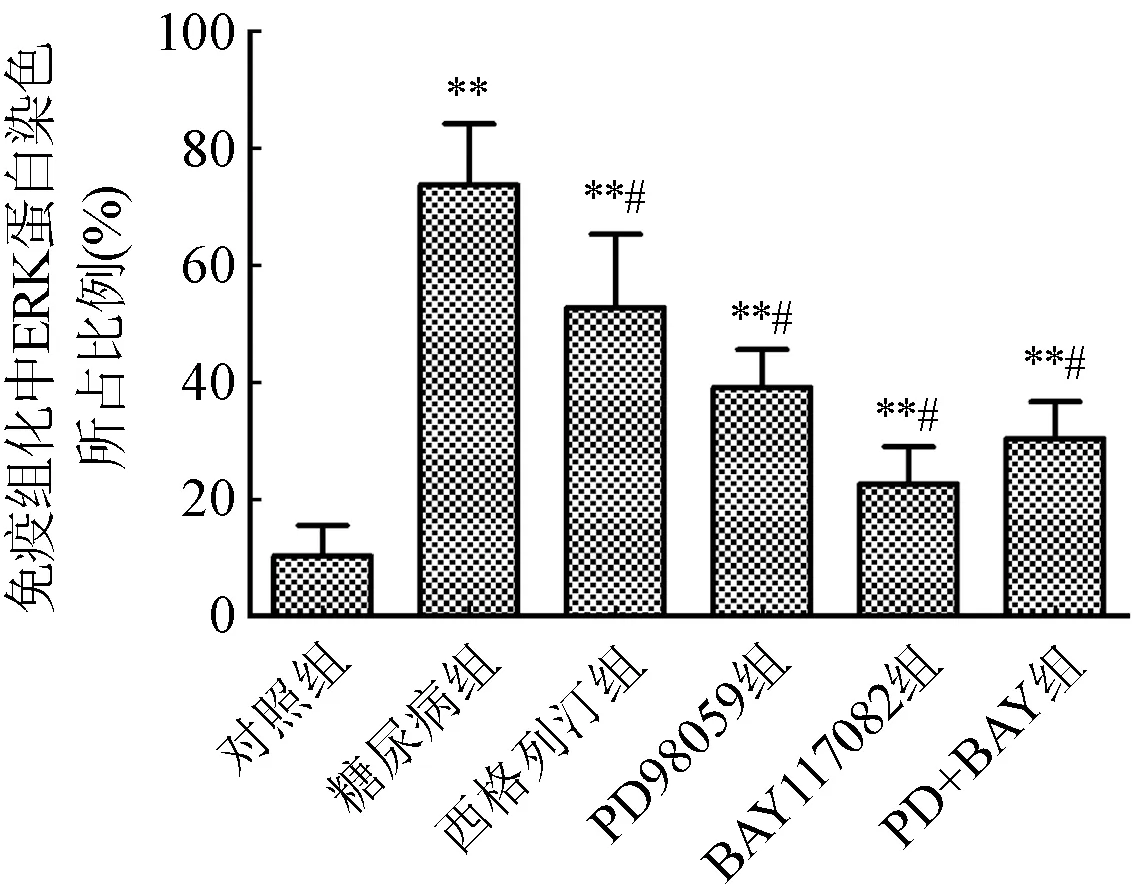
与对照组比较,*P<0.05,**P<0.01;与糖尿病组比较,#P<0.05图7 各组小鼠血管组织ERK蛋白表达情况(×100)
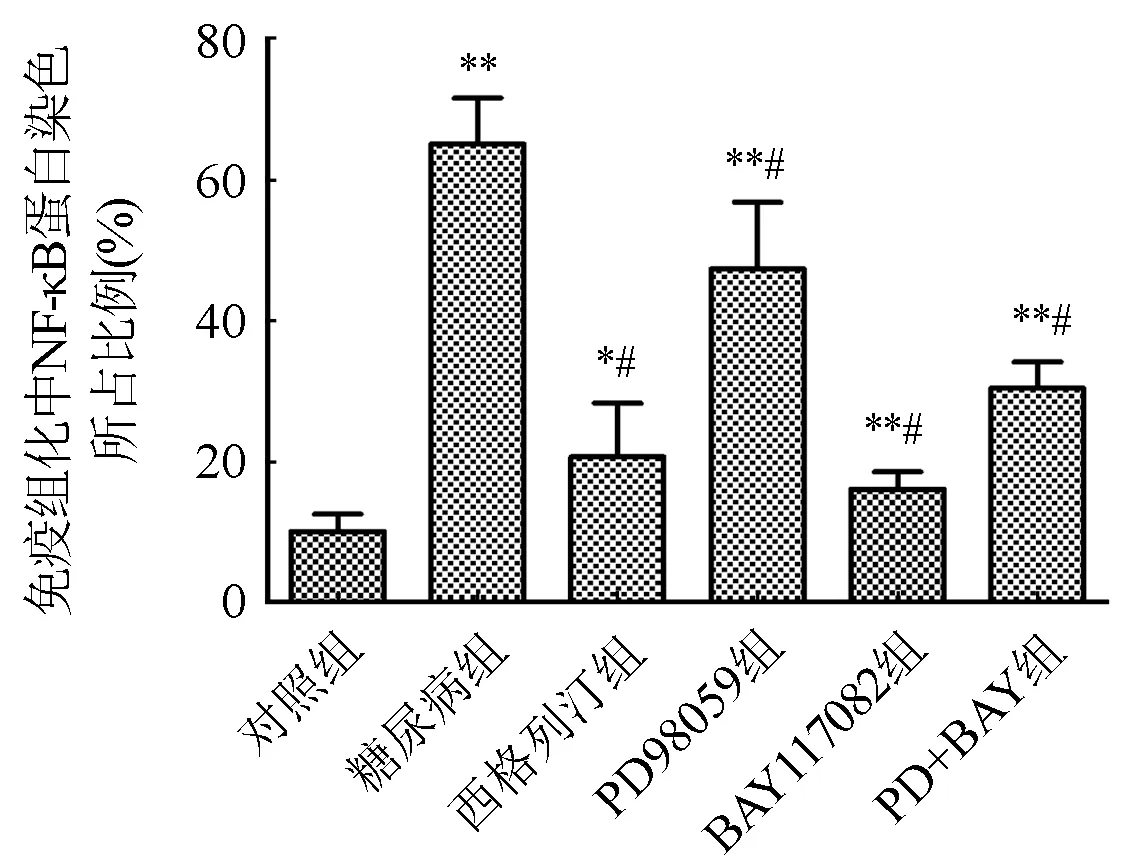
与对照组比较,*P<0.05,**P<0.01;与糖尿病组比较,#P<0.05图8 各组小鼠血管组织NF-κB蛋白表达情况(×100)
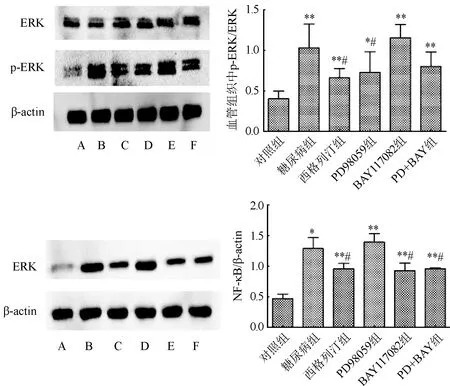
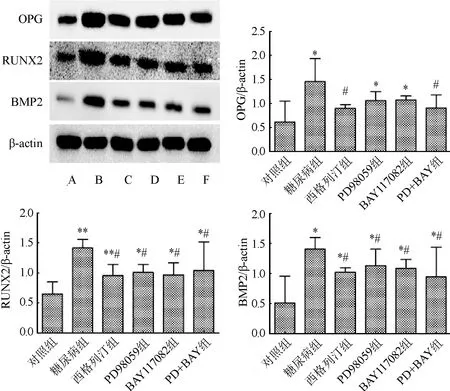
A:对照组;B:糖尿病组;C:西格列汀组;D:PD98059组;E:BAY117082组;F:PD+BAY组。与对照组比较,*P<0.05,**P<0.01;与糖尿病组比较,#P<0.05图9 Western blot实验结果
3 讨论
研究指出,糖尿病易引起动脉粥样硬化,血管纤维减小,弹性减弱,造成动脉硬化,动脉壁上钙盐过量沉积,最后以动脉钙化的病理形式呈现[7]。而糖尿病患者在出现动脉钙化后,其并发心肌梗死、心源性猝死等急性心血管事件的风险将显著增加[8]。因此,对于糖尿病患者采取血管钙化预防及相关作用机制的研究十分重要。DPP-4是T细胞表面活化抗原CD26,可与腺苷脱氨酶结合,直接干扰GLP-1和GIP活性,影响体内血糖代谢稳定[9]。体内血糖升高,小肠黏膜细胞分泌GLP-1与GIP刺激胰腺中β细胞释放胰岛素,抑制体内胰高血糖素分泌,抑制肝糖元分解,提高机体对胰岛素的敏感性,达到降低血糖的作用[10]。西格列汀是新型的有效抗糖尿病药物,可直接作用于DPP-4分子,通过升高GLP-1活性与抑制GLP-1分解以达到抑制DPP-4活性效果[11]。有研究者提出,西格列汀在通过提高胰岛素细胞活性而起到降低血糖作用的同时,直接干扰甘油三酯与胆固醇的生成与分泌,起到降低血脂的作用[12]。西格列汀除控制血液中血糖血脂,还可直接对组织器官具有保护作用:可直接保护受损的心肌及出现动脉粥样化后的血管[13]。本研究发现,与正常小鼠比较,糖尿病组小鼠血清中DPP-4浓度显著升高,西格列汀药物治疗后,小鼠体内DPP-4浓度显著降低,其血糖浓度及主动脉血管钙化程度也明显减轻,提示西格列汀能通过抑制DPP-4改善糖尿病小鼠主动脉血管钙化程度。
有研究指出糖尿病患者的体内存在明显炎症反应,而炎症反应与血管钙化密切相关,炎性因子可调控血管平滑肌细胞的成骨性分化,促进动脉粥样化血管出现钙化情况[14-15]。NF-κB信号通路是机体炎症反应的必经之路,糖尿病并发炎症反应时,NF-κB作为一种核转录因子,可通过IκBs的降解而被活化,活化后的NF-κB进入细胞核,启动基因DNA,通过增加OPG及RUNX2含量使骨骼破骨细胞活性不断增加,机体内血管钙化严重、骨量丢失凸显,出现炎症型的软化与发生硬化的“软组织”,进而导致动脉粥样硬化型的动脉血管钙化[16-17]。在本研究中,给予小鼠西格列汀,其NF-κB、OPG及RUNX2蛋白表达量降低,血糖含量及血管钙化程度均降低,其作用效果与给予NF-κB抑制剂后效果一致,说明DPP-4对血糖及血管钙化的调节作用是通过激活NF-κB信号通路完成的。
有学者猜测,血管钙化可能与ERK1/2通路相关[18]。正常情况下,机体中主要为ERK的形式,当受到外界刺激时,发生磷酸化反应,ERK主要以p-ERK的形式出现,将信息从细胞表面传递至细胞核内,启动基因的调控[19]。有研究者证实,ERK1/2通路的磷酸化水平被降低后,内皮细胞的钙化情况可明显减少[20]。在本研究中,给予小鼠西格列汀干预后,小鼠p-ERK/ERK比值明显降低,其血管钙化程度也相应减轻,与给予ERK抑制剂后效果一致,说明DPP-4对血糖及血管钙化的调节作用是通过ERK1/2信号通路介导的。
综上所述,糖尿病小鼠体内DPP-4含量明显增多,从而激活ERK1/2与NF-κB信号通路,发挥对主动脉血管钙化的调节作用。但是,如何确定DPP-4激活的ERK1/2与NF-κB信号通路是上下游关系还是平行关系,仍需后续研究作进一步探讨。

