RNAi转基因作物安全评价研究进展
栾 颖, 梁晋刚,2, 周晓莉, 张正光*
1南京农业大学植物保护学院,江苏 南京 210095; 2农业农村部科技发展中心,北京 100176
1 RNAi的发现及技术原理
RNAi(RNA interference)即RNA干扰,是由双链RNA(dsRNA)诱导的同源mRNA高效特异性降解,造成转录后水平的基因沉默(post-transcriptional gene silencing, PTGS),影响靶标生物的正常生理活动或死亡的现象。Guo & Kemphues(1995)发现正义RNA与反义RNA都能抑制线虫Caenorhabditiselegans的基因表达,这个结果与反义RNA技术理论不符。后来,Fireetal.(1998)发现Guo和Kemphues的实验中正义RNA抑制基因表达是由于污染了微量的dsRNA,即为RNAi现象。随后,科学家又在多种真核生物中发现了由dsRNA介导的RNAi现象。
RNAi起始阶段会产生RNAi的标志性组分——小干扰RNA(small interfering RNA, siRNA)和另一种调控基因表达的非编码小RNA microRNA(miRNA)。基本的RNAi过程可以分为3个主要步骤(Tomari & Zamore,2005)。首先,Dicer(一种RNaseⅢ核酶)将在细胞中表达或引入细胞的内源或外源dsRNA分子,加工成小RNA双链体。根据生物体的不同,可能有一个或多个Dicer酶,每个酶负责不同类型的dsRNA产物(Meister & Tuschl,2004)。例如,在黑腹果蝇DrosophilamelanogasterMeigen中,Dicer-1主要用于产生miRNA,而Dicer-2则负责将长dsRNAs加工成siRNA (Leeetal.,2004)。其次,这些双链体被解链,其中一条被称为引导链的单链RNA(ssRNA)被优先加载到RNA诱导沉默复合物(RNA-induced silencing complex,RISC)的蛋白质复合物中。再次,RISC复合体识别与dsRNA完全或部分序列同源的潜在靶信使RNA(mRNA),引导链促使RISC的内切核酸酶将mRNA裂解,最终导致目的基因沉默。
RNAi作为一种新的基因阻断技术,具有高度特异性、高效性、持久性和信号的可传导性等特点(李丽文等,2007),能够简单并高效地抑制特定基因的表达。目前主要应用于以下几个方面:(1)基因敲除,传统的基因敲除是反向遗传学的研究手段,技术难度高、周期长、操作困难,而RNAi技术可利用siRNA或siRNA表达载体快速、简便地抑制目的基因的表达,并能使在体外培养的细胞中达到基因敲除的效果;(2)基因功能分析,RNAi技术克服了传统转基因技术苛刻繁琐的缺点,不仅可以用于结构基因的功能研究,还可用于细胞周期调控、代谢、信号转导、膜转运以及DNA损伤反应、转录或甲基化等多方面的基因功能研究;(3)基因治疗,用于抑制癌细胞的基因表达;(4)调控信号转导通路,RNAi已经被证实能诱导植物干细胞的分化;(5)病毒感染治疗。RNAi技术可以干扰病毒的复制及相应蛋白质的翻译,有效地控制病毒的繁殖和传播(周红建等,2010)。
2 RNAi技术与传统转基因技术的区别
传统的转基因技术是利用分子生物学和基因工程技术将外源基因插入、整合到受体植物的基因组中,并使其在后代植株中得以遗传和表达,从而使受体植物获得新的性状。无论过程还是最终产品,都涉及外源重组DNA的导入及整合,且外源DNA在亲本作物中的插入位点是随机的。由于大部分产品转入的都是外源基因,需要进行蛋白表达,因此,插入位点的不同会对外源蛋白表达效率以及受体作物本身的蛋白表达产生潜在影响。对于RNAi转基因作物来说,插入位点的不同并不会导致RNA转录的差异,且该过程不涉及外源蛋白的表达(焦悦等,2018)。传统的转基因抗虫作物是靠Bt蛋白来控制靶标害虫。Bt蛋白是革兰氏阳性土壤细菌苏云金杆菌产生的一种具有高度特异性的杀虫蛋白,这种蛋白被靶标昆虫取食后在中肠溶解为前毒素,再被蛋白酶水解为毒素分子,毒素分子与中肠细胞结合使细胞膜穿孔,最终导致昆虫死亡(林珠凤等,2015)。Bt蛋白生物制剂迄今仍是世界上生产与应用规模最大的微生物杀虫剂。与其他生物杀虫剂一样,Bt生物制剂也有药效慢、持效期短、易受环境影响、成本高等缺陷与不足,这是制约其大面积推广应用的主要因素(陆宴辉和梁革梅,2016)。
研究表明,RNAi技术相比传统转基因技术有很大的优势,主要包括:(1)高度特异性,dsRNA介导的RNAi只能特异性地降解同源mRNA,并不影响其他mRNA的表达,因此,RNAi技术应用于抗虫作物上时只会针对特定的一种或几种靶标生物,而传统转基因技术突变的随机性很大;(2)高效性,尤其是对一些鞘翅目昆虫(Zottietal.,2018),少量的dsRNA就可以抑制大量同源mRNA的表达,比传统的转基因技术节约了大量人力并缩短了时间;(3)RNAi转基因植物表达的不是蛋白而是dsRNA和siRNA,这种表达形式易于在农作物中推广,因为插入到植物基因组上的外源基因干扰序列部分的mRNA转录后形成发夹结构,并被植物体内的Dicer识别降解,不会再被翻译成蛋白质,从而避免了外源蛋白质在植株体内的积累,具有较高的生物安全性。作为调节植物生长发育和保持遗传稳定性的重要机制,植物存在大量的内源dsRNA和siRNA,因此,表达与植物自身无同源序列的 dsRNA,不会对寄主植物产生不良的影响,也更易被寄主植物接受(郭强等,2012)。综上所述,RNAi技术具有重要的生物学意义,在农作物害虫防治领域有广阔的前景。
近几年来,人们将RNAi技术大量地应用到了农业领域。在作物改良方面,高梦烛等(2016)通过构建RNAi膜蛋白载体并导入到转基因拟南芥ArabidopsisthalianaHeynh中,从而提高了拟南芥的抗寒性,Wangetal.(2017)通过RNAi筛选出与刚毛柽柳TamarixhispidWilld的耐盐性相关的基因;在害虫防治方面,李娇(2016)通过注射dsRNA沉默几丁质合成酶A基因从而来控制稻纵卷叶螟CnaphalocrocismedinalisGuenee,Yangetal.(2017)利用RNAi技术敲除褐飞虱NilaparvatalugensStal体内的基因TPS1和TPS2,导致30%的昆虫死亡;在病害防治方面,黄静等(2017)通过RNAi提高了番木瓜对环斑病毒的抗性;在昆虫抗药性方面,Guoetal. (2015)利用RNAi技术沉默了小菜蛾PlutellaxyllostellaL.的转运蛋白基因,降低了其对CryiAc毒素的敏感性,从而影响小菜蛾的抗药性。目前已通过RNAi技术有效防控的主要昆虫见表1。
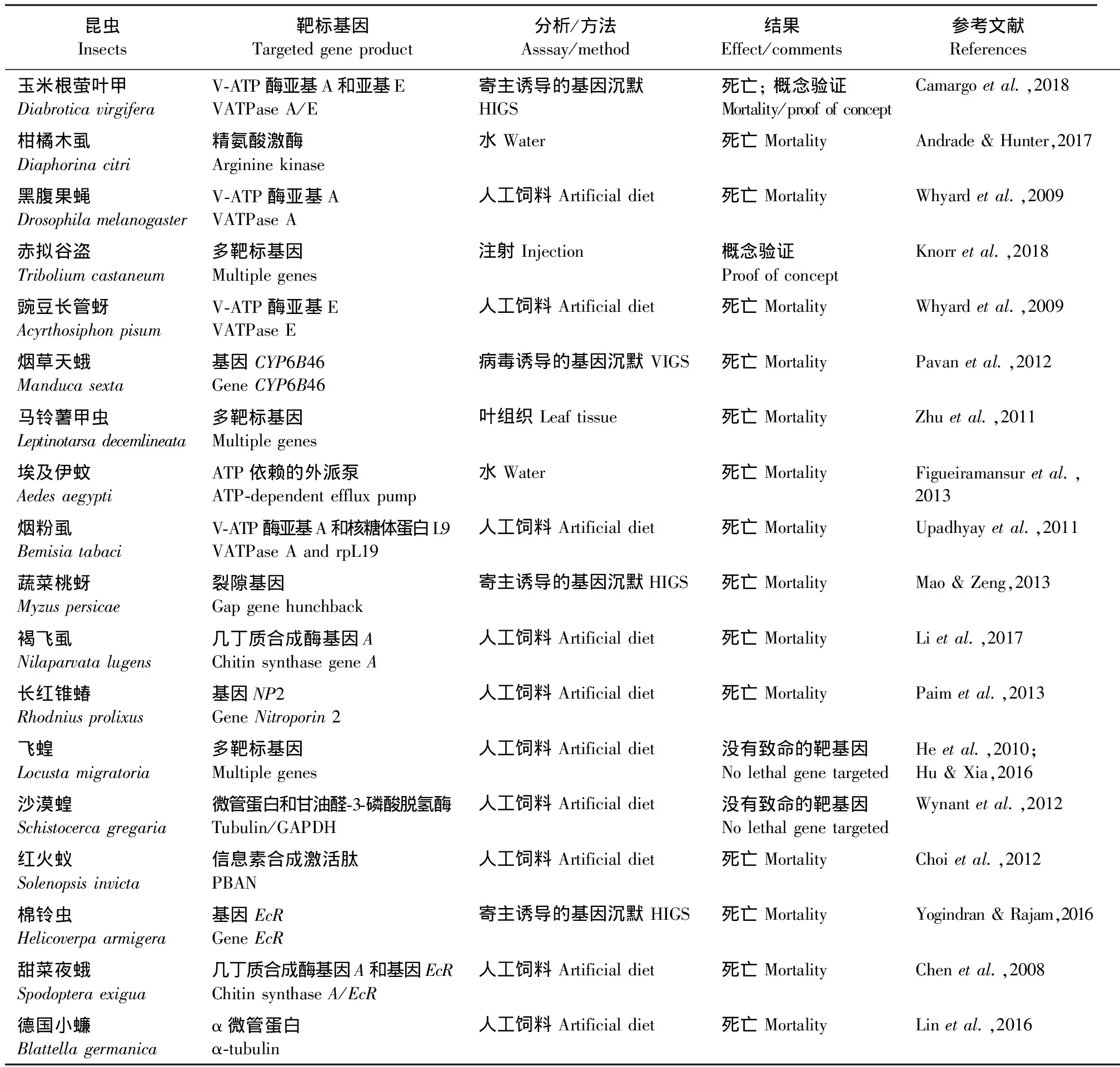
表1 目前已通过RNAi技术有效防控的主要昆虫Table 1 Major insect pests that have been effectively controlled by RNA interference technology
3 RNAi技术可能存在的风险
近年来,虽然RNAi已经成为作物保护的有效和成功的技术,但在全面采用该技术控制有害生物之前还有一些问题要解决。使用基于RNAi的线虫处理策略的一个主要问题是潜在的脱靶效应,即siRNA与非靶标基因RNA发生互补配对并非特异性地抑制了该基因的表达(尚仁福和吴立刚,2016)。由于RNAi机制以高度序列特异性的方式发生,与导入的dsRNA分子具有部分同源性的内源转录物的交叉杂交可能导致非靶基因的沉默,这可能对非靶向生物体产生影响,具有潜在的风险(Duttaetal., 2014)。
3.1 对改良植物本身的风险
3.1.1 dsRNA与作物的转基因蛋白相互作用 转基因抗虫作物Bt蛋白的作用模式是结合昆虫的中肠受体细胞,随后将细胞穿孔导致细胞裂解(Vachonetal.,2012),而dsRNA的作用模式是消耗靶mRNA(Kennerdell & Carthew,1998),这2种作用模式是不相关的,但Bt蛋白很有可能与dsRNA结合并在转基因作物中表达。因此,针对Bt蛋白与dsRNA潜在的结合要进行风险评估。Bachmanetal. (2016)评估了Cry蛋白和dsRNA(Cry3Bb1和玉米根虫DiabroticavirgiferaLeConte的DvSnf7 dsRNA)之间的潜在相互作用,抗虫玉米杂交种MON 87411既可以产生抵抗玉米根虫的Cry3Bb1 Bt蛋白,又可以针对玉米根虫产生DvSnf7 dsRNA,使玉米根虫发生RNA干扰。李翠萍等(2012)、Belden & Lydy (2006)采用了2种方法对这两者的潜在互作进行了评估,第一种方法是单独评估Cry蛋白和dsRNA在玉米根虫内的反应水平,再将两者结合评估,结果证明两者组合的反应水平是单独反应水平累加的结果,并且与独立反应下的预测反应水平没有显著差异。第二种方法采用固定的半致死浓度测定法,即将一方的固定亚致死浓度加入到另一方的有效浓度中,测定12 d内两者的半数致死浓度(LC50)是否有变化,结果发现Cry3Bb1和DvSnf7的LC50均不受对方影响。另外,Levineetal. (2015)用对Cry3Bb1敏感、对DvSnf7不敏感的科罗拉多马铃薯甲虫Leptinotarsadecemlineata(Say)测试了Cry3Bb1和DvSnf7之间相互作用的潜力,结果证明DvSnf7不改变Cry3Bb1的活性。
3.1.2 转基因作物遗传稳定性 转基因作物在不同代际间目的基因的整合和表达能力不尽相同,后代可能发生可遗传基因突变(即碱基替换、删除、插入),且编码siRNA基因比编码蛋白基因的变异率高(Obbardetal.,2009)。因此,应分析害虫的抗性发展,评估其发生时间、影响规模(局部的、区域的或全国性的)及严重程度,并建立预测模型。此外,只有建立统一的sRNA活性标准才能开展可比性评价,检测至少3代目的基因表达的稳定性和观察目标性状表现的稳定性(贺炜华等,2008)。
3.2 对靶标生物的风险
转基因作物被靶标害虫长期食用后,靶标害虫种群易发生抗性进化,通过对杀虫物质的螯合或降解,使作用方式中的任何一个步骤无效或目标部位的敏感性降低,可在靶标生物种群中产生抗性导致作物抗虫的持久性降低。尽管还没有鉴定出RNAi的抗性机制,但可以假定潜在的抗性机制。如在反应链中只要存在以下任何一种情况:靶标害虫摄取的dsRNA减少、消化系统中分子降解导致细胞吸收的dsRNA减少、Dicer酶处理得到的小RNA减少、siRNA分子的RISC复合物识别减少、RISC复合物不能降解目标mRNA或阻断RNAi的系统扩散等,RNAi转基因作物对靶标生物的抗性就会降低(Fishilevichetal.,2016)。昆虫还可通过增加目标基因序列的转录速度或上调其他与目标(沉默)基因有相同或相似功能的基因来避免基因沉默。
庇护所策略是目前害虫抗性治理的主要方法(Fittetal.,1994)。庇护所内种植的是不包含杀虫物质并允许对杀虫物质敏感的昆虫存活的作物,对特定性状没有选择压力,因此,可以保存不具有抗性等位基因的昆虫。将庇护所和转基因作物混合种植,使敏感个体与转基因植株上的抗性个体随机交配,从而使它们的后代抗性等位基因是杂合的。如果杂合子产生的后代在转基因抗虫植株上也不能存活,即达到了治理害虫的目的(Gould,1998)。
3.3 对生态环境的风险
3.3.1 dsRNA在环境中残留 RNAi生态风险评估的一个重要组成部分是确定杀虫物质残留在环境中的潜在可能性以及潜在的非目标物种的种群数量。通过检测活性杀虫分子的环境稳定性,可以确定对易感染的非靶标生物是否存在长期风险(Kough & Edelstein,2012)。Dubelmanetal. (2014)针对不同理化性质的土壤进行了检测,并将非靶标生物暴露于dsRNA培养土壤以评估生物活性(即昆虫死亡率)。结果表明,在粉砂壤土、壤砂土和黏壤土这3种土壤类型中,玉米根虫Snf7 dsRNA在48 h后是不可检测的,Snf7 dsRNA的半衰期小于30 h。很多报道也证实Bt蛋白半衰期在一到几天范围内(Bryan,2005),Snf7 dsRNA和其他dsRNA不可能在土壤中持续存在。如果要证明dsRNA在土壤中的持久性,有必要了解被暴露的黏附生物体是否对dsRNA敏感,同时是否具备必要的加工RNA的分子和与之配对的靶序列。
3.3.2 对非靶标生物的影响 靶标生物摄入的dsRNA对其有高度的特异性(Baumetal.,2007),然而多个研究表明,序列特异性反应会随着物种之间进化距离和序列间分歧的增加而降低(Whyardetal.,2009)。目前,用于转基因抗虫作物的生态风险评估为评估RNAi介导的昆虫保护作物的潜在危害提供了基础。如针对DvSnf7的dsRNA的致死和亚致死能力在4个目和10个科的昆虫中进行的评估,结果表明,DvSnf7的dsRNA杀虫活性范围很窄,只有在甲虫亚科的甲虫评估中观察到这种影响,在敏感物种中须满足一定的序列要求才能与DvSnf7匹配,且在昆虫中实现RNAi介导的反应存在额外的障碍,因此不是所有的物种都对摄入的dsRNA敏感,或在环境暴露的低浓度下不敏感(Allen & Rd,2012; Bachmanetal.,2013; Huvenne & Smagghe,2010; Tereniusetal.,2011)。因此,评估dsRNA对非靶标生物的影响,可以同时喂食靶标和非靶标生物,重点监测与靶标生物序列同源性高而易受感染的生物,并测试RNAi中使用的每种dsRNA对非靶标生物的影响。
4 RNAi技术的安全评价
目前的科技水平不能预测RNAi转基因作物对环境和被人们食用后造成的影响,因此,必须采取一系列严格的措施对转基因作物进行全程安全性评价和监控管理,维护生态多样性,保障人们的人身安全。虽然国际上已有一些经验和数据可以借鉴,但仍需对RNAi这项新技术作出具体分析,以便尽快建立起符合实际需求的安全性评价方法,这样才能优化当前的转基因技术,将RNAi转基因作物进行商业化种植。
4.1 环境安全评价
RNAi转基因作物在环境释放期间可能会对周边生态造成影响,危害当地的生态多样性。为了贯彻环境可持续发展的理念,要对转基因作物进行严格的环境安全评价。主要包括:(1)土壤微生物安全评价,RNAi转基因作物在大田种植时,作物本身及其基因产物进入土壤后可能与土壤微生物相互作用,影响土壤中微生物的活动,从而影响土壤肥力;(2)生存竞争力安全评价,RNAi转基因作物中外源基因表达可能具有更强的环境适应能力,将其释放到生态环境中后,与非转基因的作物竞争过程中具有更强的竞争力,可能影响到生物的多样性,甚至变成新型的杂草(刘华清等,2010);(3)基因漂移安全评价,RNAi转基因作物的新基因可能会在生态中发生基因漂移和与近缘野生种杂交,要针对这2种情况对当地植物的生长情况进行检测;(4)对非靶标生物的安全评价,RNAi转基因作物可能会对非靶标生物的生存造成影响,因此要监测作物周围的非靶标生物的活性及评价其潜在的影响;(5)靶标生物抗性安全评价,靶标生物可能会不断进化,淘汰对作物敏感的个体,最终对作物产生抗性,因此要监测评估靶标生物不同代的抗性。
4.2 食用安全评价
RNAi转基因作物的食用安全与人类生命安全息息相关,也是人们最关注的问题。因此,RNAi转基因作物从实验室转向大规模生产之前要实施一系列的食用安全评价。(1)营养学安全评价。检测RNAi转基因作物中的蛋白质、淀粉、纤维、矿物质以及其他与人类健康有关的营养物质,还有凝集素、植酸酶、蛋白酶等抗营养因素与生物碱、毒草等天然毒素,评估这些物质的含量与非转基因品种之间是否有显著性差异。(2)毒理学安全评价。应考虑RNAi转基因作物是否会带来新的毒素或存在产生新毒素的情况。(3)致敏性学安全评价。判断新基因的来源,根据基因是否来源于已知的对人体致敏的物种而采取不同的分析步骤。比较氨基酸序列的相似度,再进行特异性血清筛选实验,然后进行模拟胃肠液消化实验。建立动物模型实验,根据各阶段的测试结果,对RNAi转基因作物致敏性进行评价。(4)非期望效应安全评价。RNAi转基因作物可能会出现与预期效果不符的现象,包括RNAi转基因作物自身可能出现的非期望效应,以及食用了转基因食物后,动物在生理上可能存在的非期望变化。目前RNAi转基因作物非预期效应的测定方法包括靶方法和非靶方法2种。(5)肠道健康安全评价。RNAi转基因食物可能会影响肠道微生物菌群从而影响人体健康,目前主要采用亚型分析法非定向检测肠道微生物,包括微阵列分析基因表达、蛋白双向电泳和质谱、分析蛋白质、液谱结合核磁共振分析化合物等(李媛媛,2017)。
5 RNAi技术的前景与展望
本文在前人研究RNAi技术的基础上进行了一定的补充和完善,介绍了现阶段的主要潜在风险以及可行的评估方案,RNAi技术具有广阔的农业应用前景,不但可以有效减少害虫数量、提高水稻产量、降低种植成本,还可以减少化学农药造成的环境污染,有利于实现农业的可持续发展。同时,RNAi技术也存在一定的生态风险,虽然RNAi技术影响生态安全性的研究已取得了一些进展,但仍存在许多未知领域有待澄清和证明。针对目前RNAi的研究现状,应对其转基因作物大规模商品化种植后可能出现的生态风险进行长期的系统监测, 同时加强对作物生物安全的试验技能研究,发展快速、准确检测RNAi作物生态风险的新技术和新方法, 建立完善的生态安全评价体系,从而充分发挥RNAi技术在农业生产上的作用。

