枇杷果实EjNADP-ME2基因及启动子克隆与表达分析
杨俊 郑雪莲 高欢欢 寇燕 陈旭 郭傲 郑国华


摘 要 以‘解放钟和‘白梨果实为材料,研究基于转录组筛选出的表达量较高且在2个品种中有差异的EjNADP-ME2(Unigene0001461)基因,采用RACE和RT-PCR技术成功克隆EjNADP-ME2的cDNA全长。系统进化树分析表明,EjNADP-ME2与苹果的NADP-ME基因关系最近。生物信息学预测结果显示,EjNADP-ME2蛋白应该位于细胞质中。用染色体步移法成功克隆了EjNADP-ME2的启动子序列,序列预测该基因启动子区域含有水杨酸、茉莉酸、脱落酸响应的顺式作用元件,此外还有厌氧诱导元件、MYB和MYC参与黄化和干旱诱导的结合位点MBS。荧光定量PCR分析表明,EjNADP-ME2基因的表达量变化趋势在2个品种中大致相同,均呈现出先降低后升高又降低的趋势,且该基因在低酸品种的表达量稍低于高酸品种。相关性分析结果显示,低酸品种EjNADP-ME2基因转录水平与苹果酸含量呈显著负相关。本研究的结果为进一步探究EjNADP-ME2基因在苹果酸代谢途径中的功能奠定坚实基础。
关键词 枇杷;果实;细胞质型苹果酸酶;基因表达分析;启动子
中图分类号 S667.3 文献标识码 A
枇杷(Eriobotrya japonica)是蔷薇科亚热带常绿果树,被广泛种植在中国、日本、意大利、巴西、西班牙等国家[1]。枇杷果实偏酸是影响其果实品质和商业价值的主要因素。有机酸含量和种类是决定果实风味的主要因素之一,通常在果实发育的早期阶段积累,并在果实成熟期间用作呼吸基质[2]。大多数水果中的有机酸是苹果酸和柠檬酸,枇杷果实属于苹果酸型,其中苹果酸含量占有机酸含量的80%以上[3]。成熟果实中最终有机酸的含量由有机酸生物合成,降解和液泡储存之间的平衡共同决定[4]。苹果酸代谢主要受6种关键酶基因调控,其中磷酸烯醇丙酮酸羧化酶(PEPC)和NAD型苹果酸脱氢酶(NAD-MDH)控制苹果酸的合成;NADP-ME和磷酸烯醇丙酮酸激酶(PEPCK)负责苹果酸的降解;苹果酸依赖液泡膜H+-ATPase(VHA)和H+-VPP(V-PPase)质子泵积累转运ATP所需要的能量[5]。
苹果酸酶(MEs)是调控苹果酸代谢的关键酶之一,催化L-苹果酸的氧化脱羧,在二价阳离子作用下产生丙酮酸,CO2和NADPH。根据辅酶的特性,可将苹果酸酶分为NAD-ME和NADP- ME,均广泛存在于自然界中[6]。在高等植物中,NAD-ME主要在线粒体中产生丙酮酸,NADP-ME主要存在于细胞质和质体中,其中cyNADP-ME是参与苹果酸降解的关键酶[7]。目前,对植物中NADP-ME酶的研究主要有烟草、拟南芥、白杨、苹果、桃、草莓、菠萝等[8-12]。对该酶功能的研究主要在抗性、防卫、果实成熟等方面[13]。在水稻中,Liu等[14]研究表明NADP-ME调节细胞内外的渗透压,能够提高抗盐害的能力。李明等[15]成功地从苹果果实中克隆了细胞质型NADP-ME,并且验证了Mal-ME在果实发育过程中对苹果酸的积累起负调控作用。
本研究以高酸的‘解放钟和低酸的‘白梨为实验材料。从转录组中得到EjNADP-ME2基因的保守区,采用RACE技术成功分离EjNADP- ME2基因cDNA全长并进行生物信息学分析,同时分析EjNADP-ME2在果实中不同发育阶段的表达水平和苹果酸含量之间的联系。采用染色体步移的方法获得EjNADP-ME2基因的启动子序列,对所得序列的顺式作用元件进行分析,为深入研究EjNADP-ME2基因的功能与苹果酸代谢之间的机理提供理论基础。
1 材料与方法
1.1 材料
供试材料枇杷果实采自福建省莆田市常太镇果园10年生枇杷树。选取无病虫害且盛花期一致的‘解放钟和‘白梨2个品种各3株,于花期后50、65、80、95、110和125 d各采一次果。每株树上采6个果实,采后迅速去皮去核,用锡箔纸包好于液氮中速冻,保存于80 ℃冰箱中以备后续提取RNA。本实验设置3次生物学重复,每次重复随机选取2 g样品进行苹果酸含量的测定。
1.2 方法
1.2.1 枇杷果实中苹果酸提取及测定 取2 g样品于10 mL的离心管中,加入一定量的甲醇,75 ℃超声提取30 min后,12000 r/min离心10 min后取上清轉入25 mL容量瓶中,重复3次,定容至25 mL,旋转蒸干后,取5 mL双蒸水溶解,取1 mL提取液过有机滤膜,滤液用于HPLC的检测,苹果酸含量的测定参考陈发兴等[16]的HPLC方法,每个样品设置3次生物学重复。
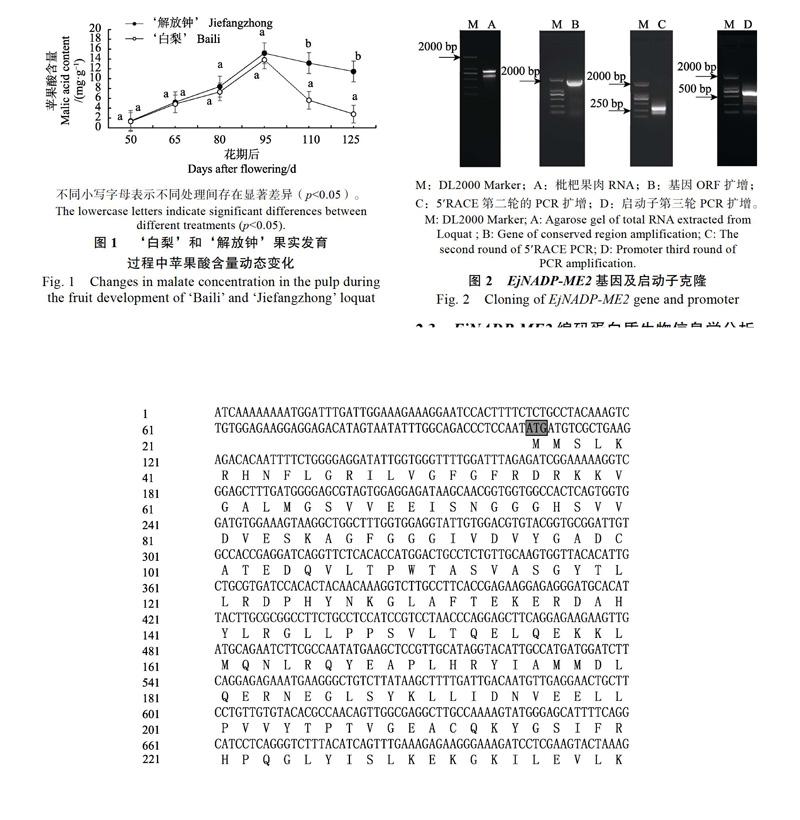
1.2.2 枇杷果实RNA、DNA的提取和cDNA合成 采用天根试剂盒对枇杷果实中RNA和DNA进行提取,采用1%的琼脂糖凝胶电泳和 Thermo Scientific Nano Drop 2000c检测RNA和DNA质量和浓度(图1A)。以枇杷果实的总RNA为模板,利用TaKaRa公司的PrimeScript? RT reagent Kit With gDNA Eraser试剂盒合成cDNA,用于后续的RT-PCR和q-PCR。
1.2.3 EjNADP-ME2基因cDNA全长克隆及其启动子克隆 分析枇杷花后110 d果肉RNA-seq数据库(未公布)筛选得到EjNADP-ME2保守区片段,发现缺少5端序列,参照TaKaRa公司的SMART 5RACE对该基因进行5端扩增。设计5端RACE引物(表1),以反转录cDNA为模板,克隆EjNADP-ME2基因5端序列,用克隆得到的序列与保守区片段的序列拼接后的全长设计ORF引物验证,引物由铂尚生物技术有限公司合成。以枇杷果实取逆转录产物1 ?L为模板对EjNADP-ME2基因进行5RACE第1轮扩增,建立25 ?L如下PCR反应体系:10×Ex-Taq Buffer 2.5 ?L;dNTP Mixture(10 mmol/L)0.5 ?L;上、下游引物(10 mmol/L)各0.5 ?L;cDNA模板1 ?L;Ex-Taq(5 U/?L)0.3 ?L,加ddH2O至 25 ?L。按照如下扩增程序进行:94 ℃预变性8 min;循环35次(94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸120 s,72 ℃ 8 min)后。以第1轮PCR产物稀释100倍作为第2轮扩增的模板,反应体系和条件和第1轮相同,PCR 产物经胶回收纯化后连接到pUCm-T载体上,转化DH5α感受态细胞,用通用引物M13进行菌液PCR检测,筛选正确的阳性克隆子送深圳华大基因股份有限公司测序。
在EjNADP-ME2的编码区序列起始密码子ATG上游设计3个向外的PCR引物SP1、SP2和SP3(表1),以基因组DNA为模板,参照TaKaRa公司的染色体步移试剂盒进行3次染色体步移,回收PCR产物并连接到pUCm-T载体上,构建重组质粒转化到DH5α感受态细胞,筛选阳性克隆,送往华大基因公司测序。
1.2.4 EjNADP-ME2基因的实时荧光定量(qPCR)表达分析 采用Beacon Designer 7软件分别设计内参基因Actin和目的基因荧光定量的引物(表1)。实时荧光定量PCR体系和程序均参照TaKaRa 公司的SYBR? Premix Ex TapTM Ⅱ试剂盒说明书进行操作。使用耶拿qTOWER2.2荧光定量仪完成定量分析。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,45个循环。每个样品设3个生物重复和3个技术重复,利用 2–ΔΔCT对定量数据进行分析。
1.2.5 EjNADP-ME2基因的生物信息学分析 使用DNAMAN进行比对和拼接目的基因序列。利用ExPASy工具中ProtParam(https://web. expasy.org/protparam/)程序对氨基酸序列的组成分子、分子量、等电点及编码蛋白的亲水性进行分析;NetPhos 3.1 Server分析磷酸化位点;TMHMM Sever 2.0(http://www.cbs.dtu.dk/services/TMH M M/)预测蛋白的跨膜区;使用在线软件SoftBerry ProtComp 9.0(http://linux1.softberry.com/b err y.p html)进行亚细胞定位预测;SignalP 4.1 (http://ww w.cbs.dtu.dk/services/SignalP/)预测信号肽;SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/n p s a_automat.pl?page=/NPSA/npsa_sec cons. html)预测蛋白的二级结构;Phyre 2(http://www. sbg. bio. ic. ac. uk/phyre2/html)在线预测蛋白三级结构;启动子的顺作用元件分析在PlantCar(http://bioinformatic.psp.ugent. be/webtools/plan tc are/heml)Place(https://sogo.dna.affrc.go.jp/cg ibin/sogo.cgi?sid=&pj=640&action=newPlaceSite&site=S000362)網页中共同分析完成。
1.2.6 数据分析及相关性评估 采用SPSS19.0软件和Microsoft Excel 2016软件对数据进行统计分析。利用Pearson相关系数评价EjNADP-ME2基因表达量与枇杷果肉苹果酸含量之间的关系。
2 结果与分析
2.1 枇杷果实中苹果酸含量的变化
利用HPLC对‘解放钟和‘白梨的苹果酸含量进行测定,结果显示均呈现出先升高后降低的趋势(图1)。此外,两者在果实发育前期的苹果酸含量不存在显著差异,花后95 d时两者的苹果酸达到最大值,果实发育后期(花后95 d以后)低酸品种苹果酸的降解幅度显著高于高酸的幅度,是导致2个品种之间酸度差异的主要原因。
2.2 EjNADP-ME2基因cDNA全长序列克隆及分析
基于‘解放钟和‘白梨果肉发育过程中转录组测序,分析得Unigene0001461(NADP- ME2)在2个品种果肉发育后期具有显著差异,利用Blast数据库对该基因与同源基因进行比对,结果显示该基因缺少5端序列。在此片段的基础上设计2轮巢式PCR的引物(表1),对EjNADP-ME2基因进行5端扩增得289 bp的片段(图2C),最后利用特异性引物扩增该基因的(ORF)全长,经过测序拼接之后获得该基因的ORF为1863 bp(图2B)。所得的序列与苹果、白梨的序列具有95%以上的同源性,因此将该基因命名为EjNADP-ME2。
2.3 EjNADP-ME2编码蛋白质生物信息学分析
2.3.1 EjNADP-ME2编码蛋白质的理化性质 利用ProtParam程序分析EjNADP-ME2编码蛋白质的理化性质,结果表明,该基因编码621个氨基酸(图3)。理论上的蛋白分子量67895.23 u,理论等电点(pI)为6.56,分子式为:C3061H4851N811O892 S19。半衰变期为30 h,不稳定系数为30.72(<40),平均亲水性0.094,属于稳定的非亲水蛋白。NetPhos 3.1 Server分析推测该蛋白质多肽链上总共含有78个磷酸化位点。TMHMM Sever 2.0结果表明不存在跨膜区。SignalP 4.1预测显示不存在信号肽序列,表明其是非分泌蛋白。SoftBerry ProtComp 9.0在线预测EjNADP-ME2蛋白位于细胞质,其预测值为6.2。
2.3.2 EjNADP-ME2编码蛋白质的二级和三级结构分析 使用在线数据库SOPMA对NADP-ME蛋白进行二级结构预测,结果显示,该蛋白质由39.29%的α-螺旋、16.26%的延伸链和44.44%随机卷曲三部分结构组成,由此可知该蛋白质主要是由随机卷曲结构组成。SWISS-MODEL对EjNADP-ME2蛋白的三级结构进行模拟,GEOM分值为0.74,表明该模型的可信度很高。
2.4 EjNADP-ME2保守结构域及系统进化分析
对苹果(Malus domestica)、梨(Pyrus bretschneideri)、李(Prunus avium)、桃(Prunus persica)、草莓(Fragaria vesca subsp. Vesca)、月季(Rosa chinensis)、葡萄(Vitis vinifera)、番茄(Solanum lycopersicum)、烟草(Nicotiana attenuata)、拟南芥(Arabidopsis thaliana)及枇杷(Eriobotrya japonica)中NADP-ME蛋白氨基酸的保守序列进行分析(图4)。结果表明:均存在10个Motifs,且前9个 Motifs均有50个保守序列(表2)。
在单子叶植物和双子叶植物中,选取19个物种,通过从NCBI中下载氨基酸的同源序列,利用MEGA7.0构建系统进化树,结果见图5,
2.5 EjNADP-ME2基因启动子的克隆及序列分析
以‘解放钟枇杷基因组DNA为模板,利用染色体步移的方法获得EjNADP-ME2启动子序列721 bp(图2D)。将得到的启动子序列提交到在线工具PlantCare和PLACE进行预测和分析,结果显示(图6):该基因的启动子顺式作用元件除包括大多数植物启动子序列的一些保守元件如启动子和增强子区域CAAT-Box,厌氧诱导作用元件ARE,G-motif、光响应调控元件G-Box、转录开始30左右的核心启动子元件。还有一些与激素有
图5 EjNADP-ME2氨基酸序列的系统进化树
Fig. 5 The phylogenetic tree of EjNADP-ME2 amino acid sequence
图6 EjNADP-ME2启动子序列及顺式作用元件
Fig. 6 EjNADP-ME2 promoter sequence and cis-acting element
关的作用元件如脱落酸响应元件、茉莉酸响应元件、水杨酸响应元件。此外,该启动子还存在转录因子MYB、MYC结合位点MBS。
2.6 EjNADP-ME果实发育过程中的表达分析
利用荧光定量PCR技术对‘解放钟和‘白梨果实发育过程EjNADP-ME2的表达检测,结果表明,‘解放钟和‘白梨的EjNADP-ME2具有相似的表达模式,均表现出先降低后升高又降低的趋势(图7),在果实发育前期(50~80 d)EjNADP-ME2基因在‘解放鐘中总体的转录水平与‘白梨之间差异不显著,该基因的表达量在花后95 d时均达到最低值,果实成熟期(花后110 d)高酸品种的表达量显著高于低酸品种。
2.7 枇杷果实苹果酸含量与EjNADP-ME2基因表达的相关性
利用SPSS19.0软件对2个枇杷品种果实发育时期的的苹果酸含量与EjNADP-ME基因的表达量进行相关性评价。结果表明,在低酸品种“白梨”果实发育时期内,苹果酸含量与EjNADP-ME基因表达量之间的Pearson值为0.779,呈显著负相关,但在高酸品种果实发育过程中,两者的之间为Pearson值为0.117,高酸品种中苹果酸含量与EjNADP-ME基因表达量之间不存在显著的相关性。
3 讨论
利用HPLC技术对高酸品种‘解放钟和低酸品种‘白梨果实发育期的果肉进行有机酸的测定,结果表明,在果实发育前期(即花后80 d以前),2个品种中的苹果酸的含量不存在差异。在花后95 d时,高酸和低酸品种的苹果酸含量达到最大值。在果实发育后期(花后95 d以后)低酸品种的降解速度和幅度明显高于高酸品种,陈发兴等[17]研究表明在花后的105 d时果实中的苹果酸含量达到最高随后降低,可能是因为实验材料所处的地理位置不同所致,但苹果酸含量的总体变化趋势相一致,所以仍然可以说明高酸和低酸品种在果实发育后期苹果酸降解速度不同可能是导致2个品种酸度差异的主要原因。
在高等植物中,NADP-苹果酸酶由1个小的基因家族编码。水稻中的NADP-ME家族由3个细胞质NADP-ME和1个质体型NADP-ME构成,并且4种NADP-ME的氨基酸序列具有很高的相似性[5]。Tao等[18]分析了12种十字花科植物的NADP-ME家族成员,结果表明NADP-ME的5个基因表现出差异表达模式,每个基因都可能具有特定的生物功能。Wheeler等[19]从拟南芥中克隆出4种NADP-ME基因的序列,并且通过Gus染色技术结果表明NADP-ME2是调控拟南芥成熟组织中NADP-ME活性的关键酶基因。本研究从枇杷果实转录组中筛选出表达量较高且在两品种之间有显著表达差异的EjNADP-ME(Unigene 0001461)基因。采用RACE技术克隆出EjNADP- ME2的cDNA全长,该基因cDNA的全长序列2159 bp,编码621个氨基酸,通过亚细胞定位软件结果显示EjNADP-ME2位于细胞质中。EjNADP-ME2基因与其他物种具有相似的功能结构域,表明该基因可能调控苹果酸的合成。从系统进化树中可以看出EjNADP-ME2基因在物种进化上具有较高的保守性。
目前,关于EjNADP-ME2基因启动子的研究未见报道。本实验利用染色体步移的技术成功克隆到EjNADP-ME2起始密码子上游721 bp启动子片段。对启动子序列进行生物信息学分析,结果显示,其含有大多数基因启动子的保守元件。此外,还有一些MYC和MYB的结合位点,说明EjNADP-ME2有可能受该转录因子的调控,这为进一步探究EjNADP-ME2基因如何调控苹果酸的降解提供了依据。
已有人研究EjNADP-ME2基因表達与水果果实中苹果酸积累之间的关系,Yao等[20]研究表明在苹果成熟期间EjNADP-ME的转录对苹果酸的积累起负调控的作用。Etienne等[21]成功克隆出桃中6个关键酶基因并且对各个基因的表达量进行了分析,结果表明各个基因的表达量与苹果酸的积累没有必然联系。Mu等[22]通过分析李的转录组及对苹果酸相关基因的表达量进行检测,发现虽然NADP-ME基因是苹果酸代谢过程的关键基因,但对李果实发育过程中的有机酸积累并没有起到决定性的作用。本实验利用RT-qPCR对2个品种的EjNADP-ME2基因的表达量进行了测定。结果表明,高酸和低酸品种的EjNADP-ME2表达量的变化趋势大致相同,在果实发育前期,该基因的表达量均逐渐减小,在花后80 d两个品种的转录水平均达到最低,此时苹果酸的含量达到最大值。花后80 d,果实的苹果酸含量随EjNADP-ME2基因表达量升高而降低。利用SPSS软件分析对EjNADP-ME2基因表达与果实苹果酸积累的相关性进行分析,结果显示‘白梨中该基因转录水平与苹果酸含量呈显著负相关,说明EjNADP- ME2基因可能是导致低酸的关键因素,这与李明等[15]的研究结果一致。在果实发育前期‘解放钟EjNADP-ME2基因的表达量略高于‘白梨,在实发育后期(110~125 d),该基因在两者之间的表达水平呈现显著差异。由此说明两品种之间的酸度差异不是主要由该基因引起的,可能还受其他苹果酸代谢相关基因的调控。这与Yang等[23]的结果相似。
参考文献
Shaw P E, Wilson C W. Determination of organic acids and sugars in loquat (Eriobotrya japonica Lindl) by high-pressure liquid chromatography[J]. Journal of the Science of Food and Agriculture, 1981, 32: 1242–1246.
陈发兴, 刘星辉, 陈立松. 枇杷果肉有机酸组分及有机酸在果实内的分布[J]. 热带亚热带植物学报, 2008, 16(3): 236-243.
Etienne A, Génard M, Lobit P, et al. What controls fleshy fruit acidity? A review of malate and citrate accumulation in fruit cells[J]. Journal of Experimental Botany, 2013, 64(6): 1451-1469.
陈发兴, 刘星辉, 林华影, 等. 离子交换色谱法测定枇杷果实和叶片中的有机酸[J]. 福建农林大学学报(自然科学版), 2004, 33(2):195-199.
Edwards G E, Andreo C S. NADP-malic enzyme from plants[J]. Phytochemistry, 1992, 31(6): 1845–1857.
Chi W, Yang J, Wu N, et al. Four rice genes encoding NADPmalic enzyme exhibit distinct expression profiles[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(9): 1865-1874.
Laporte M M, Shen B, Tarczynski M C. Engineering for drought avoidance: expression of maize NADP-malic enzyme in tobacco results in altered stomatal function[J]. Journal of Experimental Botany, 2002, 53(369): 699–705.
van Doorsseleare J, Villaroel R, vonMontagu M, et al. Nucleotide sequence of a cDNA encoding malic enzyme from poplar[J]. Plant Physiology, 1991, 96: 1385–1386.
Yoshida M. Genétical studies on the fruit quality of peach varieties. I. Acidity[J]. Bulletin of the Horticultural Research Station (in Japanese), 1970(A9): 1-15.
Franke K E, Adams D O. Cloning a full-length cDNA for malic enzyme (EC 1.1.1.40) from grape berries[J]. Plant Physiology, 1995, 107: 1009-1010.
Zhang Y, Li P, Cheng L. Developmental changes of carbohydrates, organic acids, amino acids, and phenolic compounds in ‘Honeycrisp apple flesh[J]. Food Chemistry, 2010, 123(4): 1013-1018.
Saradhuldhat P, Paull R E. Pineapple organic acid metabolism and accumulation during fruit development[J]. Scientia Horticulturae, 2007, 112(3): 297-303.
Iwakura M, Hattori J, Arita Y, et al. Studies on regulatory functions of malic enzymes[J]. Biochemical Journal (Tokyo), 1979, 85: 1355-1365.
Chi W, Yang J, Wu N, et al. Four rice genes encoding NADPmalic enzyme exhibit distinct expression profiles[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68: 1865-1874.
李 明, 姚玉新, 劉 志, 等. 苹果果实中细胞质型苹果酸酶基因(NADP-ME)的克隆与表达分析[J]. 中国农学通报, 2007, 23(7):95-100.
Chen F X, Liu X H, Chen L S. Ethychlozate reduces acidity of loquat (Eriobotrya japonica) fruit[J]. Scientia Horticulturae, 2010, 124(3): 331-337.
Chen F X, Liu X H, Chen L S. Developmental changes in pulp organic acid concentration and activities of acid-metabolising enzymes during the fruit development of two loquat (Eriobotrya japonica Lindl.) cultivars differing in fruit acidity[J]. Food Chemistry, 2009, 114(2): 657-664.
Tao P, Guo W, Li B, et al. Genome-wide identification, classification, and analysis of NADP-ME family members from 12 crucifer species[J]. Molecular Genetics & Genomics , 2016, 291(3): 1167-1180.
Wheeler M C, Tronconi M A, Drincovich M F, et al. A comprehensive analysis of the NADP-malic enzyme gene family of Arabidopsis[J]. Plant Physiology, 2005, 139(1): 39-51.
Yao Y X, Li M, Liu Z, et al. Molecular cloning of three malic acid related genes MdPEPC, MdVHA-A, MdcyME, and their expression analysis in apple fruits[J]. Scientia Horticulturae, 2009, 122(3): 404-408.
Etienne A, Moing A, Dirlewanger E, et al. Isolation and characterization of six peach cDNAs encoding key proteins in organic acid metabolism and solute accumulation: involvement in regulating peach fruit acidity[J]. Physiologa Plantarum, 2002, 114: 259–270.
Mu X, Wang P, Du J, et al. Comparison of fruit organic acids and metabolism-related gene expression between Cerasus humilis (Bge.) Sok and Cerasus glandulosa (Thunb.) Lois[J]. PLoS ONE, 2018, 13(4): e0196537.
Yang L T, Chen L S. Expression of six malate-related genes in pulp during the fruit development of two loquat (Eriobotrya japonica) cultivars differing in fruit acidity[J]. African Journal of Biotechnology, 2011, 4314: 1684-5315.