虫生真菌Isaria cateniannulata次级代谢产物及抗肿瘤活性研究
石佩星 李晓芳 解飞翔 张炳文
(1.河北大学生命科学学院,药物化学与分子诊断教育部重点实验室,河北保定 071002;2.河北大学药学院,药物质量控制河北省重点实验室,河北保定 071002)
摘要[目的]对虫生真菌环链棒束孢(Isaria cateniannulata)的次级代谢产物进行分离并研究其抗肿瘤活性。[方法]采用溶剂萃取、硅胶柱色谱、凝胶Sephadex LH-20等方法进行分离纯化,根据理化性质和波谱技术对分离得到的化合物进行结构鉴定,利用MTT法对化合物的抗肿瘤活性进行测试。[结果]从虫生真菌Isaria cateniannulata中共分离得到8个化合物,分别为β-麦角甾醇、豆甾-4-烯-3-酮、5α,8β-过氧-(22E,24R)-麦角甾-6,22-二烯3β-醇、4-methyl-5,6-dihydro-2H-pyran-2-one、(R)-甲羟戊酸内酯、对羟基苯甲醛、β-石竹烯和石竹烯氧化物。除化合物4外,其余化合物均是从该种中首次分离得到。抗肿瘤结果显示,化合物7、8对肿瘤细胞具有一定的抑制能力。[结论]该研究为新的抗肿瘤药物开发方面提供了广阔空间。
关键词虫生真菌;环链棒束孢;倍半萜类化合物;抗肿瘤活性;结构鉴定
中图分类号R284.1文献标识码A
文章编号0517-6611(2019)03-0196-03
doi:10.3969/j.issn.0517-6611.2019.03.061
环链棒束孢(Isaria cateinannulata)是棒束孢属中的一种非常重要的虫生病原菌,而且在自然界中分布广泛[1]。对该属的研究主要以玫烟色棒束孢和粉棒束孢为主,而对环链棒束孢研究较少。到目前为止,对于环链棒束孢的报道较多集中在植物病虫害防治领域,朱新燕等[2]对环链棒束孢不同菌株的固体培养条件进行研究;刘爱英[3]就环链棒束孢对于几种昆虫的治病效果进行研究,但对于环链棒束孢的次级代谢产物的系统研究鮮见报道。笔者为了寻找新型的具有抗肿瘤活性的化合物,采用溶剂萃取、硅胶柱色谱、凝胶Sephadex LH-20等方法对虫生真菌环链棒束孢进行分离纯化,根据理化性质和波谱技术对分离得到的化合物进行结构鉴定,并利用MTT法对化合物的抗肿瘤活性进行测试。
1材料与方法
1.1试验材料
1.1.1仪器。旋转蒸发仪R-210(瑞士BUCHI公司);核磁共振仪AM-600(德国BRUKER公司);双层恒温摇床ZHWY(上海智城分析仪器有限公司);超净工作台ZHJH-C1112C(上海智城分析仪器有限公司);薄层层析硅胶板(烟台化学工业研究所);柱层析硅胶(200~400目,烟台化学工业研究所);Sephadex LH-20(瑞典GE Healthcare公司)。
1.1.2培养基。PDA培养基:葡萄糖40 g,去皮土豆400 g,加蒸馏水至2 000 mL,pH 6.5。大米固体培养基:100 mL蒸馏水,80 g大米。
1.1.3
试验菌株。该试验所用菌种为环链棒束孢(Isaria cateniannulata),购自安徽农业大学,保存于河北大学药物化学与分子诊断重点实验室菌种库。
1.1.4
供试肿瘤细胞株。人肝癌细胞(Huh-7)、人宫颈癌细胞(Hela)、人胃癌细胞(MGC-803)、人乳腺癌细胞(MCF-7)以及人肺癌细胞(A549)在-196 ℃液氮中冻存。
1.2试验方法
1.2.1
发酵与分离。将Isaria cateniannulata菌种接种到PDA液体培养基中,于26 ℃、150 r/min恒温摇床中培养6 d,得到3 L种子液。将3 L种子液以10%的接种量接种到大米培养基中(共30 L),室温培养30 d,得到固体发酵物。
将Isaria cateniannulata的大米发酵物收集,以1.5倍的体积加入乙酸乙酯萃取,每次浸泡48 h,共萃取6次,合并萃取液,减压浓缩得到浸膏107 g。将107 g浸膏与等体积硅胶拌匀,室温下干燥。进行加压柱层析,用石油醚/乙酸乙酯系统梯度洗脱[100∶0、20∶1、15∶1、10∶1、8∶1、6∶1、4∶1、2∶1、1∶1(V/V)],经TCL检测之后合并,得到Fr1~Fr5共5个部分。经反复硅胶柱层析、Sephadex LH-20凝胶过滤、薄层TLC制备以及重结晶后得到化合物1~8。
1.2.2
活性筛选。将5个细胞株取出,置于37 ℃水浴锅复苏,待其解冻后吸出细胞悬液分别放入4个培养瓶中,加入细胞培养液。置于37 ℃、5%CO2的培养箱中培养。传代培养3次,每3 d传代一次,使细胞恢复健康状态。胰酶消化细胞:用3 mL PBS清洗一次细胞,然后加入1 mL胰酶,37 ℃孵育1~3 min,终止消化。在96孔板中每孔接种100 μL,其含有8 000个细胞。第2天,观察细胞密度,待细胞培养至汇合率80%左右,加药处理。分别将化合物7、8母液进行梯度式稀释,每孔加入2 μL各浓度样品稀释液,使其作用浓度分别为100.00、50.00、25.00、12.50、6.25 μL,每组设3个平行,同时设置阴性对照。样品处理细胞24 h,避光每孔均加入20 μL MTT溶液。37 ℃培养箱中孵育4 h,然后每孔加入100 μL SDS-HCl,孵育过夜。在酶标仪SpectraMax M2上测试各孔570 nm的吸光度值。
抑制率=[(对照组OD570-样品处理组OD570)/对照组OD570]×100%,根据寇式改良公式计算各个样品相应细胞株的IC50,即死亡细胞数与总细胞之比为50%时所对应的样品浓度。
2结果与分析
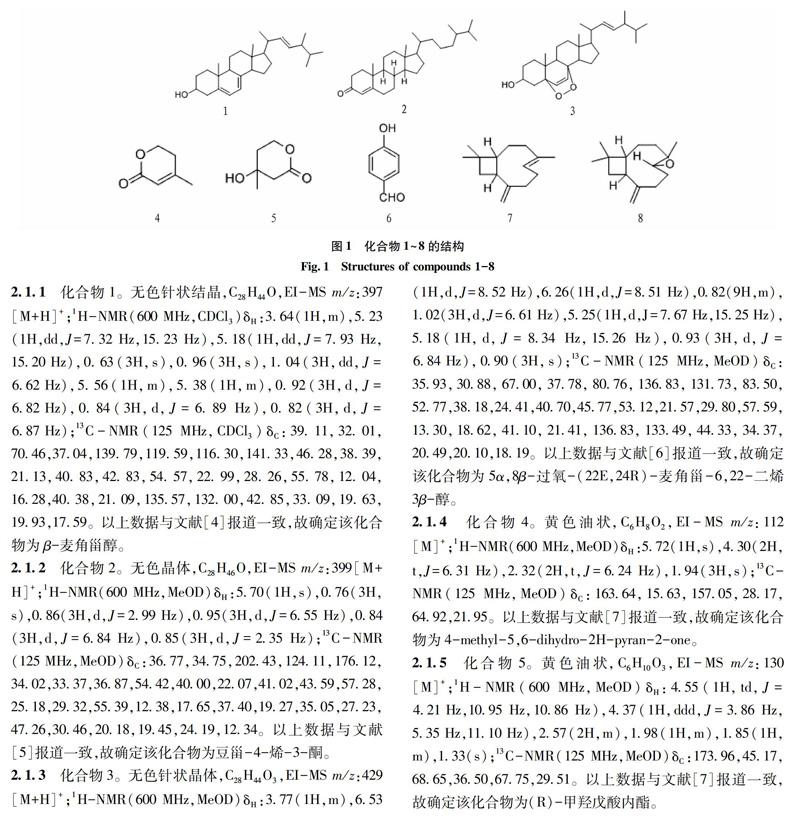
2.1结构鉴定该试验通过对Isaria cateniannulata进行大米发酵培养,从其乙酸乙酯的萃取物中共分离到8个化合物,分别为化合物1(62.7 mg)、化合物2(22.7 mg)、化合物3(11.2 mg)、化合物4(9.7 mg)、化合物5(13.3 mg)、化合物6(21.5 mg)、化合物7(11.4 mg)、化合物8(2.2 mg)。化合物的結构见图1。
2.2活性测试结果
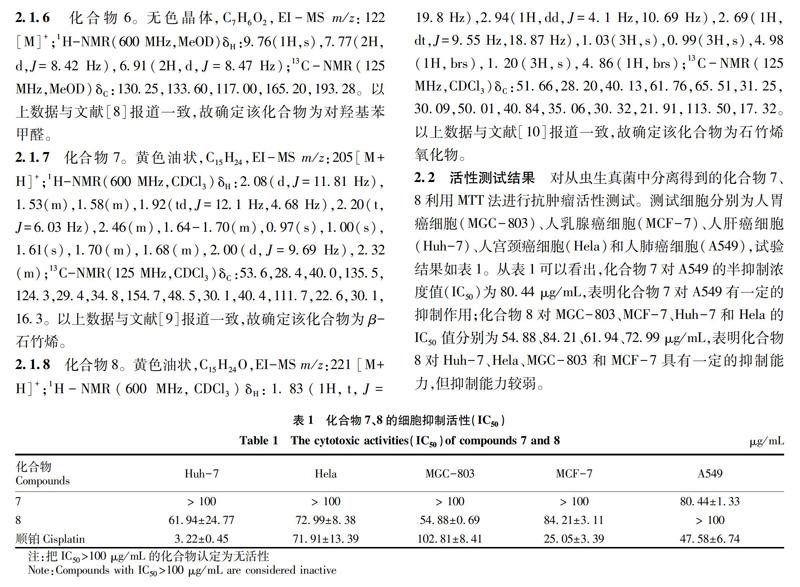
对从虫生真菌中分离得到的化合物7、8利用MTT法进行抗肿瘤活性测试。测试细胞分别为人胃癌细胞(MGC-803)、人乳腺癌细胞(MCF-7)、人肝癌细胞(Huh-7)、人宫颈癌细胞(Hela)和人肺癌细胞(A549),试验结果如表1。从表1可以看出,化合物7对A549的半抑制浓度值(IC50)为80.44 μg/mL,表明化合物7对A549有一定的抑制作用;化合物8对MGC-803、MCF-7、Huh-7和Hela的IC50值分别为54.88、84.21、61.94、72.99 μg/mL,表明化合物8对Huh-7、Hela、MGC-803和MCF-7具有一定的抑制能力,但抑制能力较弱。
3结论
该研究对虫生真菌环链棒束孢Isaria cateniannulata的次级代谢产物进行分离鉴定,共分离鉴定出8种化合物,分别为β-麦角甾醇、豆甾-4-烯-3-酮、5α,8β-过氧-(22E,24R)-麦角甾-6,22-二烯3β-醇、4-methyl-5,6-dihydro-2H-pyran-2-one、(R)-甲羟戊酸内酯、对羟基苯甲醛、β-石竹烯和石竹烯氧化物,其中8种化合物均为首次从该种中分离得到。对化合物7、8进行抗肿瘤活性测试,结果显示,化合物7对A549具有一定的抑制能力,化合物8对Huh-7、Hela、MGC-803和MCF-7具有一定的抑制能力,但是抑制能力均较弱。
安徽农业科学2019年
参考文献
[1] 张德龙,王小董,陆瑞利,等.液体或固体培养对环链棒束孢(Isaria cateinannulata)菌丝体中挥发性成分组成的影响[J].微生物学报,2011,51(12):1616-1624.
[2] 朱新燕,李增智,樊美珍,等.3株环链拟青霉固体培养条件的研究[J].安徽农业大学学报,2008,35(1):38-41.
[3] 刘爱英,陈月碧,梁宗琦,等.环链拟青霉和玫烟色拟青霉对菜青虫致病条件的研究[J].贵州农业科学,1982(1):57-59.
[4] 万辉.褐圆孔牛肝菌化学成分的研究[J].中草药,2000,31(5):328-330.
[5] 李小军,袁燕,李芝,等.苗药冠盖藤的化学成分研究[J].中草药,2014,45(8):1052-1055.
[6] 和东阳,王利勤.神黄豆果实化学成分的研究[J].中国现代应用药学,2014,31(11):1355-1359.
[7] YING Y M,ZHANG L W,SHAN W G,et al.Secondary metabolites of Peyronellaea sp.XW-12,an endophytic fungus of Huperzia serrata[J].Chem Nat Compd,2014,50(4):723-725.
[8] 胡琳,丁智慧,刘吉开.灰黑拟牛肝菌的化学成分[J].云南植物研究,2002,24(5):667-670.
[9] RAGASA C Y,ESPINEI D L,AGOO E M G,et al.Chemical constituents of Cinnamomum cebuense[J].Chin J Nat Med,2013,11(3):264-268.
[10] RAGASA C Y,GANZON J,HOFILEA J,et al.A new furanoid diterpene from Caesalpinia pulcherrima[J].Chem Pharm Bull,2003,51(10):1208-1210.

