包膜尿素氮释放模拟与黑土简化施氮研究
赵京考,吴德亮,仝利朋,宋丹丹,王 端
(东北农业大学资源与环境学院,黑龙江 哈尔滨 150030)
【研究意义】作为主要氮肥品种的尿素,虽然本身具有一定的缓释性(其一般释放期约40 d),对于生育期长达120 d的玉米来说,整个生育期需要数次施氮才能满足作物的氮需求[1]。随着作物生产的发展,减少施肥次数、降低施肥成本、增加作物产量、提高作物品质的肥料品种与施肥方法逐渐成为新的发展趋势[2-5]。【前人研究进展】包膜尿素是基于此种设想的氮肥品种,目的是通过物理包膜、控制尿素释放的方式对尿素的释放速度加以调控以适应作物生长不同阶段对氮素的需求[3-4,6-7]。氮肥形态对作物的氮吸收、氮素损失和肥料利用率有着较大的影响[1,8]。目前,虽然氮肥的来源多样,但其形态大部分是铵态氮、硝态氮和酰胺态,三者均来自于合成氨工业[8]。三者之中,在土壤中最为稳定的是容易被土壤粘土颗粒吸附的带正电荷的铵态氮,其次是电中性的酰胺态尿素,最容易损失的氮素形态是带负电荷的硝态氮,同时也是旱田氮素的主要存在形态[9]。包膜尿素提高氮素利用率的最大潜能是它能够延迟氮肥的释放速度,以便更好地与作物需求相匹配。往往希望一次施肥能够满足整个作物生育期对氮素的需求,并且将土壤内的矿物氮素水平保持在较低的水平。包膜肥料可以降低施肥次数、减少人工与机械支出,降低氨挥发,提高氮肥效率[10-11]。【本研究切入点】玉米是东北地区的主要旱作作物,其生育期在110~130 d。在苗期,由于植株矮小,根系欠发达,对氮肥的需求较低;拔节期以后植株呈加速生长态势,对氮素的需求也呈指数上升,并在开花期达到最高。玉米生育后期对氮素的需求有所降低,但是缺氮仍可能影响籽粒的形成。尿素的释放在施肥后8~10 d达到高峰,生成的高浓度铵离子极有可能形成氨气释放到大气中,不但造成氮肥的损失,同时造成大气的污染[5,8]。防止短期内大量铵离子在土壤内的积聚是降低氮损失的方式之一[1,8]。虽然硫包膜尿素和树脂包膜尿素同属包膜尿素,二者无论是包膜材料还是氮素释放模式均不同[9]。材料遇水后,经目测观察,硫包膜尿素颗粒的形变远小于树脂包膜尿素,后者遇水会膨大,从小米粒大小膨大到黄豆颗粒大小。包膜尿素颗粒破裂得越晚,尿素颗粒保持在膜内的时间越长,后续释放时间越长,对作物后期生长越有利[3,9]。评价氮素释放形态优劣的手段目前主要是基于产量和产量构成因素的分析, 缺少产量与供氮水平之间关系的直接证据[2,4,6]。因为,除受到氮素供给影响之外,作物产量还受到其他诸多因素特别是土壤水分的影响[12]。在土体内,包膜尿素释放后产生的氮素在时间-空间上呈动态分布,在东北地区,在大多数地区不具备灌溉条件的情况下,依据氮素-产量关系对包膜尿素的氮素供给得出的结论往往具有很多不确定性。在时间上,一般规律是前期高,后期低;在空间上,一般是上层高,下层低。同一个处理,在不同的土层表现出较大的氮素供给差异,给处理之间的氮素供给类型优劣的比较造成了较大困扰[4,6]。利用1 m土体内氮素的含量而不是氮素的浓度可以更好地区分不同氮素处理之间的差异[7,10]。【拟解决的关键问题】一是对硫包膜和树脂包膜尿素的氮释放过程进行室内模拟并比较2种包膜尿素的释放特征;二是比较同等施氮量条件下2种包膜尿素的土壤供氮能力,并以此为依据,判断包膜尿素一次性施肥代替传统“底肥+追肥模式”的可行性。
1 材料与方法
1.1 试验地概况
本实验于2013、2014年5-10月在东北农业大学新农村发展研究院阿城实验实习基地进行,试验地地理坐标为127°2′3.1′′E,45°31′11.6′′N,海拔144 m,试验地土壤类型为草甸黑土,土壤有机质含量38.90 g·kg-1,土壤全氮含量1.36 g·kg-1,碱解氮119.00 mg·kg-1,速效磷28.30 mg·kg-1,速效钾123.40 mg·kg-1。试验地平坦。
1.2 材料
室内模拟试验与田间试验所用材料均为市售硫包膜尿素SCU(N 36.9 %)、美国进口树脂包膜尿素PCU(N 44.5 %)。
1.3 试验设计
1.3.1 氮素释放室内模拟试验 包膜氮肥的氮释放参数测定采用水浸法[1,7,9,11,15]。放入水中的包膜尿素膜外尿素浓度远低于膜内浓度,在膜的内外形成了尿素溶液的化学势差,水分从水势高的膜外流向水势低的膜内。同时,由于扩散作用,尿素分子从浓度高的膜内扩散到尿素浓度低的膜外。不同时间氮素释放量称之为溶出率,用下式表示:
(1)
式中,p为溶出率,m为样品培养时间(d),Nt为包膜尿素的起始氮素总含量。当m=1时,定义p为初期溶出率,m时间段内(d)p值为累积释放率。
水浸法:在尼龙网袋内放入5.00 g样品。将装有样品的网袋浸入盛有100.00 mL蒸馏水的容器内密封,置于恒温培养箱在不同温度下培养。试验设2个氮肥品种(硫包膜、树脂包膜尿素),3个温度水平(20,25,30 ℃),共6个处理,3次重复。定期取样。取样前手摇容器混匀内容物,过滤后测定浸提液的氮浓度。将部分释放氮素后的网袋重新放入培养容器内,再加100.00 mL蒸馏水重新置于恒温培养箱中继续培养。如此反复,直至袋内氮素全部溶于水[1,11]。
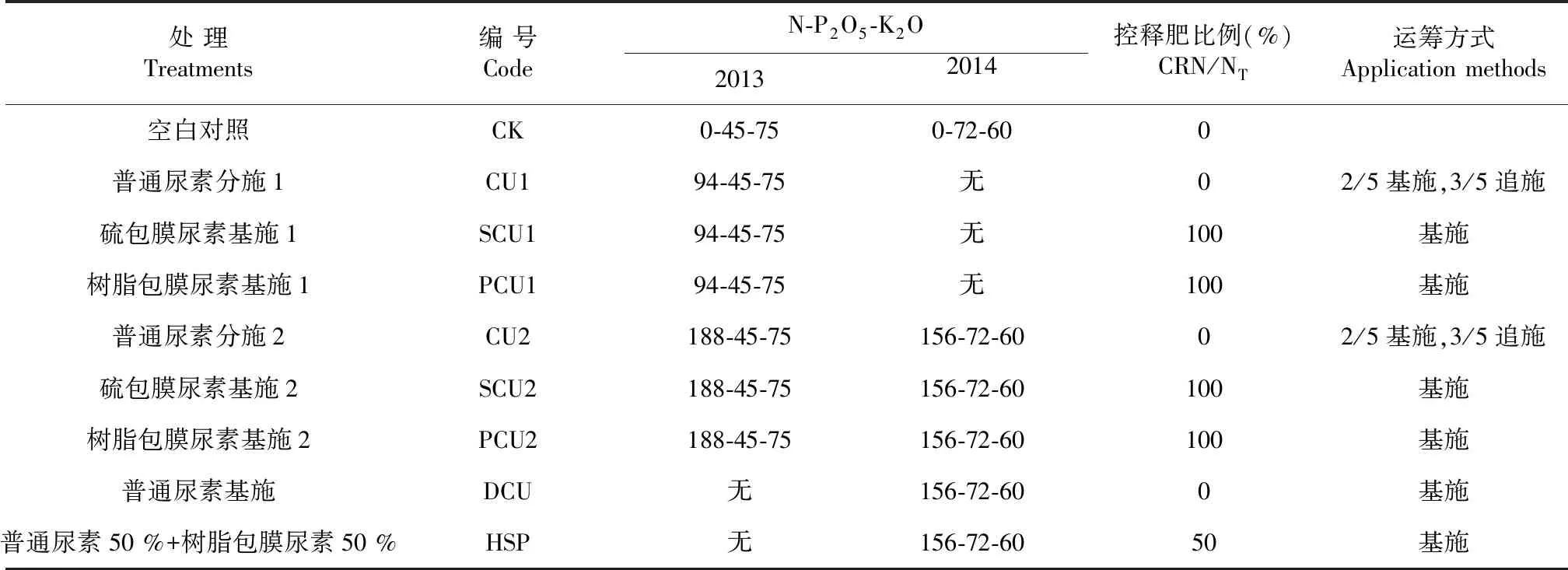
表1 试验处理与施肥量(kg·hm-2,CRN/NT为控释氮肥占总施氮量的比例)
1.3.2 田间试验 2013年,试验设置3个氮水平、2种包膜肥料(硫包膜、树脂包膜尿素),共7个处理,采用随机区组排列,小区面积为60.0 m2。所用玉米品种为先玉335,品种生育期为126 d,种植密度为60 000株·hm-2。除处理CU1、CU2为分次施肥外,其他处理的氮肥均作基肥一次性施入,磷肥和钾肥全部作基肥施入。各处理肥料用量见表1。在2013年实验结果的基础上,2014年将总施氮量调整为156 kg·hm-2,试验新增氮素一次基施和50 %普通尿素加50 %树脂包膜尿素处理, 以检验降低树脂包膜比例的施氮效果(表1)。
取样时期分别为拔节期、灌浆期、成熟期,取样深度分别为0~30,30~60,60~100 cm。
试验地原地培养[13]:准备网孔直径为60目的网袋若干,备用。每个网袋装入10.00 g样品。于垄沟内挖深、宽分别为15、12 cm的垄沟, 将盛有样品的网袋按5 cm间距放置于垄沟的底部,填平。采取“前期密,后期稀”的原则取样,取样时间分别为埋样后的第1、4、7、14、19、23、28、40、47、54、61天。每次测定3个样品。样品取出后用蒸馏水清洗袋外粘附土壤,并在无污染的条件下晾至无可见水,将样品低温(60 ℃)烘干。根据释放前后的网袋重量差计算氮素释放率。
1.4 土壤含氮量的测定
称取5.00 g鲜土,移入250 mL三角瓶中;用移液管加入50 mL浓度为2 mol/L的KCl溶液提取液,振荡30 min后过滤。测定滤液中NO3-N、NH4-N含量[流动分析仪(AA3)法],同时取样用烘干法测定土壤含水量用以氮素含量的计算。
1.5 数据处理与分析方法
运用Microsoft Excel 365和SPSS 17.0进行数据分析。
生长期土壤有效氮计算公式[14]:
(2)
式中,N为1 m土层内有效氮含量(kg·hm-2),n1,n2,…,nm为1 m土层内不同分层NO3-N含量(mg·kg-1),d1,d2,…,dm为土层分层厚度(cm)。
2 结果与分析
2.1 包膜尿素的氮养分释放模拟
2.1.1 树脂包膜尿素 从图1可以看出,在20 ℃条件下,树脂包膜尿素的氮释放速度大致经历了4个阶段[11,13]。第一阶段从第1~17天,树脂包膜尿素释放了全氮的5.00 %,平均氮释放速率为0.30%/d;第二阶段从第18~75天,氮素释放总量的54.00 %,平均氮释放速率为0.95 %/d;第三阶段从第76~105天,氮素释放总量的3.00 %,平均氮释放速率为0.45 %/d;第四阶段从第77~155天,氮素释放总量的7.00 %,平均氮释放速率为0.14 %/d。在25 ℃条件下,树脂包膜尿素可区分为2个阶段。第一阶段从第1~47天,氮释放总量的63.00 %,平均氮素释放率为1.34 %/d;第二阶段从第48~90天,氮素释放总量的17.00 %,平均氮素释放量为0.40 %/d。在30 ℃条件下,基本只有一个阶段,且释放速率较高,在50 d内就释放了氮素的80.00 %,平均释放率为1.82 %/d。可见,温度升高加速了树脂包膜尿素的释放速度,并使释放时间显著缩短,在20、25、30 ℃条件下释放80 %的总氮量所需天数分别为153、88、50 d。

图1 温度对树脂包膜尿素氮释放曲线的影响Fig.1 Effect of temperature on the nitrogen release of polymer coated-urea
2.1.2 硫包膜尿素 与树脂材料不同,硫包膜的刚性远高于树脂包膜,遇水不能膨胀。从图2可以看出,硫包膜尿素与释放时间之间的关系呈“r”形状,而不是“S”形。在20 ℃下,硫包膜尿素的初期养分释放率为48.00 %,7 d累积释放率为59.78 %,平均氮释放率为1.96 %/d。第二阶段从第8~74天,氮素累积释放率为20.20 %,平均氮释放率为0.30 %/d。升高温度并没有改变氮释放曲线的总体形状,但是缩短了释放时间[15]。20、25、30 ℃条件下达到80.00 %的累积释放率所需的时间分别为73、67、59 d。
由图1~2可以看出,2种包膜尿素的氮释放模式和速率存在着明显差别。硫包膜尿素的释放特征为:初始释放量高,之后呈线性释放。25 ℃下初始溶出率高达49.00 %,累积释放期为75 d。20 ℃下其释放曲线变化不明显,即温度对硫包膜尿素的养分释放影响较小。树脂包膜尿素释放曲线呈S形,其氮释放受温度的影响大于硫包膜尿素,温度的降低大大减缓了氮的释放。单从氮释放天数看,25 ℃下硫包膜尿素的释放期为75 d,树脂包膜尿素为85 d,两者仅相差10 d。然而二者在释放速率和模型的差异对氮素释放和作物生长的影响也较大。
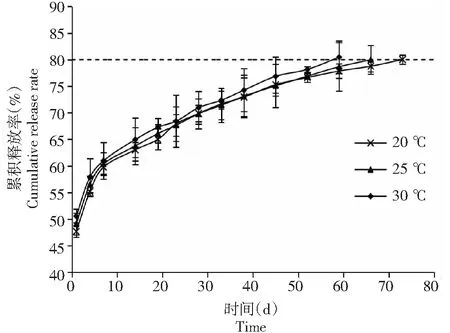
图2 温度对硫包膜尿素氮释放的影响Fig.2 Effect of temperature on the nitrogen release of sulfur coated-urea
2.1.3 介质与树脂包膜尿素 介质对包膜尿素的氮释放有着明显的影响。在田间,施入土壤的包膜尿素受到土壤水和微生物的影响,其环境明显不同于蒸馏水。因此,需要对介质的影响加以研究。由图3可以看出,温度相同,在最初的15 d内,水浸法与土培法所测得的氮素释放曲线十分相似。15 d以后,土培法测得的氮素释放率明显加速,并一直保持到培养的第23天。之后,氮素释放率随有所降低,但仍然高于水浸法。直至培养38 d后,土培法的氮素释放速率才有所降低,此时氮素释放率已达总量的65.00 %。与土培法相比,水浸法在前60 d的氮释放速度基本稳定,平均值在1.00 %/d,其后氮释放速度明显变缓,在30 d内,累积释放率达到总氮量的15.00 %,平均释放率为0.50 %/d。田间氮释放曲线与上述二者都不同。培养开始后,从第1~23天,氮素释放速率极低,平均只有0.13 %/d。从第24~53天,在29 d内,树脂包膜尿素释放了总氮量的77.00 %,平均释放量为2.66 %/d。由此可见,土壤会加速树脂包膜尿素的氮素释放速度,缩短其释放期。
2.1.4 介质与硫包膜尿素 由图4可知,与树脂包膜尿素不同,在培养的第1天就有大量的氮素释放出来。从水浸法的氮素释放来看,培养的第1天氮素累积释放率超过48.00 %。从培养的第2~7天,氮累积释放率从48.00 %增加到58.00 %,平均释放率为1.67 %/d。从培养的第8~66天,氮素累积释放率从58 %增加到80 %,平均释放率为0.38 %/d。25 ℃土培结果显示,第1天的氮释放速率为42.00 %,低于水浸法的48.00 %,高于田间原地培养的21 %。从第2~7天,氮素累计释放率增加59.00 %,平均释放率为2.80 %/d。从第8~44天,硫包膜尿素氮累积释放率从59.00 %增加到80.00 %,平均为0.58 %/d。土壤原地培养明显降低了第1天的氮素释放量(21.00 %)。从第2~17天,氮释放率从21.00 %增加到68.00 %,平均为3.10 %/d。从第18~33天,氮释放率从68.00 %增加到80.00 %,平均值为0.75 %/d。因此,土壤培养也加快了硫包膜尿素的氮释放速率。
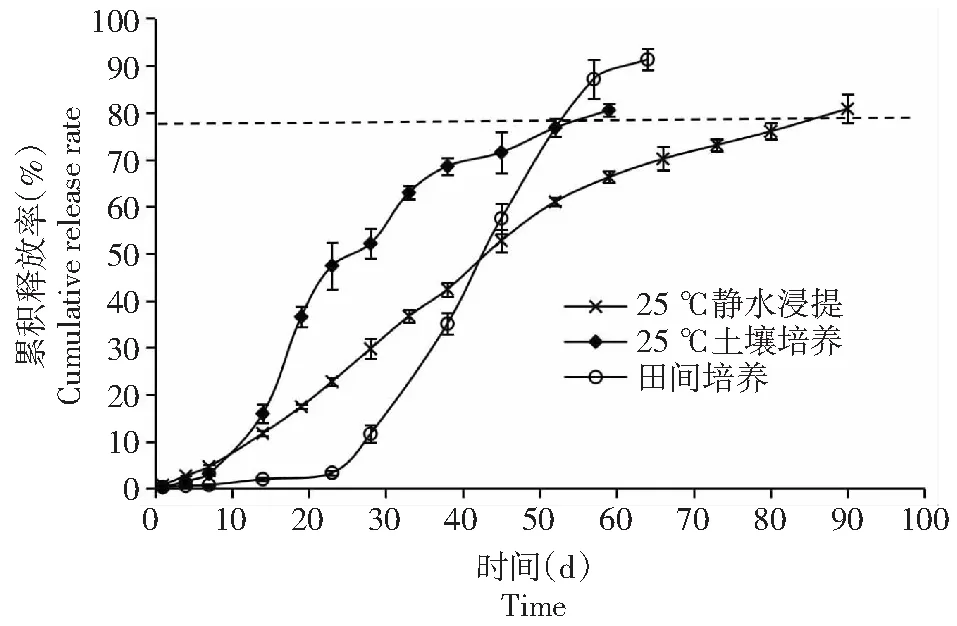
图3 培养介质对树脂包膜尿素氮释放曲线的影响Fig.3 Effect of media on the nitrogen release of polymer coated-urea
2.2 不同施氮处理对土壤无机氮含量的影响
土壤无机氮水平可以反映出植物生长过程中土壤养分供应的丰缺情况。硝态氮和铵态氮为土壤中无机氮的主要存在形式,由于铵态氮在旱地土壤中含量较低且差异较小,而硝态氮是旱田土壤氮素存在的主要方式,可用来计算土壤的有效氮[14]。因此将硝态氮含量及耕层无机氮含量变化作为研究的重点。
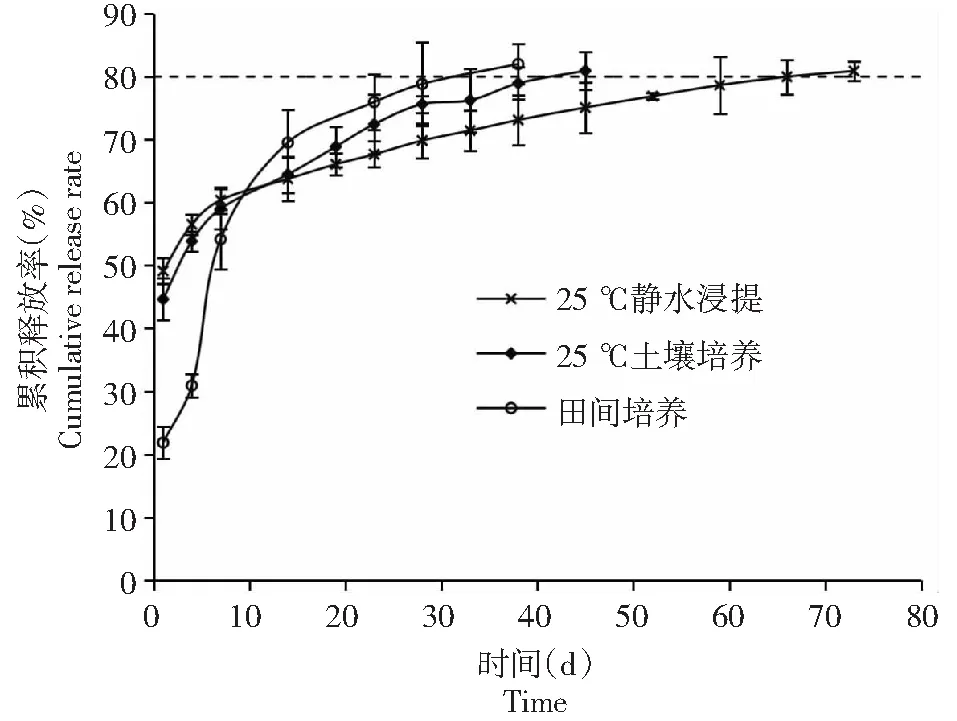
图4 不同介质中硫包膜肥料氮素释放曲线Fig.4 Cumulative release rate of nitrogen from SCU in different medium
土体内不同土层硝态氮浓度与氮肥处理和玉米生育时期有着密切关系(表2)。硝态氮的总变化趋势是,同一种氮肥处理,如果条件相同,高氮水平(188 kg·hm-2)的硝态氮含量高于低氮水平(94 kg·hm-2)的硝态氮含量;说明施氮量越大,土壤氮的残存量也越大;同一个处理、同一个玉米生育时期,0~30 cm土层的硝态氮含量高于31~60和61~100 cm 2个土层,但是31~60和61~100 cm 2个土层的规律性不强,其大小依玉米的生育时期而变。即在相同条件下拔节期 > 抽雄期 > 成熟期,也有个别处理存在成熟期 > 抽雄期的现象。
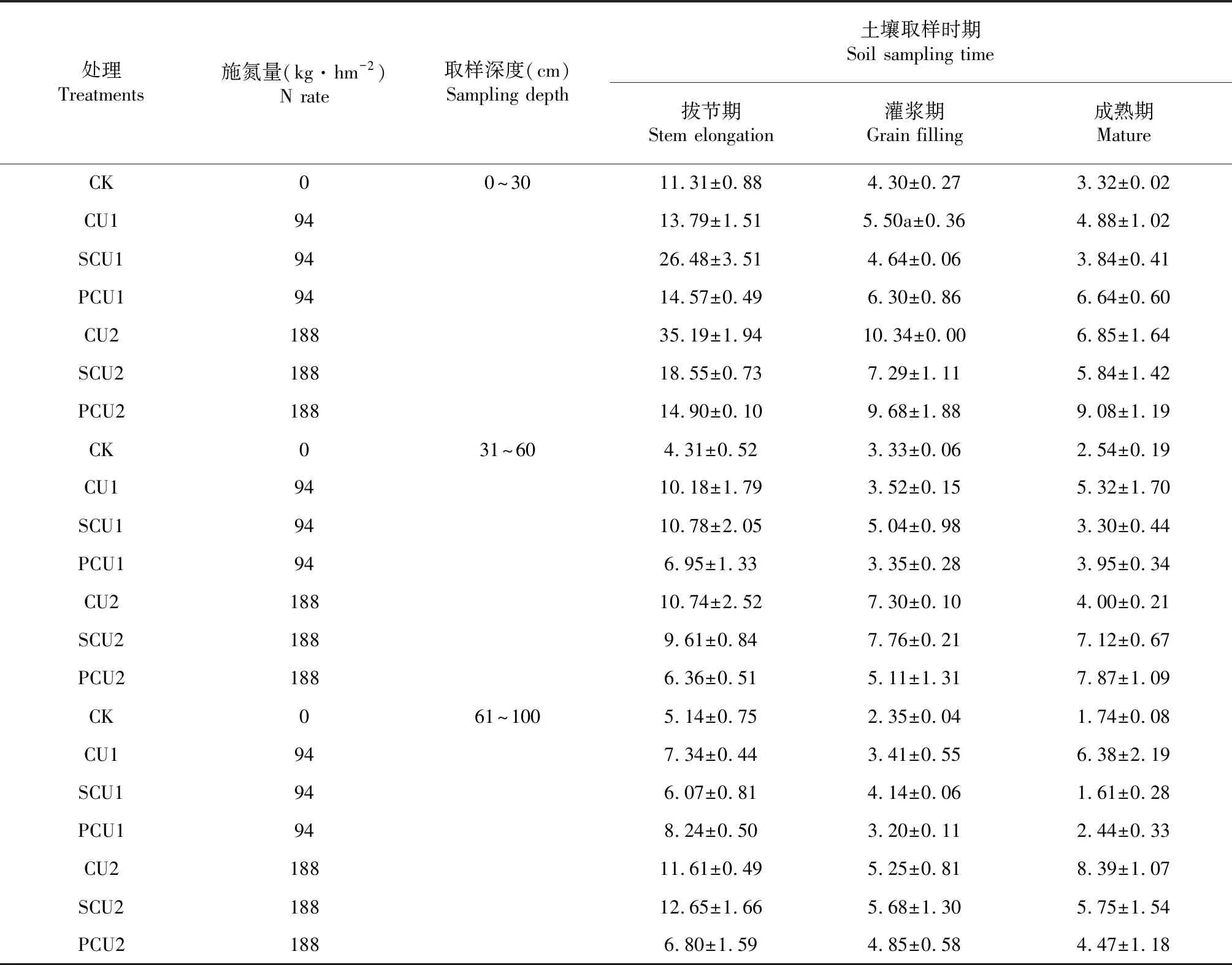
表2 不同氮肥处理0~100 cm土层硝态氮含量的变化
注:CU,普通尿素两次施肥,SCU,PCU硫包膜尿素,树脂包膜尿素一次施入。

图5 94 kg·hm-2施氮量下玉米不同生育时期不同施肥方式的土壤有效氮Fig.5 Relationship between soil available N and the growth stages of maize at low nitrogen rate (94 kg·hm-2)
由于随土层和玉米生育时期变化大[6],以硝态氮浓度为指标比较处理之间的氮素差异不甚清晰,而以玉米同一生育时期不同土层硝态氮含量为基础计算的土体有效氮总量能够较好地解决之一问题。玉米同一生育时期土体内的有效氮总量计算方法见公式(2)。
从图5可以看出,在玉米生育早期(拔节期),普通尿素CU1处理刚刚进行第2次追肥,追施的尿素尚没有分解形成硝态氮,CU1处理与PCU1(树脂包膜尿素)的土壤有效氮总量相似。硫包膜尿素一次施肥处理(SCU1)的土壤有效氮总量水平则明显高于其余处理。玉米需肥的中后期(灌浆期)已过最大需肥期,CU1,SCU1,PCU1 3个处理之间差异不明显。然而,在玉米生育后期(成熟期),CU1与PCU1 有效氮总量相似,SCU1的有效氮总量则出现了明显下降。由此可见,在低施氮量条件下,施用不同的包膜尿素,普通尿素底肥+追肥的方法与一次性施用树脂包膜尿素的氮释放特征相似,而与硫包膜尿素一次性施肥不同,后者有较为明显的后期脱肥现象。
在高施氮量(188 kg·hm-2)条件下,在玉米生育早期(拔节期),处理CU2与SCU有效氮总量较高,然而PCU2处理却较低 (图6)。此时玉米对氮素的需求尚没有达到最高,有效氮总量高会引起氮素的损失。在灌浆期,CU2与PCU2有效氮总量较高,但与SCU2相比没有达到极显著差异。到生育末期,PCU2处理的有效氮含量明显高于其余处理,说明对后期玉米生长供氮较为有利。
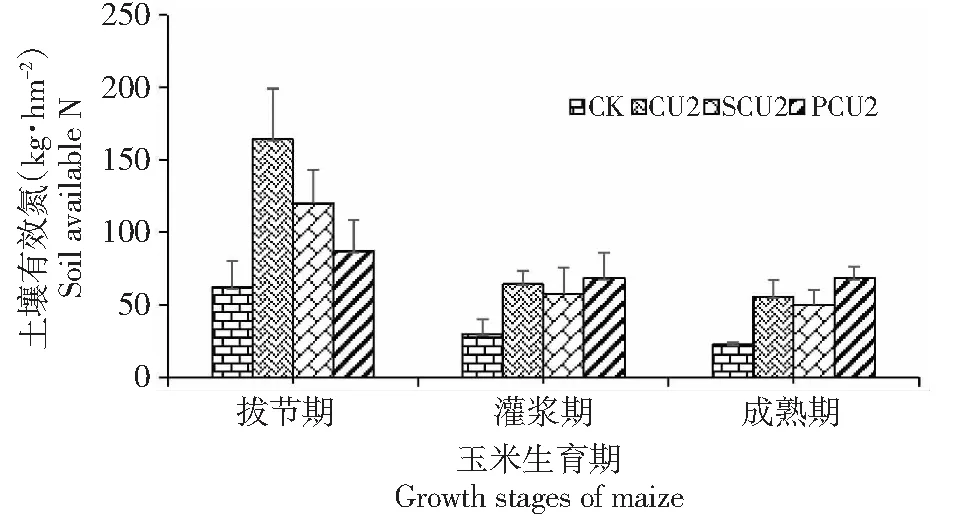
图6 188 kg·hm-2施氮量下玉米不同生育时期不同施肥方式的土壤有效氮Fig.6 Relationship between soil available N and the growth stages of maize at high nitrogen rate (188 kg·hm-2)
图7 156 kg·hm-2施氮量下玉米不同生育时期不同氮源的土壤有效氮Fig.7 Relationship between soil available N and the growth stages of maize at high nitrogen rate (156 kg·hm-2)
2014年度土壤有效氮随玉米发育时期的变化特点为,在拔节期,普通氮源氮素处理(DCU、CU2)有效氮总量较高,而包膜氮肥处于较低水平。此时玉米尚未达到吸收高峰期,适当控制土壤有效氮总量可降低氮素损失(图7)。在抽雄期,各个氮素处理的有效氮总量相差不多,但PCU处理略低于其它处理。在成熟期,处理CU2的有效氮总量最高,而其余氮素处理氮素总量显著低于CU2。
3 讨 论
酰胺态的尿素虽然可以以酰胺态被作物所吸收,但更多吸收形式是酰胺转化后的铵态氮和硝态氮。在环境因素的作用下,尿素在土壤内转化为铵态氮和硝态氮。氮素的3种形式以铵态氮最为稳定,其次为酰胺态;硝态氮稳定性最差,但却是旱田土壤中氮素的主要存在形式。控制不同阶段氮素的3种形式有利于减少氮素损失,增加作物的氮吸收[2-3,5-6]。
在本研究中,不同包膜尿素的氮释放特征差异较大。硫包膜尿素初期释放量大,持续时间短;后期氮释放速率明显降低,持续时间长,在一定程度上耦合了氮素释放与作物氮吸收[7]。树脂包膜尿素则不同,初级氮释放率很低,后加速至较高的水平,最后又降低到较低的氮释放水平。从哈尔滨地区的玉米氮需求来看,5月1日至6月20日为苗期,长达50 d,这一时期玉米的氮需求较少;拔节期为6月21至7月30日,为40 d,氮素需求增长显著;8月1-15日为开花期,氮素需求达到最高。8月16日-8月31日为灌浆期,9月1-20日为成熟期。可见,从氮供需耦合的角度看,树脂包膜尿素更接近玉米的氮素需求[9]。
氮素的释放特征与施氮量有关。在施氮量为94 kg·hm-2时,施用不同的包膜尿素,普通尿素基肥+追肥的方法与树脂包膜尿素基施处理的氮释放特征相似,而与硫包膜尿素基施不同,后者有较为明显的后期脱肥现象;在施氮量为188 kg·hm-2时,即在玉米生育早期(拔节期),树脂包膜尿素也能将土壤中的硝态氮水平保持在低水平,表现出较大的氮素释放缓释优势;在玉米生育的中后期,这种优势有扩大的趋势。到生育末期,树脂包膜尿素处理的有效氮含量明显高于其余处理,说明对后期玉米生长供氮较为有利。在施氮量为156 kg·hm-2时,硫包膜尿素基施、50 %树脂包膜尿素+50 %尿素处理均增加了玉米中期的氮素供应[11]。
除了用于一次性施肥外,包膜尿素也被用作玉米的追肥,以增加后期的氮素供给,通过增加玉米的籽粒重量达到增加产量、提高玉米籽粒品质的目的[3]。另外,在包膜材料中加入化学抑制剂(硝化抑制剂、脲酶抑制剂)还可以控制氮素不同形态在土壤中的相互转化,从而达到提高氮素利用率的目的[2]。
4 结 论
从本研究来看,PCU基施处理、50 % PCU+50 %普通尿素混合基施处理缓释效果与传统尿素基肥+追肥处理效果相当,可用于玉米一次性施肥,而SCU基施则不能。树脂包膜尿素性能优于硫包膜尿素,但在价格上树脂包膜高于硫包膜尿素,因此在推广上尚需要根据具体情况选择包膜尿素的品种和在氮肥中添加包膜尿素的数量。由于树脂包膜尿素的优异性能,以树脂包膜尿素代替尿素实现氮肥一次性施肥的施肥方法更为合理。

