雷公藤内酯醇对脂多糖刺激的人成骨肉瘤细胞MG-63血管生成和炎性反应的抑制作用
林淼雄,彭 明,杜国友,陈 燕,林惠玲
(中山市中医院:1.输血与检验科;2.外三科;3.急诊科,广东中山 528400)
骨肉瘤是20岁以下青少年或儿童常见的恶性骨肿瘤,是儿童最常见的恶性骨肿瘤,占儿童肿瘤的5%[1]。骨肉瘤最突出的症状是肿瘤部位疼痛,主要由肿瘤组织的侵蚀和骨皮质的溶解所致[2]。骨肉瘤在几个月内有向肺转移的倾向[3]。肿瘤切除,放、化疗是早期骨肉瘤患者的重要辅助治疗方法,晚期患者往往只能选择截肢。而截肢的5年生存率仅为5%~15%[4-5]。因此,迫切需要探索一种安全、有效的骨肉瘤治疗方法。恶性肿瘤的转移是一种复杂的生物学行为,血管生成是肿瘤生长转移的形态学基础。既往有研究表明,微血管密度与肿瘤转移、发生及患者预后密切相关,包括骨肉瘤[6]。肿瘤细胞可通过直接细胞接触或分泌旁分泌可溶性因子、诱导细胞修饰和细胞外基质改变肿瘤微环境[7],尤其是炎性反应,许多炎症介质可能影响细胞增殖和肿瘤的发展,其通过产生血管生成因子、生长因子、趋化因子、细胞因子和基质金属蛋白酶而促进肿瘤细胞的侵袭和逃避免疫系统的监控[8]。因此,分子靶向抑制炎性反应和血管增生是治疗骨肉瘤的潜在策略。
雷公藤内酯醇(TPL)是从雷公藤中提取的具有抗氧化、抗炎、抗癌等多种生物活性的二萜环氧化合物[9]。TPL在肺癌、结肠癌、骨肉瘤等多种癌症中均具有调控细胞凋亡、迁移和转移的作用[10-12]。此外,既往有研究表明,TPL是一种很有应用前景的抗血管生成药物[13]。但TPL是否可通过调控血管生成和炎性反应而发挥其在骨肉瘤中的抗癌作用,目前尚不清楚。本研究探讨了TPL对骨肉瘤细胞血管生成和炎性反应的影响及其可能的作用机制,现报道如下。
1 材料与方法
1.1药物与试剂 人成骨肉瘤细胞MG-63(中科院上海细胞库提供)、杜氏改良Eagle培养基(Life Technologies,Carlsbad,CA,USA)、胎牛血清(FBS,HyClone,GE Healthcare Life Science,Logan,USA)、TPL(Sigma,St Louis,MO,USA)、二甲基亚砜(DMSO,Sigma,St Louis,MO,USA)、p38抑制剂——SB203580(Medchem Express,Monmouth Junction,NJ,USA)、p38激动剂——P79350(Invitrogen,Carlsbad,CA,USA)、四甲基偶氮唑蓝比色法(MTT,Sigma,St Louis,MO,USA)、脂多糖(LPS,Sigma,St Louis,MO,USA)、人肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、低氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)酶联免疫吸附试验(ELISA)试剂盒(伊莱瑞特生物科技股份有限公司,武汉,中国)、TrIZOL(Life Technologies,Grand Island,NY,USA)、DNA反转录合成试剂盒(Takara Biotechnology,大连,中国)、SYBR q聚合酶链反应(PCR)Master Mix(Vazyme Biotech,南京,中国);p38MAPK抗体(Cell Signaling Technology,Danvers,MA,USA)、辣根过氧化物酶(HRP)、山羊抗兔二抗免疫球蛋白G(锐抗生物科技有限公司,北京,中国)等。
1.2方法
1.2.1人成骨肉瘤细胞MG-63培养 人成骨肉瘤细胞MG-63在含10% FBS的培养基,37 ℃、5%二氧化碳及饱和湿度的二氧化碳培养箱中培养,2 d更换1次培养基,3~4 d进行1次传代,选取状态良好的处于对数生长期的细胞用于实验。

1.2.3ELISA检测细胞培养上清液中TNF-α、IL-6、HIF-1α、VEGF水平 选取状态良好处于对数生长期的人成骨肉瘤细胞MG-63分别加入TPL(50、100、200 μg/mL)或TPL(200 μg/mL)+P79350(50 000 nM)预处理2 h,加入LPS(10 μg/mL)培养24 h,收集细胞培养上清液,离心去除细胞碎片,采用ELISA检测细胞培养上清液中TNF-α、IL-6、HIF-1α、VEGF水平,具体操作步骤参制造商(伊莱瑞特生物科技股份有限公司,武汉,中国)的操作说明书进行。
1.2.4定量PCR(Q-PCR)检测人成骨肉瘤细胞MG-63 TNF-α、IL-6、HIF-1α、VEGF表达水平 收集培养上清液后使用TrIZOL试剂从人成骨肉瘤细胞MG-63提取总RNA。使用带有互补DNA合成试剂盒将1 μg总RNA反转录成DNA。PCR循环参数:30 ℃ 10 min,42 ℃ 50 min,95 ℃ 5 min。以甘油醛-3-磷酸脱氧酶(GAPDH)为内参,使用SYBR qPCR Master Mix进行定量PCR检测,Q-PCR的实验结果采用2-ΔΔCq方法进行标准化和量化。引物序列:TNF-α正向引物5′-GAACTGGCAGAAGAGGCACT-3′,反向引物5′-GGTCTGGGCCATAGAACTGA-3′;IL-6正向引物5′-CCGGAGAGGAGACTTCACAG-3′,反向引物5′-CAGAATTGCCATTGCACA-3′;HIF-1α正向引物5′-TCTGGGTTGAAACTCAAGCAACTG-3′,反向引物5′-CAACCGGTTTAAGGACACATTCTG-3′;VEGF正向引物5′-TGCTTCTGAGTTGCCCAGGA-3′,反向引物5′-TGGTTTCAATGGTGTGAGGACATAG-3′;GAPDH正向引物5′-GGCATTGCTCTCAATGACAA-3′,反向引物5′-TGTGAGGGAGATGCTCAGTG-3′。
1.2.5Western-blot检测TPL对磷酸化p38蛋白(p-p38)表达的影响 使用RIPA裂解液从细胞中提取全细胞蛋白,BCA法蛋白定量,用10%十二烷基硫酸钠-聚丙稀酰胺电泳分离等量的细胞裂解液,转入聚偏二氟乙烯膜,在5%脱脂牛奶中封闭1 h后用一抗在4 ℃下孵育过夜,回收抗体,用PBST洗涤多次后在室温下用相应的二抗孵育1 h,最后采用ECL系统显示蛋白条带。导入GeneTool from Syngene软件分析蛋白条带灰度,以各组β-actin条带的灰度值作为对照,标化其相应组的p-p38蛋白表达量。
1.2.6免疫组织化学染色检测人骨肉瘤组织p-p38蛋白表达水平 对人骨肉瘤患者手术切除的病理组织标本进行脱水石蜡包埋切片,脱蜡水化,在10 mmol/L柠檬酸缓冲液(pH 6.0)中煮沸进行抗原提取。用3% H2O2溶液室温避光孵育10 min灭活内源性过氧化物酶,一抗在4 ℃下孵育过夜,用PBST洗涤多次后在室温下用相应的二抗孵育1 h,使用DAB底物试剂盒进行显色反应,用苏木素复染。
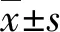
2 结 果
2.1LPS与TPL对人成骨肉瘤细胞MG-63的毒性检测 不同浓度LPS(10、20、50 μg/mL)作用24 h人成骨肉瘤细胞MG-63细胞活力与对照组比较,差异均无统计学意义(P>0.05),说明LPS(10、20、50 μg/mL)对人成骨肉瘤细胞MG-63不存在细胞毒性作用。见图1。故优选10 μg/mL LPS作用于人成骨肉瘤细胞MG-63,建立理想的体外肿瘤细胞致炎模型。不同浓度TPL(50、100、200μg/mL)作用24 h人成骨肉瘤细胞MG-63细胞活力与对照组比较,差异均无统计学意义(P>0.05)。见图2。表明在实验条件下,TPL(50~200μg/mL)与LPS(0~50 μg /mL)均对人成骨肉瘤细胞MG-63无明显细胞毒性作用,实验在该药物浓度范围内进行具有科学依据。

图1 不同浓度LPS对人成骨肉瘤细胞MG-63 细胞活力的影响
2.2TPL对HIF-1α、VEGF的抑制作用 不同浓度药物干预后人成骨肉瘤细胞MG-63 HIF-1α、VEGF表达量发生明显变化。见图3、4。LPS组HIF-1α、VEGF表达水平均明显高于对照组和DMSO组。LPS组细胞上清液中HIF-1α表达量[(205.47±26.10)μg/mL]均明显高于对照组[(53.85±7.36)μg/mL]和DMSO组[(49.52±8.33)μg/mL]。见图5。LPS组细胞上清液中VEGF表达量[(256.06±38.52)μg/mL]均明显高于对照组[(60.22±8.29)μg/mL]和DMSO组[(64.70±9.33)μg/mL]。见图6。与LPS比较,不同浓度TPL(50、100、200 μg/mL)预处理2 h细胞上清液中HIF-1α、VEGF表达量呈浓度依赖性降低。当TPL浓度达到50 μg/mL时人成骨肉瘤细胞MG-63培养上清液中HIF-1α、VEGF表达量与LPS单独刺激组比较,差异均有统计学意义(P<0.05)。当TPL上升至100 μg/mL时差异继续增大,并随TPL浓度的增加,差异趋向平稳。见图3、4。TPL预处理后人成骨肉瘤细胞MG-63培养上清液中HIF-1α分泌量分别为(145.28±18.36)、(88.10±11.36)、(64.06±7.14)μg/mL,VEGF分泌量分别为(152.36±20.42)、(116.74±16.58)、(72.35±8.63)μg/mL,与LPS组比较,不同浓度TPL(50、100、200 μg/mL)预处理细胞上清液中HIF-1α分泌量分别降低29%、57%、68%。VEGF分泌量分别降低40%、54%、71%。见图5、6。TPL可有效抑制LPS诱导的人成骨肉瘤细胞MG-63培养上清液中HIF-1α、VEGF的表达。

图2 不同浓度TPL对人成骨肉瘤细胞MG-63 细胞活力的影响

注:与LPS组比较,*P<0.05
图3不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中HIF-1αmRNA表达的影响
2.3TPL对炎性细胞因子——TNF-α、IL-6抑制作用 不同浓度药物干预后人成骨肉瘤细胞MG-63培养上清液中炎性细胞因子——TNF-α、IL-6表达量发生明显变化。LPS组TNF-α、IL-6表达量明显高于对照组和DMSO组。LPS组细胞上清液中TNF-α表达水平[(228.16±36.77)μg/mL]明显高于对照组[(53.41±6.14)μg/mL]和DMSO组[(58.37±10.19)μg/mL]。见图7。LPS组细胞上清液中IL-6表达量[(177.85±30.77)μg/mL]明显高于对照组[(40.41±3.14)μg/mL]和DMSO组[(38.75±6.19)μg/mL]。见图8。与LPS比较,不同浓度TPL(50、100、200 μg/mL)预处理2 h细胞上清液中TNF-α、IL-6表达量呈浓度依赖性降低。当TPL浓度达到50 μg/mL时人成骨肉瘤细胞MG-63炎性细胞因子表达水平与LPS单独刺激组比较,差异有统计学意义(P<0.05)。当TPL浓度逐渐上升到100、200 μg/mL时差异继续增大。见图7、8。TPL预处理后人成骨肉瘤细胞MG-63培养上清液中TNF-α分泌量分别为(171.38±24.12)、(115.88±21.30)、(86.57±17.24)μg/mL,IL-6分泌量分别为(103.38±18.60)、(68.84±11.30)、(54.57±8.11)μg/mL,与LPS组比较,不同浓度TPL(50、100、200 μg/mL)预处理后人成骨肉瘤细胞MG-63培养上清液中TNF-α分泌量分别降低25%、49%、62%。IL-6分泌量分别降低41%、61%、69%。见图9、10。TPL能显著抑制LPS诱导的人成骨肉瘤细胞MG-63培养上清液中炎性细胞因子——TNF-α、IL-6的表达。

注:与LPS组比较,*P<0.05
图4不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中VEGFmRNA表达的影响

注:与LPS组比较,*P<0.05
图5不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中HIF-1α分泌量的影响

注:与LPS组比较,*P<0.05
图6不同药物浓度对人成骨肉瘤细胞MG-63上清液中VEGF分泌量的影响

注:与LPS组比较,*P<0.05
图7不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中TNF-αmRNA表达的影响

注:与LPS组比较,*P<0.05
图8不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中IL-6mRNA表达的影响
2.4TPL通过抑制p38MAPK信号通路发挥作用 各组人成骨肉瘤细胞MG-63培养上清液中p-p38蛋白表达比较,差异有统计学意义(F=94.479,P=0.001)。LPS组与对照组比较,表达量明显增加。与LPS组比较,SB203580组及TPL各浓度组预处理2 h人成骨肉瘤细胞MG-63培养上清液中p-p38蛋白表达量明显降低,并呈浓度依赖性,表明TPL能明显降低LPS的作用。TPL(200 μg/mL)组与SB203580组比较,差异无统计学意义(q=0.259,P=0.857),TPL可有效抑制p-p38蛋白的表达。见表1。此外,与健康组织比较,人骨肉瘤组织p-p38蛋白表达量明显增加。见图11。与LPS组比较,TPL、P79350预处理组人成骨肉瘤细胞MG-63培养上清液中HIF-1α、VEGF、TNF-α、IL-6表达水平均未见明显降低。图3~10。TPL通过抑制p38MAPK信号通路抑制LPS刺激介导的人成骨肉瘤细胞MG-63血管生成和炎性反应。

注:与LPS组比较,*P<0.05
图9不同药物浓度对人成骨肉瘤细胞MG-63培养上清液中TNF-α分泌量的影响

注:与LPS组比较,*P<0.05
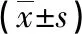
图10 不同药物浓度对人成骨肉瘤细胞MG-63 培养上清液中IL-6分泌量的影响
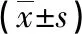
续表1 Western blot检测TPL对人成骨肉瘤细胞MG-63 p-p38蛋白的影响
注:与对照组比较,*P<0.05;与LPS组(10 μg/mL)比较,#P<0.05

注:与正常组织比较,*P<0.05
图11正常组织与人成骨肉瘤组织p-p38蛋白表达情况比较(×400)
3 讨 论
3.1TPL对LPS诱导细胞MG-63血管生成的影响 肿瘤组织生长的微环境与肿瘤细胞的增殖和侵袭、转移能力密切相关[14]。肿瘤组织周围的生长因子、炎性细胞因子和蛋白水解系统的紊乱是微血管形成和肿瘤转移相关的内在因素[15]。手术切除后的肿瘤转移是骨肉瘤患者疗效和预后欠佳的主要原因,因此,研究肿瘤组织的炎性反应和血管增生是治疗骨肉瘤的潜在靶点和策略[16]。VEGF是内皮细胞特异性最高、促生长效果最强的关键调控因子[17]。大部分侵袭性强的肿瘤VEGF的表达量一般均很高。大量的临床前和临床研究数据表明,VEGF靶向制剂在卵巢癌、乳腺癌、非小细胞肺癌等动物移植模型中具有明显的治疗作用[18]。有研究表明,TPL可调控细胞增殖、凋亡、淋巴瘤和甲状腺癌的侵袭、迁移和血管生成[19]。但TPL在骨肉瘤中的抗血管生成作用尚未见相关文献报道。本研究结果显示,TPL可有效抑制VEGF的表达,且抑制效果随剂量增加而增强。此外,VEGF表观遗传学研究证实,大部分肿瘤存在HIF-1α高表达。既往有研究表明,HIF-1α在红细胞生成、血管生成、细胞存活和肿瘤转移中发挥着重要的调控作用[20]。因此,将HIF-1抑制剂用于靶向治疗癌症是新的治疗策略。本研究通过TPL剂量依赖性抑制了MG-63细胞培养上清液中HIF-1α的表达水平。因此,推测TPL可通过抑制MG-63细胞培养上清液中HIF-1α、VEGF的表达而抑制血管生成,抑制骨肉瘤的生长和转移。
3.2TPL对LPS诱导MG-63细胞炎性反应的影响 肿瘤细胞可通过直接细胞接触或分泌旁分泌可溶性因子、诱导细胞修饰和细胞外基质改变肿瘤微环境[7],尤其是炎性反应,许多炎症介质可能影响细胞增殖和肿瘤的发展。TNF-α参与了免疫系统的维护和体内平衡,炎症和宿主防御。癌症细胞或基质细胞产生TNF-α参与了一系列肿瘤的发生与发展。其可激活核因子κB(NF-κB)信号通路,导致肿瘤细胞活化和细胞因子网络失衡。通过NF-κB,TNF-α还可介导肿瘤细胞和巨噬细胞相互作用,增加恶性肿瘤细胞的侵袭性[21]。肿瘤患者血清TNF-α水平往往是升高的,肿瘤或基质细胞产生的TNF-α使肿瘤长期处于慢性炎症的微环境[22];可能会直接导致DNA损伤,抗肿瘤细胞凋亡或促肿瘤细胞有丝分裂,调节肿瘤与基质细胞相互作用,诱发一系列基质金属蛋白酶、细胞因子、趋化因子而促进肿瘤发展。TNF-α的另一作用是促进IL-6的合成与释放,尤其是单核细胞和巨噬细胞[23]。IL-6是一种糖蛋白和多功能细胞因子,除作为促炎性细胞因子外,其还会影响癌细胞的多种活性。随着IL-6在协调先天免疫和适应性免疫方面的生理功能逐渐得到认识,IL-6已成为维持慢性炎症和自身免疫的关键介质,且越来越多的研究证实,其是连接慢性炎症和癌症发展的关键细胞因子。与TNF-α一样,IL-6可激活IL-6R/ Janus激酶/STAT3信号通路,上调Oct4基因的表达,促进非癌细胞在低附着培养条件下转化为肿瘤干细胞,从而促进肿瘤的发展[24]。晚期癌症患者IL-6水平升高,而人血清中IL-6水平升高与癌症风险增加有关。因此,IL-6被认为可作为预测癌症患者预后的标志物[25]。本研究结果显示,TPL可剂量依赖性抑制MG-63细胞培养上清液TNF-α、IL-6的表达。因此,推测TPL可通过抑制MG-63细胞炎性反应而抑制肿瘤细胞血管生成和生长。
3.3TPL对p38MAPK信号通路的影响 丝裂原活化蛋白激酶(MAPK)信号通路是多种信号通路的中心,是细胞接收、转换与传递信号一类非常重要的分子,在细胞功能活动中具有关键作用,如细胞增殖、分化、凋亡和应对外界环境的刺激[26]。越来越多的证据表明,MAPK是调节肿瘤细胞增殖和生长信号通路的关键因子[27];激活p38MAPK能促进细胞凋亡和自噬的发生[28]。同时,p38MAPK信号传导级联反应可受活性氧的调控,并参与了调控肿瘤血管的生成[29-30]。此外,p38MAPK信号通路还介导了心肌炎、肝炎等炎性反应[31- 32],因而成为开发抗炎药物的靶点。本研究结果显示,经TPL处理后p-p38蛋白的表达量较LPS组下降,提示TPL抗LPS诱导的促血管生成和炎性反应可能与下调p38MAPK信号通路的活性有关,表明p38MAPK可能是TPL作用的靶点。
4 结 论
TPL通过抑制p38MAPK信号通路转导能有效抑制骨肉瘤细胞的血管生成和炎性反应,为骨肉瘤提供了新的治疗靶点,并为骨肉瘤的治疗提供了研究基础。

