新生儿呼吸道感染产超广谱β-内酰胺酶菌的菌群分布及耐药性分析
贺 潇,申 燕,钟 文,谢 茜,李秋红△
(重庆市妇幼保健院:1.检验科;2.新生儿科,重庆 400013)
超广谱β-内酰胺酶(ESBLs)主要由肠杆菌科细菌产生[1],由质粒介导,从广谱β-内酰胺酶突变而来,是能赋予细菌对多种β-内酰胺类抗生素和单酰环类抗生素耐药的一类酶[2];可水解头孢菌素及单酰胺类抗菌药物,特别表现在对头孢噻肟、头孢他啶和利氨曲南的耐药[3-4];并可引起对氨基糖苷类等抗菌药物的多重耐药。随着近年来抗菌药物的大量使用,ESBLs所致耐药问题已成为临床抗肠杆菌科细菌感染治疗成败的重难点。而对新生儿而言,其呼吸道免疫系统尚不健全,肠道微生态仍待建立,而具有肾毒性和耳毒性的氨基糖苷类、对有关节软骨损害的氟喹诺酮类、易致溶贫和核黄疸的磺胺类和呋喃类及可致灰婴综合征的氯霉素[5]等均应避免使用或慎用,故不合理的抗菌药物应用会带来比年长儿更大的危害。意味着在新生儿呼吸道感染时选择合理的抗菌药物方案是治疗的关键。目前,关于呼吸道感染产ESBLs菌的耐药性研究多涉及成人,而有关新生儿方面的文献报道较少,不利于新生儿科抗菌药物的合理使用。因此,本研究对本院分离自新生儿呼吸道的产ESBLs细菌进行了菌群分布及耐药性分析,从而为临床提供相关的用药依据以制定有效的治疗方案。
1 资料与方法
1.1一般资料 收集2013年1月至2018年9月分离自本院新生儿科患儿呼吸道的ESBLs阳性菌132株。去除同一患者重复菌株(选取入院后第1次培养阳性菌株),同时去除28 d以上患儿培养的菌株(包括28 d)。其中产ESBLs肺炎克雷伯菌96株,产ESBLs大肠埃希菌36株。同时以2013年至2018年9月分离自本院新生儿科患儿呼吸道的不产ESBLs肺炎克雷伯菌和大肠埃希菌195株作为对照组,其中不产ESBLs肺炎克雷伯菌103株,不产ESBLs大肠埃希菌92株。
1.2仪器与试剂 仪器为美国BD公司Phoenix 100全自动鉴定药敏仪、生物安全柜、恒温二氧化碳培养箱等。试剂为标准质控菌株大肠埃希菌(ATCC25922)和肺炎克雷伯菌(ATCC700603)、血琼脂平板、麦康凯琼脂平板等。
1.3方法
1.3.1标本来源及采集方法 上呼吸道感染患儿于喂奶前采用咽拭子刮取咽后壁分泌物,置于无菌试管中;下呼吸道感染患儿喂奶前采用无菌吸痰管自鼻腔深入咽喉部吸取痰液。送检标本于低倍显微镜下至少观察10个视野计数,评价分泌物或痰液是否合格(白细胞大于25个、鳞状上皮细胞小于25个、细菌种类小于或等于3种)。
1.3.2菌株鉴定 标本接种、分离培养与鉴定严格按《全国临床检验操作规程(第4版)》[6]进行。将标本接种于血琼脂平板和麦康凯琼脂平板,35 ℃、5%二氧化碳孵箱中培养20~24 h后以大肠埃希菌(ATCC25922)和肺炎克雷伯菌(ATCC700603)作为质控菌株,采用美国BD公司生产Phoenix 100全自动鉴定药敏仪进行菌株鉴定和药敏分析。
1.3.3药敏试验 从平板上挑取数个单菌落接种于Phoenix 100全自动鉴定药敏仪专用的鉴定管中,调菌液浓度至0.5麦氏浊度后取25 μL于Phoenix 100专用药敏管,置Phoenix 100全自动鉴定药敏仪中孵育20~24 h后读取鉴定结果及药敏试验结果。
1.4统计学处理 采用SAS9.0统计软件对数据进行分析,计数资料以率(%)表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1新生儿呼吸道ESBLs阳性菌的菌群分布及ESBLs检出率 新生儿呼吸道感染产ESBLs菌中肺炎克雷伯菌占72.73%,大肠埃希菌占27.27%,二者的ESBLs检出率分别为48.24%和28.12%。见表1。
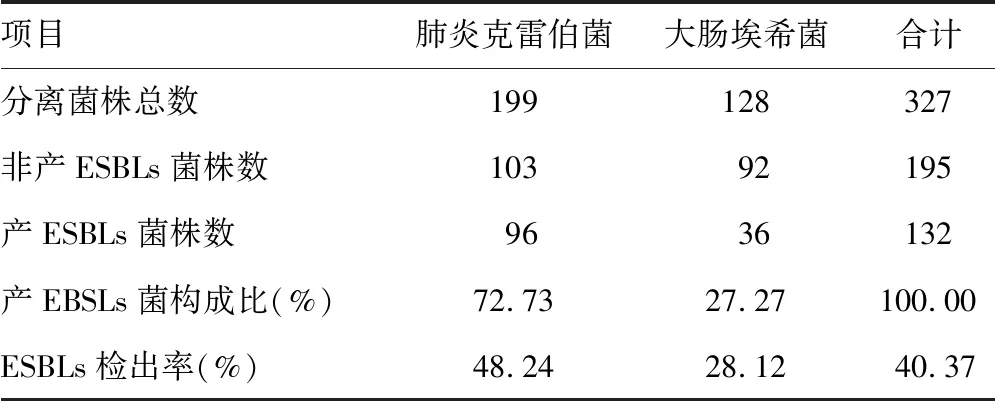
表1 新生儿呼吸道中产ESBLs菌的检出率
2.2新生儿呼吸道产ESBLs菌常用药物敏感试验结果 在体外药敏试验中分离自新生儿呼吸道的产ESBLs肺炎克雷伯菌对阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢他啶和哌拉西林的耐药率明显高于产ESBLs大肠埃希菌,而产ESBLs大肠埃希菌对环丙沙星、左旋氧氟沙星和庆大霉素的耐药率明显高于产ESBLs肺炎克雷伯菌,差异均有统计学意义(P<0.05)。见表2。
2.3新生儿呼吸道产ESBLs菌和相应非产ESBLs菌耐药率比较 新生儿呼吸道产ESBLs菌株耐药性明显高于相应非产ESBLs菌株。见表3。
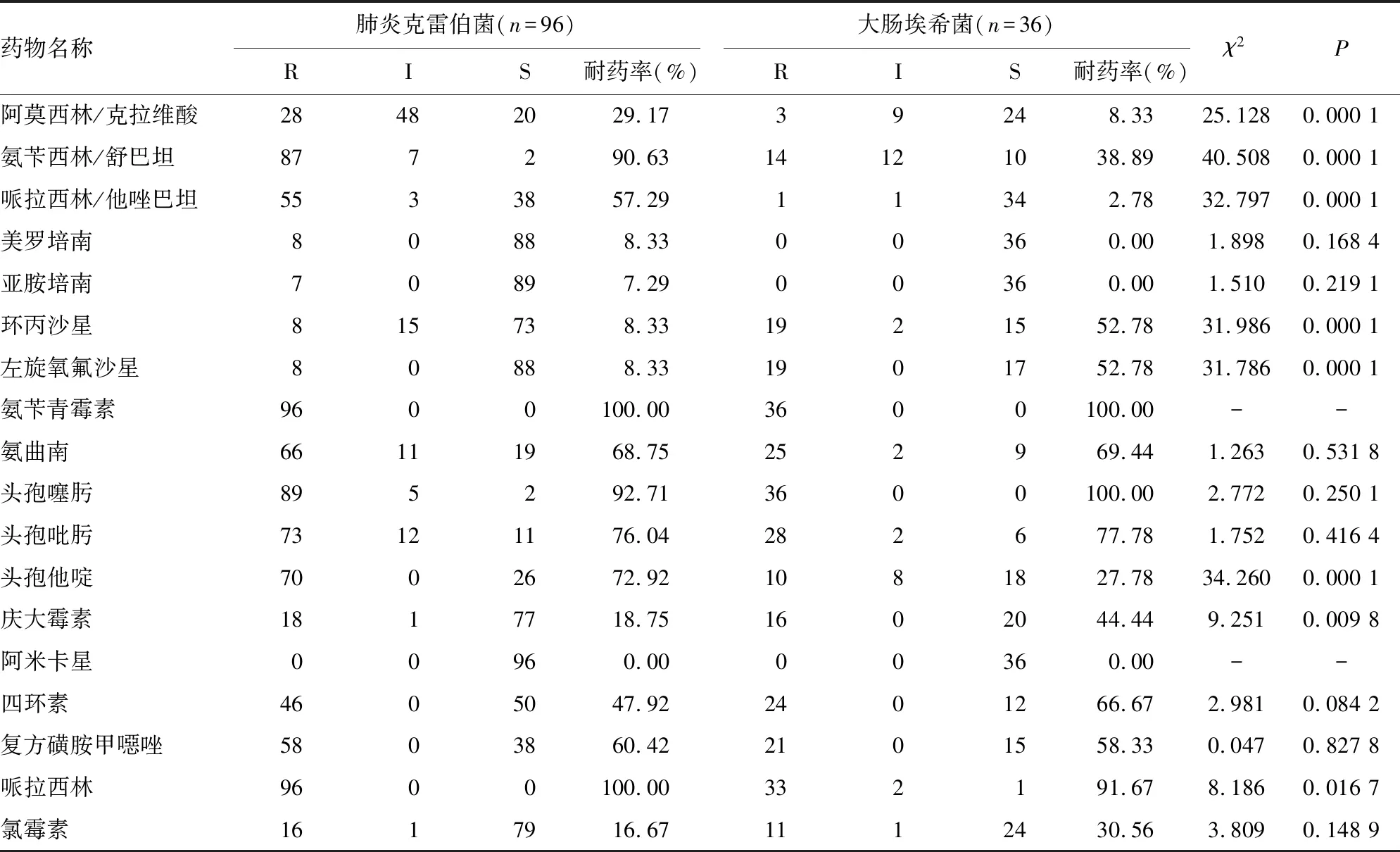
表2 新生儿呼吸道产ESBLs菌药敏试验结果及耐药率比较
注:R表示耐药,I表示中介,S表示敏感,-表示无数据
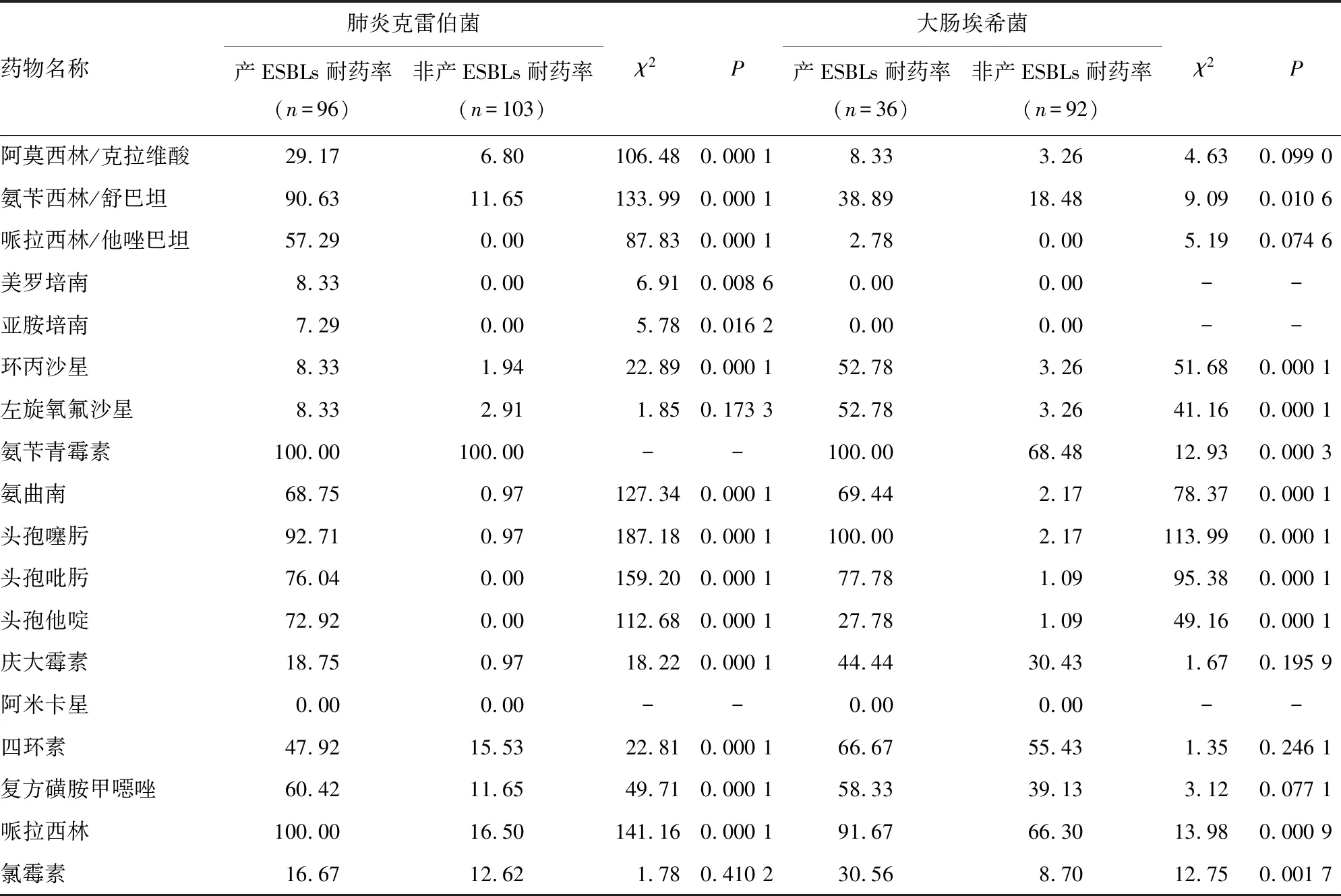
表3 新生儿呼吸道产ESBLs菌和相应非产ESBLs菌的耐药率比较(%)
注:-表示无数据
2.4新生儿呼吸道产ESBLs菌的肺炎克雷伯菌与大肠埃希菌多重耐药率比较 新生儿呼吸道产ESBLs肺炎克雷伯菌和大肠埃希菌的多重耐药率分别为97.92%和88.89%。见表4。
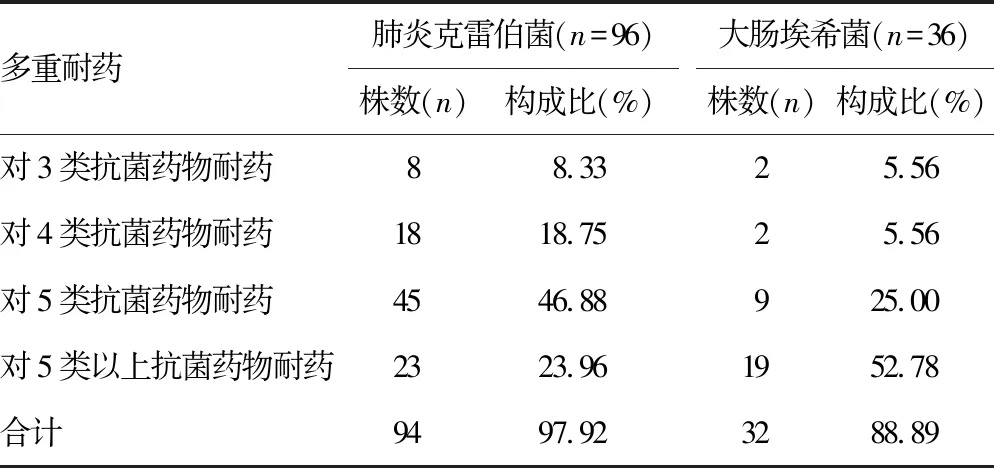
表4 新生儿呼吸道产ESBLs菌的肺炎克雷伯菌与大肠 埃希菌多重耐药率比较
3 讨 论
近年来,随着抗菌药物特别是第3代头孢菌素的大量使用,革兰阴性菌对这些药物的耐药率呈逐年增高趋势,其原因之一就是ESBLs的产生[7];其介导的耐药问题已成为当前全球最重要的医院耐药问题之一。
2003年RUPP等[8]曾报道,全球有10.00%~40.00%的大肠埃希菌和肺炎克雷伯菌表达ESBLs。近年来,赵小芳等[9]报道部分地区儿童呼吸道产ESBLs阳性率高达54.36%。本研究结果显示,新生儿呼吸道产ESBLs菌总检出率为40.37%,而肺炎克雷伯菌和大肠埃希菌的ESBLs阳性检出率分别为48.24%和28.12%,与国内HU等[10]报道的成人肺炎克雷伯菌和大肠埃希菌的ESBLs阳性检出率分别为25.20%和45.20%比较,具有一定差异。但与新生儿及儿童呼吸道感染的肺炎克雷伯菌和大肠埃希菌的ESBLs阳性检出率分别为40.91%[11]和31.40%[12]较为一致,故分析新生儿呼吸道感染的ESBLs检出率与成人比较,具有一定差异,其相应的耐药性也有所不同。
本研究进行的体外药敏试验结果显示,产ESBLs菌对碳青霉烯类亚胺培南和氨基糖苷类中的阿米卡星敏感性较好,但因新生儿用药的特殊性,针对此类细菌导致的新生儿感染,临床用药常选用碳青霉烯类和含ESBLs抑制剂的复合抗菌药物。但有研究表明,临床常用的β-内酰胺类抗菌药物——头孢西丁和碳青霉烯抗菌药物——亚胺培南是强有力的头孢菌素酶(AmpC酶)诱导剂[13],而AmpC酶不被β-内酰胺酶抑制剂——克拉维酸所抑制。近年来,有研究表明,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.00%和2.90%上升至2017年的20.90%和24.00%[14],故虽然亚胺培南为治疗产ESBLs菌感染的首选药物,但应用亚胺培南时应更加慎重。
针对新生儿呼吸道产ESBLs菌感染,添加β-内酰胺酶抑制剂将更加安全、有效。而本研究进行体外药敏试验结果显示,对产ESBLs肺炎克雷伯菌,阿莫西林/克拉维酸的耐药率低于哌拉西林/他唑巴坦和氨苄西林/舒巴坦;而对产ESBLs大肠埃希菌,哌拉西林/他唑巴坦的耐药率低于阿莫西林/克拉维酸和氨苄西林/舒巴坦。为临床应用β-内酰胺酶抑制剂提供了理论依据。
ESBLs的产生与我国目前抗菌药物的大量使用具有一定关系。在新生儿呼吸道感染时可能较成人更广泛地使用了头孢菌素类药物,可能导致新生儿呼吸道产ESBLs菌多重耐药率较高。本研究结果显示,新生儿呼吸道产ESBLs肺炎克雷伯菌和产ESBLs大肠埃希菌多重耐药率分别为97.92%和88.89%,略高于以往文献报道的成人呼吸道产ESBLs菌多重耐药率为74.63%[15]。这对新生儿呼吸道感染的临床用药提出了警示,更加合理地运用抗菌药物至关重要。虽然添加β-内酰胺酶抑制剂可提高抗菌药物的疗效,但本研究体外药敏试验结果显示,添加β-内酰胺酶抑制剂仍具有一定的耐药率。故寻找能控制产ESBLs菌的感染和蔓延、保护有限的对产ESBLs菌敏感的抗菌药物是眼下治疗患者,特别是新生儿产ESBLs菌感染的当务之急。
4 结 论
2013年至2018年9月,新生儿呼吸道感染中产ESBLs菌检出率较高,且新生儿呼吸道产ESBLs菌多重耐药率高于成人。体外抗菌试验结果显示,对导致新生儿呼吸道感染的产ESBLs菌不同含β-内酰胺酶抑制剂的复合β-内酰胺类抗菌药物其耐药率有差别,将对指导临床合理用药具有积极的意义。作者拟下一步从分析ESBLs的基因型出发,在指导临床用药、预防和控制产ESBLs菌医院内感染的同时寻找可用于新生儿呼吸道产ESBLs菌感染的药物及其抗菌机制。

