大豆异黄酮与肠道微生物相互作用研究进展
梁文欧,赵力超,方 祥,王 丽*
(华南农业大学食品学院,广东 广州 510642)
大豆异黄酮是大豆或苜蓿等植物产生的黄酮类次级代谢产物,在大豆及其制品豆浆、豆腐、豆芽等食物中广泛存在[1-2]。膳食摄入大豆异黄酮与人体健康有密切的关系[3]。世界卫生组织对全世界25 个国家的61 个群体进行的“心血管疾病和食物关联比较研究(CARDOIAC)1985ü2005”发现,尿液代谢物中异黄酮含量大于20 μmol/d的人群与异黄酮含量小于1 μmol/d的人群相比,前者患与冠状动脉疾病、前列腺癌以及乳腺癌有关疾病的死亡率更低[4]。其次,大豆异黄酮作为一种典型的植物雌激素,具有弱雌激素活性,在不同个体雌激素水平下可发挥类雌激素或抗雌激素双向调节功能,并在荷尔蒙依赖相关的代谢中发挥重要作用,亦有抗氧化、抗肿瘤、抗成骨细胞凋亡作用等功能[5-7]。尽管大豆异黄酮对人体健康有益,但是其有效组分主要是以结合态的糖苷形式存在,生物可利用度(小于5%)极低,制约了大豆异黄酮的充分利用。研究发现,大豆异黄酮糖苷组分与结肠菌群相互作用可产生生物活性和生物可利用度显著提高的新型微生物转化物,促进大豆异黄酮生理活性的充分发挥[8]。因此,本文将对大豆异黄酮与复杂的肠道菌群系统相互作用进行综述,以期为功能食品组分与肠道菌群互作影响健康作用的研究提供参考。
1 肠道菌群生物转化提高了大豆异黄酮的生物活性和生物可利用度
目前对膳食中的大豆异黄酮被摄入体内后如何被代谢、代谢后生成哪些代谢产物以及代谢产物活性如何了解较少。事实上,大豆异黄酮中只有结构简单的苷元能被小肠直接吸收,其组分只占大豆异黄酮的5%~10%,剩下90%以上异黄酮组分是以糖苷形式存在[9]。结合态糖苷多以共价作用与细胞壁结构成分结合,如羟基苯甲酸通过苯环上的羟基与木质素连接成键,或者通过羧基与糖类和蛋白形成酯。结合态糖苷能够抵抗胃和小肠的消化作用到达结肠,继而被肠道微生物代谢[10]。肠道微生物对大豆异黄酮的影响主要包括两个方面:1)食物中的大豆异黄酮结合态糖苷在肠道微生物的作用下能够游离出来;2)结肠中大豆异黄酮能在肠道微生物分泌的酶作用下进行代谢。如图1所示,结合型糖苷首先在小肠中进行去糖基化,依靠β-葡萄糖苷酶去除糖苷键得到游离苷元,此后会有两种代谢途径,第一条途径是游离苷元进入结肠,由结肠菌代谢游离苷元,最后通过粪便排出;第二条途径是游离苷元经肠内循环和肠肝循环,最终以尿液的形式排出代谢物;或者产物在小肠处重新解聚成游离苷元进入结肠,最终以粪便形式排出。从大豆异黄酮在体内的代谢途径分析,肠道微生物对大豆异黄酮的生物转化主要集中在将结合态糖苷游离出来和结肠菌群代谢作用。
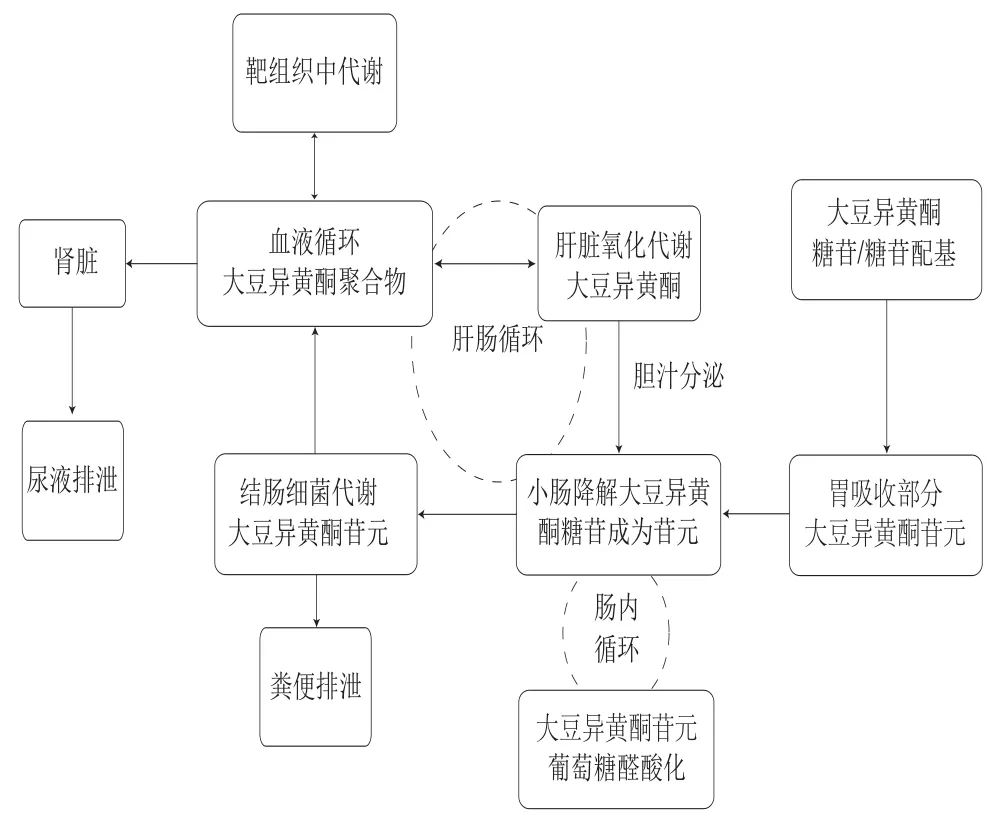
图1 大豆异黄酮代谢示意图[11]Fig.1 Schematic representation of soy isof l avone metabolism[11]
1.1 肠道微生物对大豆异黄酮结合态糖苷的游离作用
大豆异黄酮按形态分为游离型苷元和结合型糖苷两类,数量有12 种[12]。游离型苷元主要包括黄豆苷元、染料木黄酮和大豆黄素;结合型糖苷由3 种游离苷元分别与葡萄糖、丙二酰基葡萄糖、乙酰基葡萄糖以β-糖苷键连接而成[11],结合型糖苷是人们日常食用的大豆及其制品中大豆异黄酮的主要存在形式。
肠道微生物对结合型苷元的释放主要借助于其所分泌的酶作用而实现。肠道菌群为大豆异黄酮生物转化过程提供宿主不具备的酶。β-葡萄糖苷酶是研究最多的一种水解酶,可将外源糖苷转化为相应的苷元和葡萄糖。肠道中的拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)细菌,如肠球菌(Enterococcus)、乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、梭状芽孢杆菌(Clostridium)等都含有编码丰富的糖苷水解酶基因,可代谢多种糖苷成分[13]。β-葡萄糖苷酶水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[14],最终使结合型糖苷发生解离而释放成为游离苷元。研究发现,β-葡萄糖苷酶对底物的糖基部分结构的专一性较差,水解CüO糖苷键、CüS键、CüN键等[15],这给β-葡萄糖苷酶水解不同形式的大豆异黄酮提供可能。Day等[16]使用人类小肠和无肝细胞提取物证明L-葡萄糖苷酶能去除异黄酮上的糖基。另外,Hawksworth等[17]研究发现,直肠内的细菌,如Lactobacillus spp.、Bifidobacterium spp.等都拥有β-葡萄糖苷酶的活性,并且β-葡萄糖苷酶参与糖酵解途径,是Bif i dobacterium参与糖代谢的有关酶系之一。
1.2 肠道微生物对大豆异黄酮的代谢降解
膳食中的结合型糖苷被肠道微生物游离后或直接进入结肠的游离苷元在肠道微生物作用下进一步被代谢降解。肠道微生物介导的大豆异黄酮代谢降解主要包括还原、开环、去酮基等反应(表1)。结合图2的游离苷元经肠道微生物介导的代谢降解过程[18],还原反应是游离苷元C环的2、3位间双键加氢变成单键;开环反应是C环的1位打开,加上羟基或者甲基;去酮基反应是去除C环的4位酮基,且去酮基反应是生成雌马酚或者雌马酚衍生物的过程。从图2中可看出,不同游离苷元由肠道微生物介导代谢形成的产物结构相似。黄豆苷元经肠道微生物作用代谢成去氧甲基安哥拉紫檀素(O-desmethylangolensin,O-Dma)或者雌马酚;染料木黄酮经微生物作用代谢成对乙基苯酚或者5-OH-雌马酚;大豆黄素的代谢结果为6,7,4-三羟基异黄酮。每一种游离苷元在代谢的最后都经历开环或者去酮基作用,生成开环代谢产物或去酮基代谢产物。
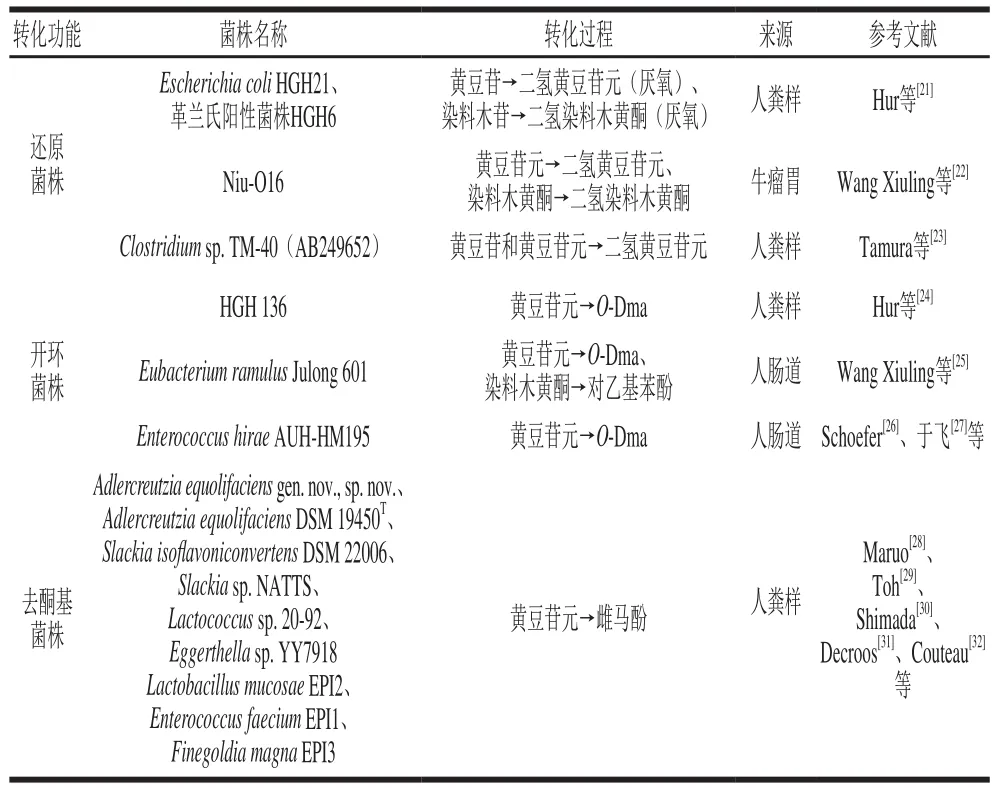
表1 不同转化功能的大豆异黄酮转化菌株Table1 Soy isof l avone transformation by different functional strains
肠道微生物对游离苷元的代谢降解主要是借助于其分泌的一系列酶的作用而实现,不同阶段所需的酶不同,因此对大豆异黄酮的作用方式不同。结合型糖苷的去糖基化过程需要乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)等分泌的β-葡萄糖苷酶;而对游离苷元而言,需要黄豆苷元还原酶、二氢黄豆苷元酶、四氢黄豆苷元还原酶等酶系。在此基础上,有学者研究调控这3 种酶的相关基因,如Schröder等[19]用Slackia isoflavoniconvertens DSM 22006把黄豆苷元转化为雌马酚,通过二维差异凝胶电泳观察几种蛋白质的诱导情况。在确定的肽序列的基础上,作者发现了一组编码黄豆苷元诱导蛋白的8 个基因,在8 个基因中dzr、ddr和tdr经大肠杆菌和酶活性测试,确定其相应的编码产物分别是黄豆苷元还原酶(daidzein reductase,DZNR)、二氢黄豆苷元还原酶(dihydrodaidzein reductase,DHDR)和四氢黄豆苷元还原酶(tetrahydrodaidzein reductase,THDR)。由dzr(AFV15453)编码的DZNR氨基酸序列与Slackia sp. NATTS(BAL46928)显示出95%的序列相似性,与Lactococcus sp. 20-92(BAJ72747)有42%的序列相似性。ddr(AFV15451)编码产物属于“经典”短链脱氢酶/还原酶,由ddr编码DHDR的氨基酸序列与Slackia sp. NATTS(BAL46929)的有93%序列相似性,与Lactococcus sp. 20-92(BAJ72747)有86%的序列相似性。由tdr(AFV15450)编码的THDR氨基酸序列与Slackia sp. NATTS(BAL46928)的有90%序列相似性,与Lactococcus sp. 20-92(BAJ72747)的有87%的序列相似性。类似地,Kawada等[20]发现Eggerthella sp.YY7918编码的DZNR、DHDR和THDR的基因命名分别为eqlA、eqlB和eqlC,其编码序列与Lactococcus sp. 20-92(BAJ72747)有99%的序列相似性。

图2 不同游离苷元在结肠的代谢转化[18]Fig.2 Metabolic transformation of different free aglycones in the colon[18]
影响肠道微生物对大豆异黄酮代谢的因素除了肠道微生物分泌酶的作用,还包括:1)肠道微生物的底物专一性。如Clostridium sp. TM-40(AB249652)只还原黄豆苷元[23],不还原染料木黄酮和大豆黄素;而Eubacterium ramulus可以还原黄豆苷元和染料木黄酮[25],这主要是由于3 种游离苷元的结构具有差异,而若同一种菌株所分泌酶的底物专一性强,有可能造成某些菌株不能同时代谢3 种游离苷元的情况;2)人体肠道微生物组成。研究表明人的雌马酚代谢表型(即能否将黄豆苷元转化为雌马酚)决定于其肠道的微生物组成,雌马酚产生者的肠道中有Streptococcus intermedius spp.、Ruminococcus productus spp.、Bacteroides ovatus spp.等微生物,而非雌马酚产生者的肠道中则缺少这些细菌[32]。
2 大豆异黄酮对肠道微生物菌群结构及其酶活性的影响
大豆异黄酮对肠道微生物的影响主要包括两个方面:1)大豆异黄酮对肠道微生物菌群构成的影响;2)大豆异黄酮对肠道微生物酶活性的影响。这是因为大豆异黄酮在肠道内作为菌群培养基,不仅能为肠道菌群提供营养物质,帮助肠道菌群在肠道中定植、成熟,还能保持肠微生态系统稳定;某些肠道菌群可生成有利于身体健康的代谢产物如短链脂肪酸、乳酸等,维持肠道菌群平衡;还能有助于抑制病原微生物生长[33]。而肠道菌群也会分泌相关促进大豆异黄酮代谢的酶系,因此大豆异黄酮对肠道微生物的酶活性产生一定影响。
2.1 大豆异黄酮对肠道微生物菌群构成的影响
大豆异黄酮在肠道菌的作用下代谢成雌马酚等对人体有益的物质,代谢物的产生取决于特定肠道菌群结构及其发挥的生物转化功能,而特定肠道菌群结构又受到大豆异黄酮调控影响。对17 名绝经后妇女的研究显示,补充大豆异黄酮1 周后,肠道微生物群变化个体差异显著[34]。在这项研究中,受试者被给予含有160 mg大豆异黄酮(包括染料木黄酮、大豆黄素和黄豆黄素)和1 g皂角苷的大豆条。结果发现,在肠道微生物群中Bifidobacteria比例显着增加,Lactobacillus减少,而雌马酚产生者的Bifidobacteria和Eubacteria的水平比非雌马酚产生者的增加更明显。另一项研究也报道了类似的结果,其中39 名绝经后妇女连续两个月每天接受100 mg大豆异黄酮,观察到Clostridium、Eubacterium、Lactobacillus、Enterococcus、Faecalibacterecterium以及Bif i dobacterium的数量增加,而12 名雌马酚产生者体内的Clostridium和Eubacterium的数量比非雌马酚产生者增加更明显[35]。然而也有研究表明,16 名绝经期妇女每天服用一片含有80 mg大豆异黄酮浓缩物的片剂,发现大豆异黄酮对肠道菌群影响不显著[36]。
2.2 大豆异黄酮对肠道微生物酶活性的影响
肠道微生物可产生与宿主能量代谢、物质代谢及遗传信息转运等系列生理过程密切相关而种类繁多的酶系统,主要包括水解酶、氧化还原酶、抗氧化酶等[37]。研究发现,大豆异黄酮对肠道微生物的酶系统有显著影响,其影响途径主要包括:大豆异黄酮通过改变肠道微生物的种类和数量,进而使微生物代谢酶的种类和数量发生相应改变,最终影响到酶参与的代谢反应。大豆异黄酮加快Lactobacillus spp.、Bifidobacterium spp.等分泌β-葡萄糖苷酶的速率[38],进而促进结合型糖苷的水解。不仅如此,大豆异黄酮还促使Slackia isof l avoniconvertens DSM 22006、Eggerthella sp.YY7918等菌株分泌DZNR、DHDR、THDR,进而加快游离苷元的代谢转化过程。大豆异黄酮除了在体内代谢过程中对肠道微生物酶活性产生影响,还增强抗氧化酶活性。Gunae等[39]的研究表明,大豆异黄酮可显著升高大鼠血清中超氧化物歧化酶、过氧化氢酶的活力,减少丙二醛含量,诱导酶活性防御系统,消除老化代谢产物,发挥机体抗氧化机能。
3 大豆异黄酮及其肠道微生物代谢主产物S-雌马酚对人体相关疾病的预防
大豆异黄酮及其肠道微生物代谢主产物S-雌马酚被认为是潜在抗癌物质,对前列腺癌、乳腺癌等雌激素依赖性肿瘤有一定的治疗与预防作用。同时,其作为一种良好的活性氧自由基清除剂,抗氧化作用显著。另外,这两类物质属于弱的植物雌激素,能较弱地与雌激素受体结合并呈现雌激素样活性,具有预防和治疗骨质疏松症、心血管疾病、动脉粥样硬化等多种生物学活性。
3.1 抗肿瘤作用
大豆异黄酮及其肠道微生物代谢主产物S-雌马酚的抗肿瘤活性研究主要集中于抗乳腺癌和前列腺癌,其通过抑制肿瘤细胞增殖、促进其凋亡而发挥抗癌作用。
在预防乳腺癌方面,Ye Dengfeng等[40]证明大豆异黄酮中的染料木黄酮诱导细胞凋亡和典型的G2/M细胞周期停滞。从机理上看,染料木黄酮通过抑制Skp2和促进其下游靶点肿瘤抑制基因p21和p27发挥其肿瘤抑制效应。S-雌马酚(0.1~350 µmol/L)以时间和剂量依赖性方式抑制人乳腺癌细胞系MDA-MB-231和T47D细胞生长,雌马酚被认为是放射增敏剂,能够诱导癌细胞凋亡[41]。
在预防前列腺癌方面,染料木黄酮被广泛研究用来抑制前列腺癌。Bilir等[42]证明染料木黄酮诱导调节几种基因,包括NOTCH3、JAG1、ADCY4和NEU1,这些基因可能成为染料木黄酮治疗前列腺癌的新型分子靶点,从而进一步了解前列腺肿瘤发生过程中涉及到的多分子途径,研究染料木黄酮对这些基因在蛋白质水平和细胞功能的表达影响。S-雌马酚具有显著的抗前列腺癌活性,经S-雌马酚治疗后,LnCap、DU145和PC3 3 种前列腺癌细胞系以浓度依赖性方式表现出细胞凋亡率增加,这可能是S-雌马酚通过Akt特异性途径,进而激活FOXO3a和抑制MDM2表达,从而实现其抗癌作用[43]。
3.2 抗氧化作用
大豆异黄酮能够清除人体内的活性氧自由基,保护人体内脂质、蛋白质、染色体免受活性氧的攻击,减少脂质过氧化物的产生,因而可以防止细胞发生病变,延缓人体组织老化,产生抗机体衰老作用。大豆异黄酮抑制过氧化物生成,是有效的过氧化氢清除剂。Wei Huachen等[44]证明大豆异黄酮中的染料木黄酮可明显抑制致癌剂12-O-十四酰基佛波醇-13-乙酸酯诱导HL-60细胞产生过氧化氢。染料木黄酮的抗氧化能力与结构中4’和5位羟基以及芳香环的位置(C3和C2对称)密切相关。其次,大豆异黄酮的抗氧化作用还表现在减少活性氧自由基对DNA的损伤。8-羟基-2’-脱氧鸟苷是DNA中鸟嘌呤被细胞有氧代谢过程中形成的某些活性氧攻击而产生的一种修饰碱基,即DNA氧化应激损伤的标志分子,大豆异黄酮可以有效抑制8-羟基-2’-脱氧鸟苷的产生[5],因此它能预防DNA的氧化损伤。
在已知的大豆异黄酮所有代谢产物中,S-雌马酚被认为是生理活性最高的成分,其抗氧化活性要比亲本化合物黄豆苷元高出100多倍[45]。S-雌马酚属于多酚类物质,可作为氢/电子受体,清除自由基。Rimbach等[46]研究发现S-雌马酚在清除巨噬细胞产生的一氧化氮能力上和大豆苷元类似,仅次于染料木黄酮。
3.3 对其他疾病的影响
大豆异黄酮对其他常见疾病如心血管疾病、糖尿病、骨质疏松症也有一定的预防和治疗作用。大豆异黄酮对心血管的保护作用是由于大豆异黄酮可以修复内皮细胞损伤。王燕等[47]的研究表明,大豆异黄酮对过氧化氢和脂多糖所致的人脐静脉内皮细胞氧化损伤具有明显的保护作用,并能减少内皮细胞的凋亡,从而维持血管稳态、保持内皮的相对稳定和预防血栓形成。大豆异黄酮能够直接影响细胞增殖及葡萄糖刺激的胰岛素分泌[48],改善葡萄糖代谢,调节人体内的激素和酶,进一步防治人体肥胖、糖尿病及其并发症等疾病。大豆异黄酮预防骨质疏松症是由于其具有雌激素作用。Jin Xin等[49]的研究结果表明黄豆苷元以雌激素受体依赖性方式激活丝裂原活化蛋白激酶/细胞外调节激酶和磷酸肌醇3-激酶/Akt或磷脂酰肌醇3激酶-Akt/Akt,促进人类成骨细胞样MG-63细胞中的增殖、分化和抗凋亡来刺激成骨。
肠道微生物代谢主产物S-雌马酚在预防动脉粥样硬化、防止骨质疏松等方面的作用普遍受到关注。Zhang Ting等[50]的研究结果表明动脉粥样硬化的发展与内质网过度应激密切相关,S-雌马酚上调内质网应激标记物的表达,包括p-PERK、p-eIF2α、GRP78、ATF6和CHOP蛋白;并且Nrf2 siRNA可干扰CHOP的诱导作用,S-雌马酚可通过激活Nrf2信号通路来减轻内质网应激,从而改善动脉粥样硬化。防止骨质疏松方面,S-雌马酚改善骨矿物质密度,抑制白细胞介素-6及其受体的表达,激活雌激素受体β活性,降低破骨细胞相关基因的表达,从而预防骨质疏松症[51]。
4 结 语
近年来,随着肠道微生物在健康调控和代谢控制中的作用逐步得到确认,肠道微生物相关健康科学得到了飞速发展。就大豆异黄酮而言,肠道菌群的参与使我们对大豆异黄酮的体内代谢吸收有了新的认识,而利用膳食调节和优化肠道菌群进而提升人类的健康水平有着巨大的现实意义。虽然大豆异黄酮与肠道菌群的相互作用方面的研究得到了学者极大的重视,并且取得一些可喜的成果,然而,尚有一些问题值得进一步探索:首先,大豆异黄酮对人的有益调节作用主要在于摄入体内的大豆异黄酮在肠道微生物菌群的作用下如何被转化,需要明确肠道菌群结构调整背景下有哪些细菌类群主导参与了大豆异黄酮生物转化过程;其次,肠道微生物通过群落而非单一个体来发挥重要功能,微生物相互作用、共同协作,一起完成复杂的代谢功能,需要明确大豆异黄酮与肠道菌群的相互作用机理;最后,需要解决大豆异黄酮在肠道菌群作用下的代谢通路,明确关键因子的调控作用。
多组学技术迅速发展,为大豆异黄酮与肠道菌群的相互作用研究提供了极大便利[52]。宏基因组高通量测序技术结合生物信息工具分析,有助于查找大豆异黄酮在生物转化过程中的关键细菌群,得到高通量、高分辨率和低误差的检测结果[53]。代谢组学技术有助于发现肠道菌群与代谢的密切关系,寻找潜在的共代谢标志物,鉴定与包括大豆制品在内的膳食代谢过程中的关键功能菌,从而了解大豆异黄酮多成分、多靶点、多层次的作用机制[54]。但是宏基因组学分析并不能区分表达基因与非表达基因,因此,转录组学及蛋白质组学的应用显得尤为必要。最终,多组学的关联分析将有助于进一步阐明大豆异黄酮发挥生理活性的作用物质基础,以及肠道菌群介导的分子机制。最后,研究膳食组分与复杂的肠道菌群系统的相互作用,需要构建人源化的小鼠模型[55],这样可以克服以人为研究对象时无法精确控制食物成分的困难,降低非可控因素的影响,能够相对客观地反映膳食组分的代谢过程。将高通量宏基因组测序技术与宏转录组、代谢组技术相结合用于研究大豆异黄酮在结肠的生物转化过程,并从整体水平对不同层次的研究成果加以整合,可获得研究对象的整体性特征。

