局部晚期宫颈癌根治性手术联合辅助治疗与同步放化疗疗效分析
张雪梅,陈 丽*
(1.承德医学院,河北 承德 067000;2.保定市第一中心医院,河北 保定 071000)
宫颈癌是女性仅次于乳腺癌的最常见恶性肿瘤,发病率居女性生殖系统恶性肿瘤的首位,是妇科恶性肿瘤最常见的死亡原因[1]。宫颈癌全球每年新发病例约50万,占所有新发癌症病例的5%,每年超过26万的妇女死于宫颈癌,主要中、低收入国家。其发病率在发展中国家仍处于较高水平,超过80%发生在发展中国家,中国宫颈癌发病率约占全球新发病例的三分之一[2]。尽管目前宫颈癌筛查在逐渐普及,但因宫颈癌的早期临症状不明显,大部分病例就诊时已处于局部晚期[3],在发展中国家,有70%以上的患者诊断时已处于局部晚期,对于这部分患者,其发病率和死亡率仍在增加,生存率仍然是令人沮丧的[4]。
关于局部晚期宫颈癌的治疗,2019美国国立综合癌症网络(NCCN)宫颈癌临床实践指南(第1版)[5]指出,ⅠB2和ⅡA2期可选择:(1)根治性盆腔外照射+顺铂同期化疗+阴道近距离放疗,(2)广泛性子宫切除术+盆腔淋巴切除术±腹主动脉旁淋巴结取样,(3)盆腔外照射+顺铂同期化疗+近距离放疗,放疗后行辅助性子宫切除术。3种推荐中,首选同期放化疗。然而,在欧洲、日本、韩国以及拉丁美洲,局部晚期宫颈癌的其他治疗方式被认为具有同样的治疗效果,包括根治性手术+术后辅助治疗、新辅助化疗+根治性手术、同步放化疗+辅助化疗或根治性手术、新辅助化疗+同步放化疗等[5]。因此,对于局部晚期宫颈癌的治疗,世界范围内仍没有达成共识,没有公认的标准治疗方法。本研究旨在通过对比两种治疗方法的临床疗效及不良反应、并发症发生率,以期为ⅠB2和ⅡA2期宫颈癌患者治疗方法的选择提供依据。
1 资料与方法
1.1 一般资料
选择2010年01月至2015年06月于解放军总医院妇科和肿瘤内科住院的148例ⅠB2和ⅡA2期宫颈癌患者的临床资料,根据治疗方法分为两组:手术联合辅助治疗组(73例)接受根治性手术后行辅助放化疗和同步放化疗组(75例)。纳入标准:(1)经病理学确诊为宫颈癌;(2)经至少两位副主任医师及以上妇科肿瘤医生行妇科检查证实为IB2和IIA2期;(3)为初次发病确诊为宫颈癌,未合并其他恶性肿瘤。排除标准:(1)合并严重肝肾功能损害或骨髓造血系统疾病等不能耐受放化疗的患者;(2)研究对象相关资料缺失者。
1.2 治疗方案
(1)手术组联合辅助治疗组:直接行广泛性子宫切除+盆腔淋巴结清扫术,术中行腹主动脉旁淋巴结探查,如增大则行腹主动脉旁淋巴结取样或清扫,绝经前患者保留一侧或双侧卵巢并移位至结肠旁沟,并以钛夹标志。术后胃肠功能恢复后行1次化疗,化疗方案选择顺铂+紫杉醇,先予紫杉醇135 mg/m2,加入至500 ml生理盐水持续静脉滴注,化疗前预处理防过敏,维持时间>3 h;紫杉醇静滴结束后同一天予顺铂40 mg/m2,加入至500 ml生理盐水静脉滴注,维持时间>1 h,滴完后继续补液至少1000 ml。术后2~3周膀胱功能恢复后行盆腔外照射,DT46Gy,每次2 Gy,共23次,放疗时同步化疗,化疗方案同前。如术后病理回报阴道残端阳性,补充腔内照射2~3次。(2)同步放化疗组:采用直线加速器外照射,常规设野,盆腔体外照射DT30~34 Gy,每次2 Gy,每周5次;后予盆腔四野外照射,DT20~22 Gy,每次2 Gy。高剂量率铱-l92腔内后装放疗,每次6 Gy,总计5次,A点总剂量80 Gy,治疗7~8周。放疗期间每日阴道擦洗。放疗开始的同时(放疗第1天)予化疗1个疗程,4周后重复1个疗程,放疗结束后继续化疗,共6个疗程,化疗方案同手术组。
1.3 观察指标
观察指标包括:患者年龄、FIGO分期、肿瘤分化程度、病理类型。按欧洲癌症研究和治疗组织的毒性标准评定化疗毒副反应(血液毒性及胃肠道反应)、放疗毒副反应(放疗性膀胱炎、直肠炎)。手术组观察术中及术后输血情况、术中手术副损伤(血管、膀胱、输尿管、直肠等损伤)、术后并发症(发热、感染、血栓形成、肠梗阻、切口愈合不良及淋巴囊肿形成等)。随访预后情况(复发或远处转移、死亡)。
1.4 术后随访
术后3个月内每月随访1次,之后每3个月随访1次至2年,术后3-5年每隔6个月随访1次,如无复发则之后每年随访1次。以电话随访及门诊随访为主。
1.5 统计学方法
采用SPSS 22.0统计软件进行数据分析。正态分布的计量资料用均数±标准差表示,组间比较用t检验。计数资料用百分比表示,组间比较用x2检验。检验水平α=0.05,P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料比较
本研究共纳入FIGO分期为ⅠB2和ⅡA2期的宫颈癌患者148例,其中手术联合辅助治疗组73例,同步放化疗组75例,两组患者的年龄、FIGO分期、肿瘤分化程度、病理类型比较,差异无统计学意义(P>0.05),两组间具有可比性(表1)。
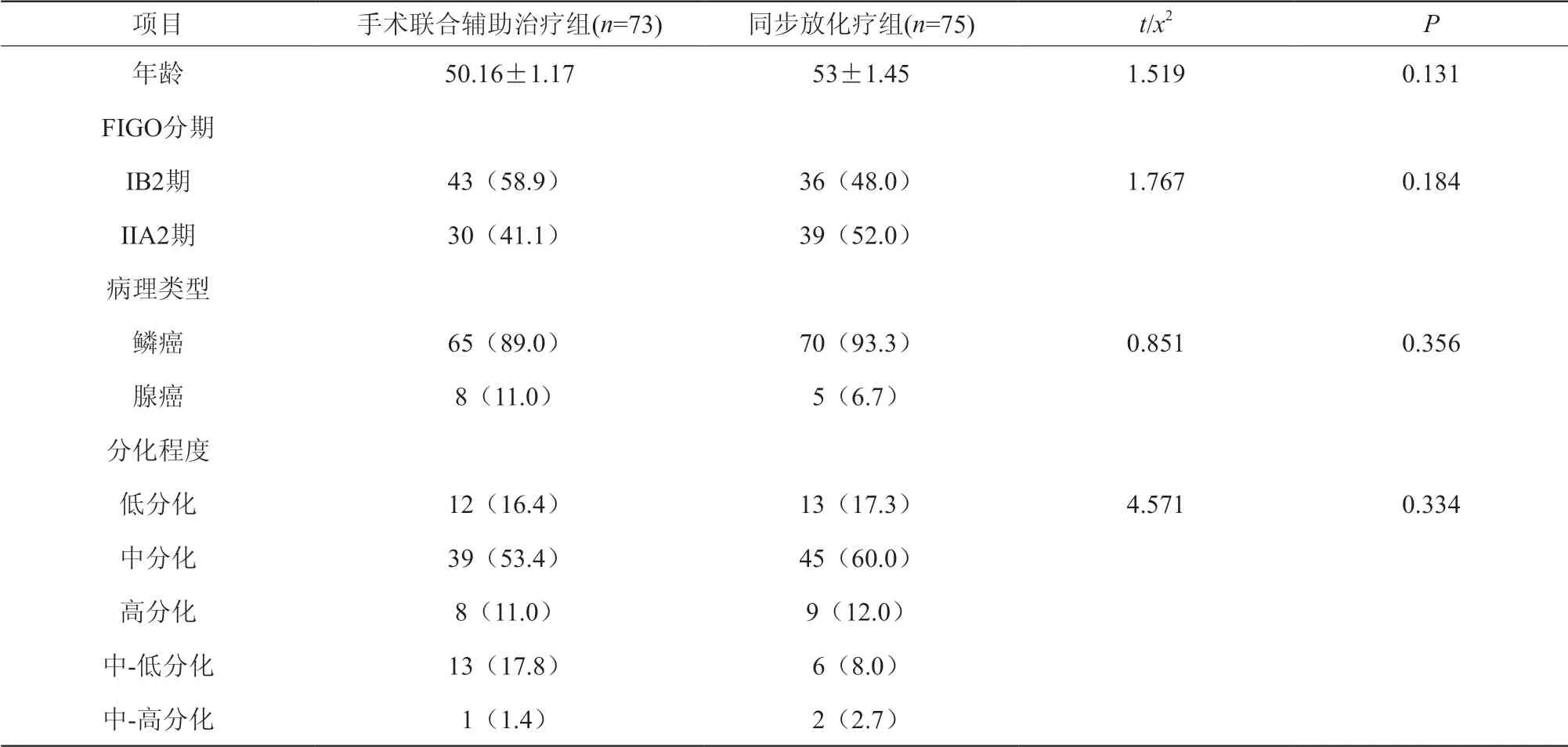
表1 两组患者一般资料
2.2 治疗效果
除死亡病例,两组患者随访3年的疗效比较,根治手术联合放化疗组3年生存率(86.3%)、复发及远处转移率(16.4%)与同步放化疗组3年生存率93.3%)、复发及远处转移率(8.0%)差异均无统计学意义(P>0.05)。
2.3 两组的毒副反应及并发症比较
手术组患者的胃肠道反应、急性直肠毒性及急性膀胱毒性发生率比较,差异有统计学意义(P<0.05),2级以上骨髓抑制及肝肾功能损害发生率比较,差异均无统计学意义(P>0.05)(表2)。所有纳入患者均无因治疗毒性反应而中断者,治疗依从性好,无因毒副反应或并发症而出现治疗相关性死亡病例。

表2 两组患者放疗及化疗后毒副反应及并发症比较[例(%)]
2.4 手术相关并发症
手术组共纳入符合标准患者73例,其中有39例(53.4%)因术中出血,术中或术后需输血纠正贫血治疗。有7例(9.6%)出现手术副损伤,其中3人术中出现输尿管损伤,2人出现膀胱损伤,1人出现直肠损伤,1人出现血管损伤(右髂总静脉破裂)。有18例(24.7%)出现术后并发症,8人出现术后持续高热,3人出现术后感染(泌尿系感染2人,肺部感染1人),1人出现肠梗阻,1人出现下肢静脉血栓,1人出现腹部切口裂开,4人出现盆腔淋巴囊肿。
3 讨论
目前宫颈癌治疗手段主要包括手术、放疗、化疗和多种治疗方式联合的综合治疗。对于早期宫颈癌的患者,治疗可选择根治性手术(广泛性全子宫切除±盆腔淋巴结清扫术±腹主动脉旁淋巴结清扫术)或根治性放疗,预后良好,其5年生存率达90%。对于晚期宫颈癌的患者,推荐同步放化疗为标准治疗方案,5年总生存率可达40%。然而,对于局部晚期宫颈癌患者,目前的标准治疗方案仍存在争议。局部晚期宫颈癌是具有高危因素的宫颈癌,局部肿瘤体积大,手术难度大,且常有浸润性生长或淋巴结转移,易复发及转移,预后较差。近年来国内外学者着力于探索放疗、化疗联合手术治疗的综合治疗方法用于局部晚期宫颈癌患者的临床疗效[6]。 刘瑶等[7]对73例接受同步放化疗的Ib2和IIa2期宫颈癌患者的临床病理资料进行整理与分析,结果表明,治疗有效率为91.78%,疾病控制率为97.26%;3年DFS为84.93%,0S为86.30%;5年DFS为79.45%,0S为82.19%,指出同步放化疗治疗Ib2期和IIa2期宫颈癌的近、远期疗效肯定,不良反应可耐受,是一种可供选择的方法。2008年,Meta分析协作组[8]纳入13项随机对照研究比较同步放化疗和单纯放疗疗效,分析发现前者5年OS延长6%(HR=0.81,P<0.001),同时前者也明显降低局部及远处复发风险。
同步放化疗能提高生存率和局部控制率的原理在于化疗和放疗协同效应。放化疗同时进行缩短了治疗周期,避免肿瘤细胞再增殖;化疗可使肿瘤细胞进入增殖期,从而达到增敏效果,还可以抑制放射损伤的修复。此外,除了对放疗产生增敏及巩固等作用,化疗本身也有肿瘤杀伤作用,且静脉化疗为全身用药,可能会减少远处转移。对于年轻患者,直接放疗对卵巢功能影响较大,围绝经期症状的出现影响生活质量,同时对患者心理上也会造成影响,可行卵巢悬吊以尽量减轻放射线对卵巢功能的损害。此外,有研究表明在化疗前使用促性腺激素释放激素激动剂,使卵泡休眠可减少放疗及化疗药物的侵害[9]。
本研究结果显示,同步放化疗组与手术组获得相似的生存结局,3年生存率、复发及远处转移率差异无统计学意义,但是同步放化疗避免了手术并发症,手术对于患者机体是一种创伤,围手术期易出现多种并发症,增加了患者出血、输血、感染、器官损伤、肠粘连、肠梗阻及血栓形成等的风险和痛苦,严重时可危及生命,术后淋巴囊肿形成产生压迫症状,易造成下肢水肿,腹部切口及阴道残端愈合不良或反复感染等,严重影响患者术后的生活质量。此外,手术增加了术后辅助治疗的胃肠道反应、急性直肠毒性及急性膀胱毒性发生率,可能与术中分离组织器官或术中损伤,以及术后胃肠功能等恢复差有关。本研究几乎所有患者出现不同程度的放化疗毒副反应,但多数经对症处理后症状缓解或消失,依从性和耐受性良好。
因此,我们认为,对于ⅠB2和ⅡA2期局部晚期官颈癌患者,采取同步放化疗效果良好,具有较高的安全性,相比于直接行根治手术联合辅助治疗,首选同步放化疗。但本研究随访时间尚短,其远期不良反应和生存结局尚待进一步长时间随访及大样本研究。

