酸性微环境在肿瘤中作用的研究进展*
杨建芬
(赣南医学院2016级硕士研究生,江西 赣州 341000)
肿瘤微环境由肿瘤细胞、免疫细胞、内皮细胞、间充质干细胞以及大量的细胞外基质等构成,微环境内各种成分之间的相互作用调节肿瘤的发生发展。研究表明,肿瘤的微环境对肿瘤的增殖、侵袭、迁移及血管生成等起着重要的作用,并阻碍有效的抗肿瘤免疫,影响着肿瘤的恶变和转移[1]。由于糖酵解增强,缺氧,以及组织灌注不足等,肿瘤微环境中积聚大量的酸性代谢产物,使肿瘤微环境呈酸性。研究表明,酸性微环境在肿瘤的增殖、侵袭迁移以及免疫逃逸等过程中起着重要的作用,并影响着肿瘤的有效治疗[2],使肿瘤细胞对放化疗不敏感,导致肿瘤治疗更加困难[3](见图1)。本文就近年来酸性微环境在肿瘤中作用的研究进展进行综述。
1 酸性微环境的成因及其调节机制
1.1酸性微环境成因肿瘤组织的细胞外环境常呈酸性,pH值在6.5至6.9范围内,而正常组织的细胞外环境常呈碱性,pH值在7.2至7.5范围内[4],这是实体肿瘤内存在的普遍现象。导致酸性微环境形成的原因较为复杂,其主要原因有以下几点:(1)Warburg效应——即使有氧条件下,肿瘤细胞也倾向于糖酵解维持肿瘤快速增殖所需的能量和碳源,并产生大量乳酸。糖酵解产生的乳酸被单羧酸转运蛋白(monocarboxylate transporter, MCT)转运至细胞外,使细胞外环境呈酸性。此外,肿瘤细胞在多种癌基因c-Myc、Ras等影响下,糖酵解相关蛋白以及关键酶表达水平增高,使糖酵解速率得以提高,进一步增加糖酵解酸性产物[3]。(2)肿瘤中的磷酸戊糖通路表达上调,在磷酸戊糖途径中,6-磷酸葡萄糖转化为果糖1-6磷酸生成3个CO2和6个H+。磷酸戊糖途径产生的二氧化碳可以在碳酸酐酶(carbonicanhydrase, CA)的作用下发生水合作用产生碳酸,使pH值下降。(3)多种肿瘤中的脂肪酸合成增加:柠檬酸合成一个脂肪酸可产生7个CO2和7个H+,有助于酸性微环境的形成[5]。(4)由于多数肿瘤处于高代谢率以及高增殖率状态,肿瘤组织的氧供远远不足氧耗量,使肿瘤组织常呈缺氧状态,缺氧条件下的肿瘤细胞通过上调缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)的表达适应缺氧微环境,HIF-1α表达的增强可上调糖酵解相关基因以及磷酸戊糖通路相关基因的表达,从而促进酸性代谢产物的生成[3]。(5)由于组织灌注不足,肿瘤血管发展为功能不全的血管,无法将氢离子、乳酸酸性产物及时排出,导致肿瘤细胞外酸性产物堆积[6]。
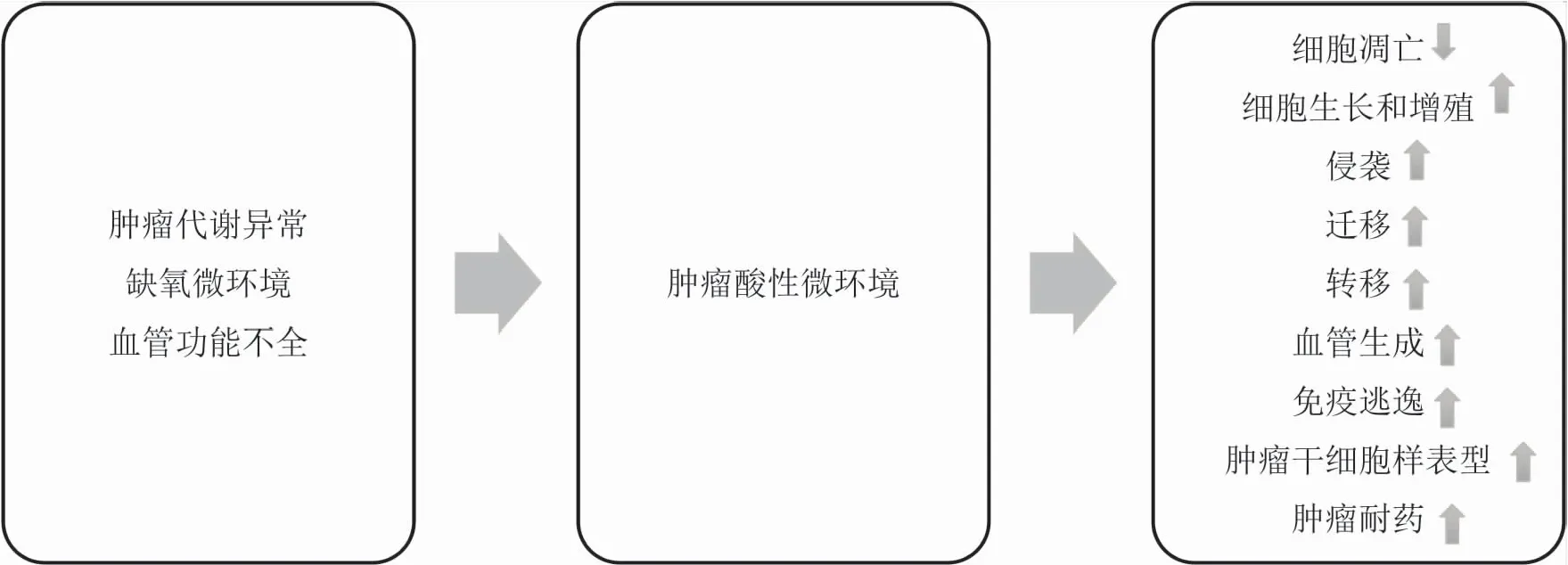
图1 肿瘤酸性微环境成因及其在肿瘤中的作用
1.2酸性微环境的调节机制由于肿瘤细胞内酸性代谢产物增多以及H+增加,肿瘤细胞为避免细胞内酸中毒,需将氢离子以及酸性代谢产物排出至细胞外,使细胞内pH值保持在正常轻微的碱性水平,从而导致细胞外环境长期处于低pH值状态[7]。为达到这一目的,肿瘤细胞需要利用细胞质膜上的一些转运蛋白调节细胞内外的pH值。这些转运蛋白主要包括:(1)囊泡型H+-ATPases(vacuolar-H+-ATPase, V-ATPase);(2)钠氢交换蛋白 (Na+/H+exchanger, NHE);(3)MCT;(4)碳酸氢盐转运蛋白;(5)氢离子乳酸共转运蛋白。此外,CA家族通过催化二氧化碳水合作用来调节pH。这些转运蛋白以及CA家族在肿瘤的进展中起着重要的作用,同时也为肿瘤的靶向治疗提供了有利条件[8]。
2 酸性微环境在肿瘤进展中的作用
2.1酸性微环境对肿瘤细胞发生的影响肿瘤细胞典型的特征之一是不受管制的生长[9]。由于肿瘤细胞内持续的排出乳酸,细胞内酸性环境使肿瘤细胞质膜上V-ATPase、NHe等氢离子转运蛋白以及乳酸转运蛋白表达增高,将酸性代谢产物排出肿瘤细胞外,使肿瘤细胞内pH值呈偏碱性,细胞内碱度的变化与细胞进入细胞周期S期有关,并保持细胞处于不受控制的增殖状态[10]。在这种条件下,细胞内pH值的增加促进了细胞从S期向G2/M期转变,刺激了有丝分裂,促进肿瘤细胞的增殖[3]。此外,酸性微环境下Src蛋白的活化与肿瘤细胞的增殖也有密切关系,Src蛋白的激活可促进肿瘤细胞快速从G1期进入到S期,从而促进肿瘤细胞的增殖[11-12]。
在pH 7.5的培养基中,经4 Gy射线照射后,约15%的细胞在24 h内发生凋亡。而在pH 6.6培养基中,结直肠癌细胞在4 Gy射线照射后24 h内均无凋亡迹象。此外,相比于pH值为7.5的培养基,pH 6.5培养基中的聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]裂解和DNA断裂也更少,说明酸性微环境能够减少PARP裂解和DNA断裂,抑制结直肠癌细胞的凋亡[13]。还有研究表明,在酸性条件下(pH 6.5)培养淋巴瘤细胞,T细胞死亡偶联基因 8(T-cell death associated gene 8,TDAG8)被激活,TDAG8可通过上调抗凋亡蛋白Bcl-2和Bcl-xL的表达抵抗葡萄糖或谷氨酰胺缺乏引起的细胞凋亡[14]。
2.2酸性微环境对肿瘤侵袭迁移的影响肿瘤患者死亡的主要原因是由于原发性肿瘤向远处的转移。肿瘤的侵袭和转移涉及肿瘤细胞与宿主细胞及其微环境之间的多重相互作用。研究表明,酸性微环境可通过破坏肿瘤的粘附连接、诱导肿瘤细胞上皮间充质转化(epithelial-mesenchymal transition,EMT)以及促进肿瘤细胞外基质(extracellular matrix, ECM)的降解在肿瘤细胞侵袭迁移的过程中发挥作用[15-17]。
2.2.1酸性微环境与肿瘤的粘附连接肿瘤的粘附连接对其转移潜能有一定的影响。在肿瘤的转移过程中,肿瘤周围组织中细胞粘附能力的降低可使肿瘤细胞从原发肿瘤上脱落。多种因子可调节肿瘤的粘附连接,如Src蛋白、上皮型钙黏蛋白 (E-cadherin)等。Src蛋白的活化可使E-cadherin的表达减少,E-cadherin的表达减少与肿瘤细胞从原发肿瘤上脱落有密切关系,而其表达增加可抑制侵袭迁移的发生。研究表明,酸性微环境下,肿瘤细胞的Src蛋白被激活,Src蛋白通过激活蛋白激酶C-δ(protein kinase C-δ,PKCδ)途径破坏p120-连环蛋白介导的粘附连接,并降解E-cadherin,粘附连接的破坏使肿瘤细胞与细胞的接触松散,增加了细胞的运动和迁移,从而促进了肿瘤的转移[12]。
此外,粘附连接的破坏常与EMT有关,粘附连接蛋白E-cadherin在EMT的诱导过程中起着重要的作用。EMT的分子特征之一是E-cadherin以及细胞角蛋白8等上皮标记物的表达减少或功能缺失[18]。 在EMT过程中,细胞表面的E-cadherin分子减少,连接复合物的胞内β-catenin释放,从而激活核转录因子淋巴增强子结合因子(lymphoid-enhancer-binding factor,LEF)/T-细胞因子-4(T-cell factor-4,TCF4),诱导上皮细胞侵袭性肿瘤基因表达模式及间充质表型。因此,酸性微环境导致的E-cadherin的表达减少也在EMT形成过程中也起着一定的作用[15]。研究表明,抑制E-cadherin的表达可以干预EMT的诱导过程,从而抑制肿瘤的侵袭迁移过程[17]。
2.2.2酸性微环境与肿瘤细胞外基质的降解在癌细胞转移过程中,ECM的降解是肿瘤细胞从原发癌转移及随后转移的先决条件。ECM的降解需要基质金属蛋白酶(matrix metalloproteinase,MMPs)。研究表明,酸性微环境能促进肿瘤细胞中MMP2、MMP9的激活,从而促进肿瘤细胞的迁移[19]。黑色素瘤细胞中,酸性胞外pH值可通过丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)、NF-κB信号通路以及增加磷脂酶D(phospholipase D,PLD)活性诱导MMP9的表达来促进肿瘤细胞转移[20-21]。乳腺癌细胞中,酸性微环境通过活性氧类 (reactive oxygen species, ROS)/蛋白激酶B (protein kinase B, PKB)/NF-κB途径促进肿瘤细胞的侵袭,然而用活性氧清除剂清除ROS后,酸性微环境诱导的PKB和NF-κB的激活可减少,乳腺癌细胞侵袭性减弱[22]。此外,酸性pH值对肿瘤细胞中组织蛋白酶B的分布和分泌也有影响,癌症中的酸性微环境可诱导细胞内组织蛋白酶B的外周分布,并且还增加其分泌。组织蛋白酶B不仅可降解基底膜层粘连蛋白、纤维连接蛋白和Ⅳ型胶原,还能激活细胞外基质中的金属蛋白酶以及尿激酶型纤溶酶原激活剂等,促进肿瘤细胞的侵袭和迁移[23]。除此之外,还有研究证明酸性细胞外pH值能够促进整合素αvβ3的激活,整合素αvβ3激活对肿瘤的侵袭迁移也发挥重要的作用[24]。由此可见,酸性微环境可通过NF-κB等信号通路诱导MMP2、MMP9等基质金属蛋白酶的表达,从而促进肿瘤细胞外基质降解,增强肿瘤的侵袭性。
2.3酸性微环境对肿瘤血管生成的影响肿瘤新血管生成在肿瘤的生长和转移过程中起重要作用,血管内皮细胞生长因子(vascular endothelial growth factor , VEGF)、白细胞介素-8(IL-8)等多种血管生长因子促进肿瘤的血管生成[25]。VEGF可以增强微血管渗透性,使蛋白质累积在间质,促进血管生成,VEGF还能通过启动其受体VEGFR信号通路促进肿瘤血管内皮细胞的存活和迁移;IL-8也是一种重要的血管生成因子,可通过肿瘤内皮细胞的受体促进肿瘤血管的形成。研究表明,酸中毒可刺激胶质瘤和胶质母细胞瘤细胞中VEGF的表达[26-27]。此外,酸性细胞外环境通过激活转录因子核因子κB(nuclear factor-κB,NF-κB)和激活蛋白1(activator protein-1,AP-1) 促进人胰腺癌和卵巢癌细胞中IL-8的表达[28]。体外实验表明,降低培养基pH值(6.3~6.7)也会导致乳腺癌患者血小板源性内皮细胞生长因子(platelet-derived endothelial cell growth factor , PD-ECGF)的升高,PD-ECGF也是一种具有促进血管生成作用及刺激内皮细胞生长的细胞生成因子[29]。在酸性pH条件下培养人黑色素瘤细胞,可使VEGF和IL-8上调[26]。体外研究证明,黑色素瘤细胞产生的IL-8与其在裸鼠体内的转移潜能直接相关,提示IL-8是一种促进人黑色素瘤进展和转移的生长因子[27]。此外,酸性微环境下整合素αvβ3的激活也参与肿瘤血管生成的过程[24],说明酸性微环境对肿瘤的血管生成起着一定的促进作用。
2.4酸性微环境对肿瘤免疫逃逸的影响尽管机体存在免疫监视,但肿瘤细胞仍能够增殖生长,并扩散转移,说明肿瘤细胞能够逃避机体免疫监视。研究表明,在肿瘤的细胞外酸性pH值可影响其微环境内的免疫细胞、基质细胞等。在细胞外乳酸过多的条件下,细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)的增殖受到抑制,白细胞介素-2(IL-2)、干扰素-γ(interferon-γ,IFN-γ)等细胞因子生成减少,抗肿瘤免疫调节受到抑制。此外,研究还证明,细胞外酸中毒使CTLs内穿孔素和颗粒酶B的含量降低,CTLs的细胞毒性活性受到抑制,无法有效杀伤肿瘤细胞,实现其免疫逃逸[30]。研究表明,酸性细胞外pH可抑制IL-2、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和T细胞受体的表达,使肿瘤特异性CD8+T细胞功能受损[31]。此外,乳酸在抗原特异性T细胞刺激过程中抑制树突状细胞(dendritic cells,DCs)的活化,DCs在机体抗肿瘤免疫过程中起着核心作用,只有在活化后才能发挥抗肿瘤免疫功能[32]。因此,酸性微环境有助于肿瘤细胞的免疫逃逸。
2.5酸性微环境对肿瘤干细胞样表型的影响肿瘤干细胞表型受肿瘤微环境的调控。前期研究表明,低氧微环境调节着肿瘤干细胞的维持,这与诱导HIF-1α及HIF-2α有关:缺氧条件下,肿瘤干细胞中HIF-1α和HIF-2α被激活,通过Notch信号通路使肿瘤干细胞维持自我更新和未分化状态。肿瘤干细胞标记物Sox2、Oct4表达也上调,使肿瘤干细胞获得多能性[33]。此外,HIF-2α还能激活癌基因c-Myc,而c-Myc对肿瘤干细胞未分化状态的维持起着至关重要的作用[34]。后续研究证明,酸性微环境在不依赖于低氧环境的条件下,诱导肿瘤干细胞中HIF-2α的表达,维持肿瘤干细胞的自我更新和未分化状态,并促进胶质瘤干细胞标记物Olig2、Oct4和Nanog的表达,使肿瘤干细胞获得多能性[35]。
3 靶向肿瘤酸性微环境的治疗策略
酸性微环境强烈影响弱碱性化疗药物的分布和吸收,使肿瘤细胞产生耐药性。对于化疗的肿瘤而言,药物如蒽环类、长春新碱等呈弱碱性且亲脂性弱,部分细胞外的药物在酸性环境中易发生质子化而不能透过胞膜,从而不能进入肿瘤细胞内;部分药物虽然能进入细胞内,但它们容易积聚在酸性细胞器中。此外,酸性微环境对肿瘤的放射治疗也不敏感。因此,细胞外酸性微环境对于肿瘤的治疗而言是一项挑战,但同时也为专门针对肿瘤细胞的治疗提供了新可能性。
近年来,针对酸性微环境的治疗策略有一定的进展:(1)设计能进入固体肿瘤核心的弱酸性化合物,使其在酸性微环境中易于扩散,从而产生疗效。例如,在细胞外酸性条件下,弱酸性化疗药物如马法兰的摄取会增强;(2)利用碳酸氢钠等缓冲液,使肿瘤微环境碱化。研究证明,口服碳酸氢钠治疗增加了小鼠转移性乳腺癌模型的细胞外pH值,并减少了转移灶的形成;口服碳酸氢钠缓冲液中和肿瘤pH值也可提高免疫治疗的疗效[36];(3)应用膜插入肽(pHLIP):在酸性微环境中,pHLIPs将c-末端插入到膜上,形成稳定的跨膜螺旋。治疗分子与pHLIP的结合使化疗药物直接释放到细胞中[37]。
除此之外,抑制酸性微环境转运系统,使细胞外pH值正常化,使细胞内pH值降低,也可干扰癌细胞的增殖,促进癌细胞的凋亡。如质子泵抑制剂艾司奥美拉唑等,这些抑制剂在酸性条件下被激活,通过抑制质子的泵出使肿瘤细胞外pH值升高。研究表明,艾司奥美拉唑抑制黑色素瘤细胞的增殖,并通过使肿瘤细胞内酸化诱导肿瘤细胞死亡[38]。因此,质子泵抑制剂的使用有可能成为肿瘤治疗的新策略之一。此外,氨基磺酸盐等CAIX抑制剂也可通过抑制CAIX的活性降低细胞外pH值而产生一定的抗癌作用[39]。近年来研究表明,针对MCT 1的治疗药物可以产生多种抗癌作用,MCT 1抑制剂AZD 3965目前正在进入晚期实体肿瘤Ⅰ/Ⅱ期临床试验[40]。另外,MCT1,MCT2与MCT4的协同抑制剂氯尼达明在体外和体内都能增强阿霉素的疗效[41]。
4 结 语
综上所述,肿瘤中酸性微环境对肿瘤的发生发展至关重要。肿瘤代谢异常、实体肿瘤缺氧微环境以及肿瘤血管功能不全导致酸性微环境的形成,酸性微环境促进肿瘤的侵袭迁移、免疫逃逸、化疗耐药等,并在某些情况下促进EMT和干细胞样表型等。肿瘤酸性微环境调控过程中的主要因子如V-ATPase、NHE以及MCT等对肿瘤的发展也发挥重要的作用,并为肿瘤治疗提供靶点。因此,对肿瘤酸性微环境的干预可能为肿瘤的靶向治疗提供新的机会。然而,酸性微环境对肿瘤发生发展的影响机制及其信号通路研究目前还处于初级阶段,有待进一步研究,靶向酸性微环境的干预策略以及新的联合治疗策略也是今后需要努力的方向。

