HCG培养自体淋巴细胞宫腔灌注治疗原因不明复发性流产效果观察及作用机制
赵婷,姚吉龙,张华坤,刘庆芝
(南方医科大学附属深圳市妇幼保健院,广东深圳 518000)
生殖医学的发展给越来越多的复发性流产患者带来了福音。系统性检查夫妇双方的染色体、感染因素、血栓前状态、内分泌因素、自身免疫因素等,并针对性地治疗可使部分患者成功妊娠。但仍有部分复发性流产患者通过上述检查并未发现明显异常,被称为原因不明复发性流产(URSA),推测可能与母体对胚胎父系抗原排斥有关,其治疗非常棘手。有研究表明,在体外将外周血淋巴细胞加入子宫内膜细胞中培养后,可以增加滋养细胞对子宫内膜的侵袭力,说明自体淋巴细胞可能改善了子宫内膜的免疫状态[1]。目前对自体淋巴细胞体内宫腔治疗的研究甚少。本研究通过对URSA进行绒毛膜促性腺激素(HCG)培养自体淋巴细胞宫腔内灌注治疗,探究该方法对妊娠结局的影响;并于治疗后取少量内膜组织,检测不同妊娠结局患者内膜组织中白细胞介素2(IL-2)、IL-8、肿瘤坏死因子α(NF-α)、T细胞活化后表达和分泌的调节蛋白(RANTES)的水平,探究其相关机制,从而为URSA患者提供新的治疗方法。
1 资料与方法
1.1 临床资料 选取2016年9月~2017年9月就诊于本院生殖综合门诊的URSA患者46例,年龄(32.15±4.08)岁,连续流产次数≥2次。本研究患者子宫无器质性病变及生殖道畸形,无感染因素,无内分泌检查异常,无遗传性疾病且夫妇双方染色体检查无异常,排除自身免疫功能紊乱。将46例患者随机分为观察组和对照组各23例,观察组年龄(33.09±4.39)岁,BMI(22.33±1.63)kg/m2,子宫内膜厚度(8.96±1.02)mm;对照组年龄(31.22±3.57)岁,BMI(22.39±1.78)kg/m2,子宫内膜厚度(9.00±1.23)mm。两组临床资料具有可比性。本研究经医学伦理委员会批准,患者均签署知情同意书。
1.2 自体淋巴细胞分离及宫腔灌注治疗方法 对照组常规进行主动免疫治疗,观察组进行自体淋巴细胞宫腔灌注治疗及内膜搔刮并取样。连续B超监测观察组排卵情况,于排卵前4~5 d,抽取患者自体外周血10~20 mL,应用淋巴细胞分离液分离外周血淋巴细胞,并使用TCM199 (Gibco, Grand Island, NY, USA)洗涤2次后,将细胞密度调至1×106/mL,置于RPMI1640培养基(美国Sigma公司)及10%血清白蛋白中与HCG(3~6 U/mL)混合共培养24 h后,离心分离出淋巴细胞。经生理盐水洗涤、定容,将细胞密度调整为(1~5)×108/mL,重悬至300~500 μL于5 mL无菌离心管中备用。排卵前3 d,患者取膀胱截石位,0.1%碘伏常规消毒外阴及阴道,人工授精管连接1 mL注射器,抽取分离好的淋巴细胞,缓慢注射入宫腔内,停留几秒钟后取出人工授精管,患者平躺休息15~20 min。宫腔灌注2个月经周期后指导患者备孕。
1.3 观察指标 半年后比较两组妊娠结局(持续妊娠、再次流产、未妊娠)。比较观察组不同妊娠结局者的年龄、流产次数、BMI、子宫内膜厚度及治疗后子宫内膜组织中IL-2、TNF-α、IL-8、RANTES水平。宫腔灌注1个周期后于黄体期,常规消毒外阴及阴道,用一次性内膜取样器抽取少量内膜组织,生理盐水洗涤,离心收集标本,后置于冻存管中(Falcon),迅速放入液氮中,后至-80 ℃冰箱储存备检。IL-2、IL-8、TNF-α、RANTES试剂盒购自美国Bio-rad公司,按照Bio-plex操作说明书进行检测。

2 结果
2.1 两组妊娠结局比较 观察组持续妊娠9例、再次流产3例、未妊娠11例,临床妊娠率为39.13%;对照组持续妊娠2例、再次流产6例、未妊娠15例,临床妊娠率为8.69%;两组临床妊娠率比较P<0.05。
2.2 观察组不同妊娠结局者一般情况比较 见表1。各组年龄、BMI、子宫内膜厚度比较差异均无统计学意义(P均>0.05)。
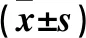
表1 观察组不同妊娠结局者一般情况比较
2.3 观察组不同妊娠结局者治疗前后子宫内膜组织中IL-2、TNF-α、IL-8、RANTES水平比较 见表2。
3 讨论
URSA是生殖医学领域的一大难题,其病因不明,复杂多样,治疗棘手[2]。URSA患者承担着巨大的社会心理压力,如何解决此类患者的妊娠问题,提高其妊娠率,成为临床医生亟待解决的问题。URSA可能与母胎间免疫调节紊乱有关。胚胎携带父系抗原种植于子宫内膜,相当于一种半同种移植,如果母体对胚胎父系抗原免疫低反应,不能识别父系抗原,就会发生免疫排斥,导致流产。目前对URSA患者的治疗,主要是丈夫或第三方供血的淋巴细胞主动免疫治疗及静脉注射免疫球蛋白,但其有效性至今尚存在争议。本研究采用自体淋巴细胞宫腔灌注,避免了丈夫及第三方供血可能造成的血源性感染、过敏反应等。且宫腔灌注直接作用于子宫内膜局部,操作简便,易于被患者所接受。Nakayama等[3]将外周血单核细胞(PBMC)加入小鼠胚胎的培养基中,发现胚胎的侵袭作用增强;若HCG与PBMC共同孵育后再加入培养基中,则胚胎的侵袭作用显著增强。表明HCG增强了PBMC的作用。HCG与外周血淋巴细胞作为妊娠期间重要的激素及免疫细胞,两者作用相辅相成。基于此本研究将自体淋巴细胞进行预处理,将其与HCG共培养24 h,从而增强自体淋巴细胞对子宫内膜局部的免疫调节作用。
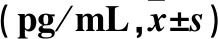
表2 观察组不同妊娠结局者治疗前后子宫内膜组织中IL-2、TNF-α、IL-8、RANTES水平比较
注:与相同妊娠结局治疗前比较,*P<0.05。
Madkour等[4]对至少2次种植失败的患者,在移植胚胎前给予已培养的自体外周血淋巴细胞宫腔内治疗后,患者的胚胎种植率(21.54%)及临床妊娠率(44.44%)均显著上升。Yu等[5]研究也表明,HCG体外培养自体PBMC宫腔注射后,既往有反复种植失败的患者临床妊娠率也明显提高,达46.24%。目前有关宫腔灌注治疗的研究主要针对反复种植失败的患者。本研究首次对URSA患者给予宫腔灌注HCG孵育的自体淋巴细胞,同样取得了较高的妊娠率。提示对于URSA患者,自体淋巴细胞宫腔灌注可能为一种较好的治疗方法。
辅助性T淋巴细胞(Th),又被称为CD4+细胞,其与自然流产密切相关,其根据功能的差异及分泌细胞因子的不同分为Th0、Th1、Th2细胞亚群。Th0细胞是前体细胞,起主要作用的是Th1、Th2细胞。Th1细胞可分泌IL-2、IL-12、干扰素γ、TNF-α等,促使巨噬细胞、NK细胞增殖分化,通过介导细胞免疫应答,参与超敏反应及器官特异性免疫调节,起到免疫杀伤的作用[6]。Th2细胞则可分泌IL-4、IL-6、IL-5、IL-8等细胞因子,抑制炎症因子的生成,促进B细胞增殖分化及抗体的生成,通过体液免疫发挥免疫耐受的作用[7]。因此,要维持正常妊娠,母体免疫应向Th2偏移,以促使母体与胚胎间免疫容受的形成[8]。IL-8为Th2细胞因子,可促进子宫内膜血管的形成,促进胚胎着床,趋化激活中性粒细胞介导免疫平衡[9,10]。RANETS具有类封闭因子作用,能够阻止母体NK细胞对同种异基因胎儿父系抗原的免疫识别及应答,抑制混合淋巴细胞反应;妊娠过程中如果其产生减少,母体会将胚胎视为异物对其进行免疫攻击,从而导致流产[11]。IL-2、TNF-α是Th2细胞产生的重要细胞因子,在正常早期妊娠的绒毛及间质细胞中很少表达,IL-2可与TNF-α产生协同作用,激活NK细胞,促使淋巴细胞增殖转化为细胞毒性细胞,产生免疫毒性作用[12,13]。正常情况下,胚胎为避免被母体免疫细胞排斥,应使Th1/Th2免疫反应处于平衡状态,在胚胎植入及以后的怀孕过程中,母体会分泌大量Th2细胞因子,使免疫反应向Th2转化,以Th2型反应为主,利于妊娠的进展[14]。本研究结果发现,与治疗前相比,观察组中持续妊娠者治疗后IL-2、TNF-α水平下降,IL-8、RANETS水平升高,差异均有统计学意义;而再次流产与未妊娠者相关细胞因子水平治疗前后比较差异无统计学意义。Th1型细胞因子减少,Th2型细胞因子增多,促使免疫反应Th1/Th2平衡向Th2型偏移,Th2型反应占主导地位,促使母胎免疫耐受的形成,从而使妊娠过程继续进行下去。
综上所述,HCG培养自体淋巴细胞宫腔灌注治疗可显著改善URSA患者的妊娠结局,其机制可能通过调节子宫内膜局部细胞因子的改变,促使免疫反应向Th2型偏移,促使母体与胎儿间免疫耐受形成,从而避免流产的发生。但本研究也有不足,样本量较小,今后对其作用机制还要进行深入研究。

