高血压伴高同型半胱氨酸患者血管内皮细胞损伤的相关标志物水平变化观察
赵亮 谢伟 李娜 张雯 喜林强 邹琦 张娟娟 李岳阳 沈晓程
[摘 要] 目的 分析高血压伴高同型半胱氨酸(Hcy)患者血管内皮细胞损伤及血栓前状态的相关标志物水平变化的临床诊断价值。方法 选取我院收治的高血压伴高Hcy患者80例为观察组,选择同期Hcy水平正常的原发性高血压患者60例为对照组,选择同期门诊体检健康者40例为正常组。比较三组研究对象的血管内皮细胞损伤及血栓前状态的相关标志物的水平情况。结果 观察组患者Hcy、血栓调节蛋白(TM)、超敏C反应蛋白(hs-CRP)、血管性假性血友病因子(vWF)、血小板α颗粒膜蛋白-140(GMP-140)、纤溶酶原激活物抑制物-1(PAI-1)、纤维蛋白原(FIB)、D-二聚体(D-D)水平明显高于对照组与正常组(均P<0.05),而叶酸、维生素B12及组织型纤溶酶原激活物(t-PA)水平明显低于对照组与正常组(均P<0.05)。结论 高血压伴高Hcy患者的Hcy、TM、hs-CRP、vWF、GMP-140、PAI-1、FIB、D-D水平较高,而叶酸、维生素B12、t-PA水平较低。
[关键词] 高血压;血管内皮细胞损伤;血栓前状态;高同型半胱氨酸
中图分类号:R544.1
文献标识码:A文章编号:1009-816X(2019)02-0130-04
doi:10.3969/j.issn.1009-816x.2019.02.007
高血压伴高同型半胱氨酸(Hcy)患者的血管内皮细胞损伤及血栓前状态的相关标志物水平变化十分重要,可以有效评估高血压伴Hcy病情控制情况,指导合理科学用药[1,2]。血栓前状态是指血液凝血纤溶系统紊乱,易形成血栓的病理状态[3]。目前临床多侧重患者的降血压以及降Hcy水平等方面的研究,关于高血压伴高Hcy患者血栓前状态的相关标志物的监测以及血管内皮细胞损伤机制研究较少[4],本研究旨在分析高血压伴高Hcy患者其血管内皮细胞损伤的相关标志物水平变化情况,为临床治疗提供一定的参考,报道如下。
1 资料与方法
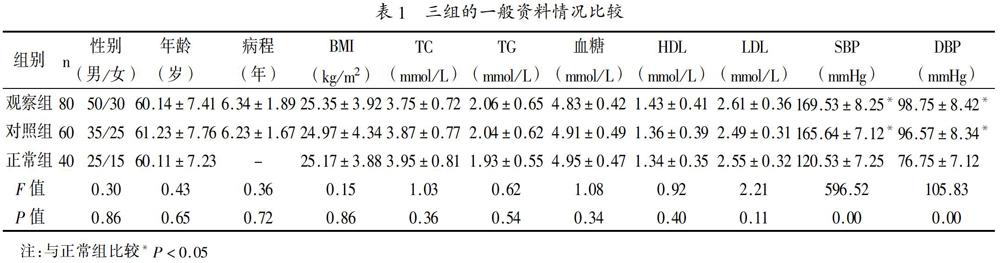
1.1 一般资料:选取我院2016年10月至2017年12月接收治疗的高血压伴高Hcy患者80例为观察组,选择同期Hcy水平正常的原发性高血压患者60例为对照组。入选患者均知情同意本次研究,签署知情同意书,且本研究通过本院伦理委员会批准,纳入标准:所有入选患者均符合高血压及高Hcy诊断标准[5],即Hcy≥15μmol/L,舒张压(DBP)≥90mmHg和(或)收缩压(SBP)≥140mmHg。排除标准:(1)继发性糖尿病、高血脂、高血压的患者;(2)合并恶性肿瘤及严重脏器功能障碍者;(3)入组前7天服用影响凝血和纤溶系统的药物。选择同期门诊体检健康者40例为正常组。三组患者性别、年龄、体质量指数(BMI)、总胆固醇(TC)、甘油三酯(TG)、血糖、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)比较无统计学意义(P>0.05),而SBP、DBP比较差异有统计学意义(P<0.05),见表1。
1.2 方法:采集研究对象清晨空腹肘静脉血4mL,2mL放入3.2%枸橼酸钠抗凝管中立即摇匀,2000r/min迅速离心15min,取上清液(血浆,黄色)统一编号,置于-20℃的冰箱中待检。血浆Hcy水平通过乳胶比浊法检测,采用酶联免疫吸附(ELISA)法测定血浆血栓调节蛋白(thrombomodulin,TM)、超敏C反应蛋白(high-sensitivity-C-reactive protein,hs-CRP)、血管性假性血友病因子(vascular von willebrand factor,vWF)、血小板α颗粒膜蛋白-140(granule membrane protein-140,GMP-140)、纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)、组织型纤溶酶原激活物(tissue plasminogen activator,t-PA);采用CA7000血凝分析仪测定纤维蛋白原(fibrinogen,FIB)、D-二聚体(D-dimer,D-D),以上测试过程均严格按照仪器说明书进行操作,相关试剂均为仪器配套试剂。
1.3 统计学处理:采用SPSS 19.0版统计软件,计量资料用(x-±s)来表示,多组间比较采用单方差分析,两两比较采用SNK法;计数资料用例(%)表示,采用χ2检验,组间均数两两比较用q检验,等級资料组间比较采用秩和检验,P<0.05为差异有统计学意义。
2 结果
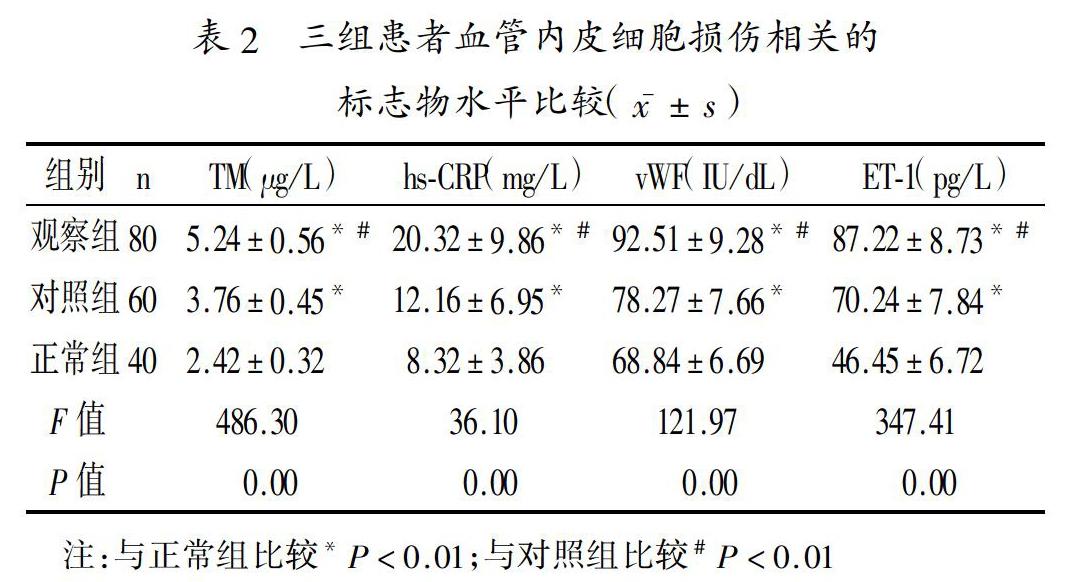
2.1 三组患者血管内皮细胞损伤相关的标志物水平比较:观察组患者vWF、ET-1、TM、hs-CRP水平明显高于对照组与正常组,差异有统计学意义(P<0.05)。见表2。
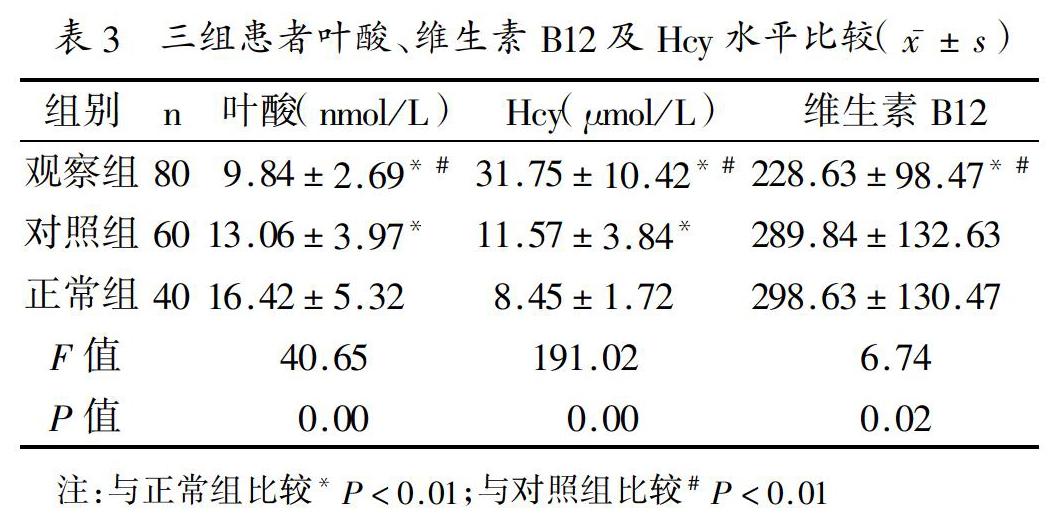
2.2 三组患者叶酸、维生素B12及Hcy水平比较:观察组患者的Hcy水平明显高于对照组与正常组(P<0.05),而叶酸、维生素B12水平明显低于对照组与正常组(P<0.05),见表3。
2.3 三组患者血小板与凝血功能相关标志物水平比较:观察组患者GMP-140、FIB、D-D、PAI-1水平明显高于对照组与正常组(P<0.05),而t-PA水平明显低于对照组与正常组,差异有统计学意义(P<0.05),见表4。
3 讨论
高血压是临床上较为多见的疾病,其诱发因素比较多,包含精神应激、肥胖、遗传以及高钠低钾饮食等,而血浆高Hcy水平的原因则有摄入维生素B6、叶酸不足,高蛋氨酸蛋白饮食等,二者协同作用,会明显提升患者发生心脑血管事件的风险[6,7]。有研究显示,Hcy水平过高会造成心脑血管事件,每当Hcy水平降低3μmol/L,发生脑卒中的几率就降低32%,而每当Hcy水平升高5μmol/L,发生脑卒中的几率就升高59%[8]。另外,Azegami等[9]研究指出,高血压伴高Hcy患者发生脑卒中的几率要比单纯高血压患者高4倍,是发生脑卒中最为危险的因素。
Hcy是一种无法由食物直接获得的含硫氨基酸,是蛋氨酸循环的代谢产物,其形成的过程中需有N10-亚甲基四氢叶酸、维生素(维生素B12、叶酸、维生素B6)、β-胱硫醚合成酶以及N5等辅助因子[9]。叶酸、维生素B6是重要的辅酶,一旦缺少叶酸,Hcy水平会升高产生堆积,当血浆Hcy过高就会损害血管内皮细胞,同时SBP、DBP上升,加重动脉硬化,引发严重的心脑血管事件[10,11]。本研究显示,高血压伴高Hcy患者的Hcy水平明显高于正常Hcy水平高血压患者与正常健康者,而叶酸、维生素B12水平明显低于正常Hcy水平高血压患者与正常健康者。故临床治疗高血压伴高Hcy患者需充分补充叶酸与维生素B12,降低Hcy水平,达到降血压,舒张血管,预防动脉粥样硬化和血栓形成的作用。近年来临床也显示,补充充分的叶酸和维生素B12,虽然可以降低Hcy水平,但是仅通过降低Hcy水平来预防心脑血管事件尚存在较大的争议[12]。目前多项研究一致认为,高血压伴高Hcy患者的临床症状多表现为血小板活化、凝血功能紊乱、血管内皮细胞损伤、血液流变学改变等四方面的血栓前状态[13,14]。血栓前状态的相关标志物检测具有较高的临床指导价值,可以有效地评估患者病情[15,16]。
本研究选择代表性的血管内皮细胞损伤相关的指标vWF、心血管活动的重要调节因子ET-1、血管内皮细胞膜表面的一种跨膜糖蛋白TM与非特异性的炎症因子hs-CRP,凝血功能相关标志物中血液凝固性增强与继发性纤溶亢进指标D-D、t-PA及其对应的生理抑制剂PAI-1、t-PA以及凝血功能中血液高凝状态指标FIB,血小板激活的特异性分子标志物GMP-140,评估高血压伴高Hcy患者病情。结果显示高血压伴高Hcy患者的血小板活化释放促凝物质进入血液循环,同时hs-CRP增加血管紧张素受体表达,发生血管壁的炎症反应,促进异常的高凝作用和纤溶亢进,导致凝血功能紊乱而纤溶功能减退,增加血管阻力,进一步加剧血管内皮细胞损伤程度,形成血栓前状态,加速血管硬化进程[17]。综上所述,高血压伴高Hcy患者的Hcy、TM、hs-CRP、vWF、GMP-140、PAI-1、FIB、D-D水平较高,而叶酸、维生素B12、t-PA水平较低,以上标志物水平可评估高血压患者的病情。故临床治疗高血压伴高Hcy患者要尽早药物治疗,同时做好以上各标志物的监测,延缓血栓前状态的形成。
参考文献
[1]Wang W, Duan K, Ma M, et al. Tranexamic acid decreases visible and hidden blood loss without affecting prethrombotic state molecular markers in transforaminal thoracic interbody fusion for treatment of thoracolumbar fracture-dislocation[J]. Spine,2017,43(13):E734-E739.
[2]Hobbelt AH, Spronk HM, Crijns HJGM, et al. Prethrombotic state in young very low-risk patients with atrial fibrillation[J]. J Am Coll Cardiol,2017,69(15):1990-1992.
[3]方宇,刘惠莲,杨克平,等.H型高血压患者血管的结构功能及其血栓前分子标记物的变化[J].血栓与止血学,2018,24(2):197-200.
[4]Yaghootkar H, Lotta LA, Tyrrell J, et al. Genetic evidence for a link between favorable adiposity and lower risk of type 2 diabetes, hypertension, and heart disease[J]. Diabetes,2016,65(8):2448-2460.
[5]孙宁玲,李建平,卢新政,等.H型高血压诊断标准依据解读[J].中华高血压杂志,2017,25(6):508-510.
[6]倪云忠.老年H型高血压合并糖尿病患者血浆同型半胱氨酸水平与颈动脉内膜厚度关系的研究[J].中国实验诊断学,2017,21(10):1770-1772.
[7]Mao X, Xing X, Xu R, et al. Folic acid and vitamins D and B12 correlate with homocysteine in Chinese patients with type-2 diabetes mellitus, hypertension, or cardiovascular disease[J]. Medicine,2016,95(6):e2652-e2659.
[8]纪昕,岳晓乐,赵丹丹,等.同型半胱氨酸与动脉粥样硬化患者血管内皮细胞损伤相关性[J].标记免疫分析与临床,2017,24(1):73-76.
[9]Azegami T, Yuki Y, Hayashi K, et al. Intranasal vaccination against angiotensin II type 1 receptor and pneumococcal surface protein A attenuates hypertension and pneumococcal infection in rodents[J]. J Hyper,2018,36(2):387-394.
[10]柳相珍,张媛,徐成伟,等.子痫前期患者血浆中可溶性内皮细胞蛋白C受体与血管性血友病因子及可溶性血栓调节蛋白的水平变化[J].中华检验医学杂志,2016,39(10):783-785.
[11]陈孝红,王卓,马婷,等.vWF预测H型高血压患者血栓前状态的意义[J].昆明医科大學学报,2017,38(5):74-77.
[12]Landolt-Marticorena C, Prokopec SD, Morrison S, et al. A discrete cluster of urinary biomarkers discriminates between active systemic lupus erythematosus patients with and without glomerulonephritis[J]. Arthritis Research & Therapy,2016,18(1):218-229.
[13]叶梓,王世杰,李辉,等.血管内皮细胞中的凝血物质:理论研究新进展[J].中国组织工程研究,2017,21(4):627-632.
[14]贾贤达,杨庆华,茹建平.H型高血压患者血浆炎性因子及血流动力学的变化[J].宁夏医科大学学报,2017,39(2):230-232.[15]Pang H, Han B, Fu Q, et al. Association of high homocysteine levels with the risk stratification in hypertensive patients at risk of stroke[J]. Clin Ther,2016,38(5):1184-1192.[16]张勇.H型高血压患者血管内皮功能变化及与血浆同型半胱氨酸水平的关系[J].河北医药,2017,39(17):2593-2596.[17]Psaila B, Barkas N, Iskander D, et al. Single-cell profiling of human megakaryocyte-erythroid progenitors identifies distinct megakaryocyte and erythroid differentiation pathways[J]. Genome Biology,2016,17(1):83-101.
(收稿日期:2018-11-10)

