QuEChERS-超高效液相色谱-三重四极杆质谱测定野生食用菌中尼古丁
林 涛,魏茂琼,余积东,李茂萱,邹艳虹,沙凌杰,刘宏程*
(1. 云南省农业科学院质量标准与检测技术研究所, 云南 昆明 650205; 2. 农业农村部农产品质量安全风险评估实验室(昆明), 云南 昆明 650205; 3. 云南省德宏州芒市农产品质量安全监督检测站, 云南 芒市 678400)
云南因其特殊的地理位置和气候条件而拥有丰富的野生食用菌资源,其营养丰富、味道鲜美,深受消费者的喜爱。然而,在2008年11月,德国的EUROFINS实验室[1]报道了牛肝菌中尼古丁含量超标(德国规定食用菌鲜品中的最大残留限量为0.05 mg/kg),野生食用菌中的尼古丁受到了广泛的关注。研究[2]结果表明,尼古丁属内源性代谢产物,不同产地品种的食用菌中都能检出尼古丁,且同一子实体的不同部位中尼古丁的含量差别较大。为此,各国也纷纷为食用菌中的尼古丁规定了最大残留限量。2009年,欧盟[3]修订了食用菌类中尼古丁的最大残留限量,即食用菌鲜品中为0.036 mg/kg,干燥牛肝菌为2.3 mg/kg,除牛肝菌外的干燥野生菌为1.17 mg/kg。日本肯定列表[4]中规定了草菇中的最大残留限量为2 mg/kg。
尼古丁又名烟碱,对生物体具有很多毒副作用,能够使心跳加快、血压上升和精神状况改变等,可促进血小板凝集,造成心血管阻塞、中风等急慢性疾病[5-8]。野生食用菌的种类较多,基质成分复杂,尼古丁在不同野生食用菌中的含量各不相同,常规测定方法难以达到测定要求,因此,目前对于野生食用菌中尼古丁测定方法的文献报道不多。Cavalieri等[9]利用QuEChERS方法对不同食用菌中尼古丁进行了测定,但其未考虑到野生菌干样在提取前的复水性因素,影响了最终的尼古丁提取效率;Lin等[10]利用毛细管电泳-安培检测器测定了食用菌中的尼古丁含量,其灵敏度无法满足部分低含量尼古丁的食用菌的测定;Müller等[11]利用GC-MS/MS测定了食用菌中尼古丁的含量,该方法操作相对简单,但是也存在一定的基质干扰;Wang等[12]利用高通量动态微波辅助萃取,并结合在线SPE测定了食用菌中的尼古丁含量,得到了较好的分析效果,但是该方法采用的技术较先进,不利于实验室的广泛使用;杨俊等[13]利用超高效液相色谱-串联质谱仪测定了食用菌中的尼古丁,但是该方法采用了纯水作为提取溶剂,提取溶液成分复杂,不利于后续的质谱定量分析。
目前,在野生食用菌中尼古丁测定过程中普遍存在基质复杂、提取效率低、净化效果差及灵敏度低等现象,针对这些问题,本研究对传统的QuEchERS方法、尼古丁的色谱和质谱条件等进行优化,以期建立测定野生食用菌中尼古丁的高效、快速、高灵敏的超高效液相色谱-串联质谱方法。
1 实验部分
1.1 仪器与试剂
API 5500 Q TRAP三重四极杆质谱仪(美国AB公司); 1290Ⅱ超高效液相色谱仪(美国Agilent公司); ZORBAX RRHD色谱柱(50 mm×2.1 mm, 1.8 μm,美国Agilent公司); BSA224S-CW电子分析天平(德国Sartorius公司);涡旋混匀器(美国Thermo Scientific公司); TDL-40C高速台式离心机(上海安亭科学仪器厂)。
尼古丁(纯度为99%)购买于加拿大Toronto Research Chemicals公司;甲醇和乙腈(均为色谱纯)购买于德国Merck公司;无水硫酸镁、NaCl、乙酸铵、氨水(均为分析纯)购买于国药集团化学试剂有限公司;甲酸(色谱纯)、石墨化碳黑(GCB)吸附剂(45 μm)购买于美国Sigma公司; ProElut NH2、C18、N-丙基乙二胺(PSA)、Florisil填料(50 μm)均购买于中国迪马科技;纯净水(购买于杭州娃哈哈公司)。
1.2 实验方法
1.2.1标准溶液配制
称取10 mg尼古丁,用乙腈溶解后定容至10 mL,得到1 g/L的尼古丁标准储备液,再用乙腈稀释成不同浓度的标准溶液,于-20 ℃下避光保存。
1.2.2样品处理
野生食用菌子实体,包括其菌盖和菌柄经烘干后粉碎混匀(新鲜样品将其整个子实体匀浆混匀),参照文献[14-17]的方法加以改进,称取0.5 g野生食用菌干样(鲜样称取5.0 g)于离心管中,加入2 mL水(鲜样无需加水),涡旋1 min后静置15 min,使样品充分润湿,再加入10 mL氨水-乙腈(6∶94, v/v)提取液,涡旋振荡2 min后加入3 g NaCl,涡旋混匀后以5 000 r/min的速度离心5 min,取2 mL上清液于另一离心管中,加入200 mg无水硫酸镁、150 mg PSA和50 mg GCB,涡旋混合1 min后,以5 000 r/min的速度离心2 min,吸取1.0 mL上层提取液,过0.22 μm有机相滤膜,待分析。
1.2.3色谱条件
利用乙腈和0.1%(体积分数,下同)氨水溶液作为流动相。流速:0.2 mL/min;柱温:35 ℃;进样量:0.5 μL,梯度洗脱步骤如表1所示。

表 1 梯度洗脱参数
1.2.4质谱条件
采用ESI源,正离子MRM扫描模式,参照文献[18-21]中相关质谱条件,并根据本实验仪器条件进行优化,得到相关参数如下:气帘气流速为20 L/h,雾化气流速为55 L/h,辅助气流速为55 L/h,辅助加热气温度为650 ℃,喷雾电压为5 500 V。定量离子对为m/z163.0>130.0,定性离子对为m/z163.0>117.0,去簇电压为80 V,碰撞电压分别为25 V和35 V。
2 结果与讨论
2.1 色谱条件的优化选择
首先比较了利用乙腈和甲醇分别作为有机相时的色谱出峰情况。结果表明,利用甲醇作为有机相时尼古丁存在一定的拖尾现象,而乙腈作为有机相时的峰形较好,无拖尾现象,色谱图见图1。
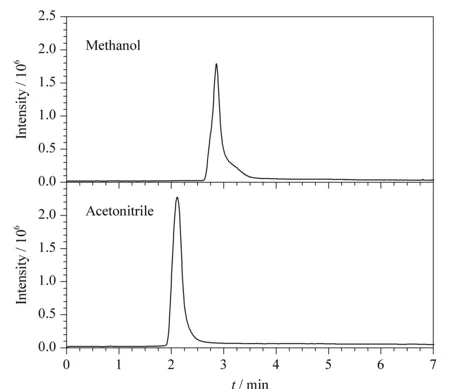
图 1 尼古丁在甲醇和乙腈为有机相时的色谱图Fig. 1 Chromatograms of nicotine using methanoland acetonitrile as the organic phase

图 2 尼古丁在酸性和碱性流动相下的色谱图Fig. 2 Chromatograms of nicotine using acidicand alkaline mobile phases
另一方面,比较了流动相条件中的酸碱性对尼古丁出峰的影响,采用乙腈作为有机相,分别比较了甲酸-水溶液(0.1∶99.9, v/v)和氨水-水溶液(0.1∶99.9, v/v)的出峰效果。结果表明,在酸性流动相条件下,尼古丁能够被电离,且具有较好的水溶性,因此在反相色谱柱上的保留较差[22],同时尼古丁在酸性条件下形成盐,极性较大,呈现出双峰形状,而在碱性条件下峰形则较好,达到了较好的色谱分离效果(见图2)。
2.2 尼古丁提取条件的优化
2.2.1提取前加水体积的选择
常见的野生食用菌主要包含新鲜样品和经烘干脱水后的干样,对于新鲜食用菌样品,可直接加入提取溶剂进行提取,而对于干样,常需要在加入提取溶剂前加入一定量的水,以使干样润湿吸水后恢复至新鲜状态,从而保证目标化合物在干样中的提取率与新鲜样品一致。根据欧盟[23]对于农药检测方法的要求,对于含水量低于10%的样品,样品称样量(g)与加水体积(mL)的比例应为1∶2~1∶5。因此,本研究比较了称样量(g)与加水体积(mL)的比例分别为1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6和1∶7时尼古丁的提取效果。结果表明,当不加水时,样品无法润湿,有机试剂难以进入样品细胞内部,从而影响了目标化合物的提取效率。随着加水量的不断增加,尼古丁的提取效率不断增大。当称样量(g)与加水体积(mL)的比例为1∶4和1∶5时,提取效率达到最大,其后又随着加水量的增大而降低。水相体积的不断增大使得后续NaCl饱和步骤中的饱和度不断降低,从而减小了尼古丁在有机相中的含量。综合考虑后,选择本试验中野生食用菌中称取0.5 g干样后加入2 mL水,可达到较好的提取效果。
2.2.2提取溶剂的选择
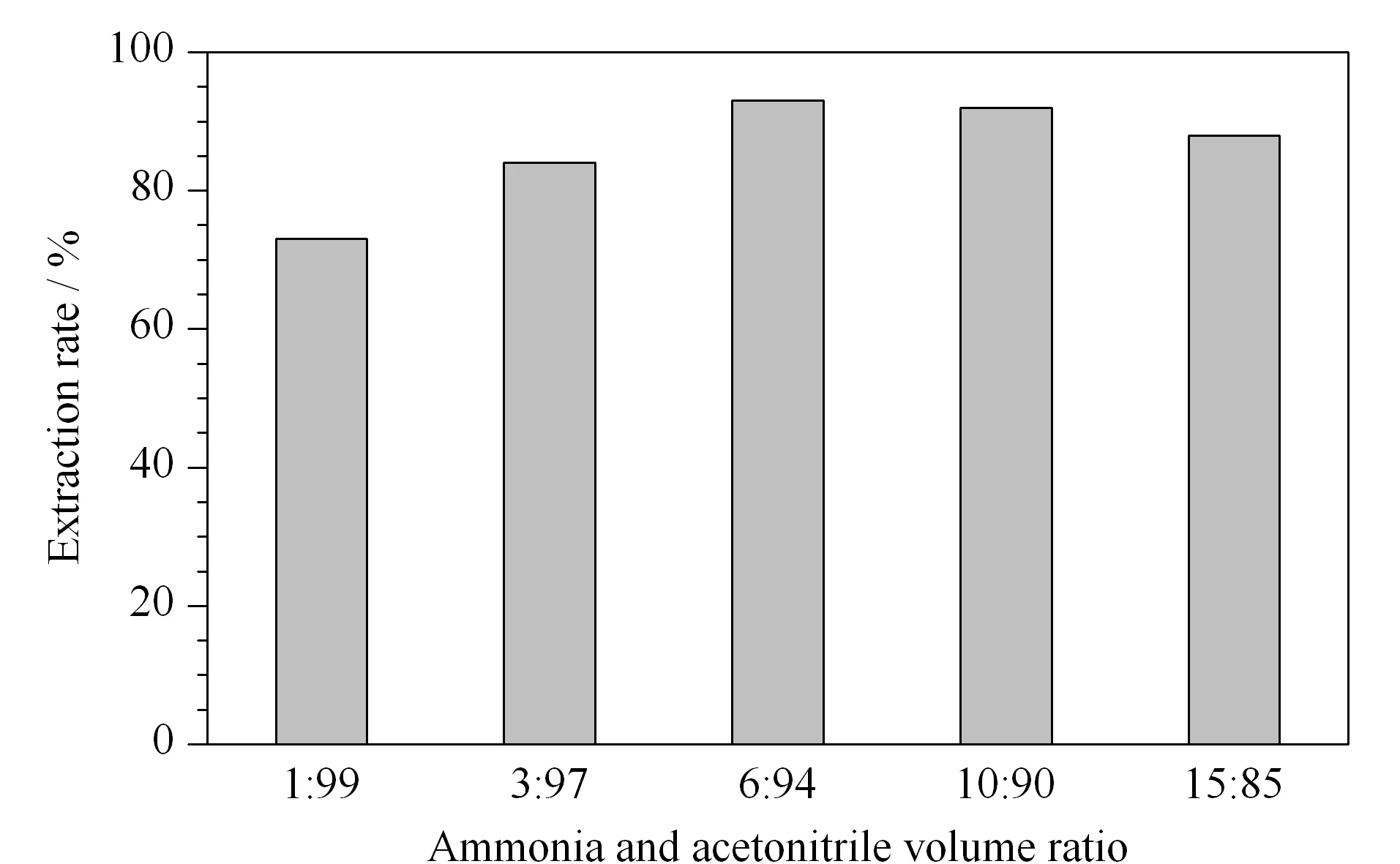
图 3 不同氨水和乙腈体积比对于尼古丁提取效率的影响Fig. 3 Effects of the different ammonia water and acetonitrile volume ratio on the extraction efficiencies of nicotine
尼古丁含有一个叔胺基团和一个吡啶基团,其pKa值分别为8.2和3.1[24],表明尼古丁在不同的pH条件下的溶解性不同。常规情况下,尼古丁易溶于水等大极性溶剂,但是野生食用菌的水提物成分复杂,不利于后续的分析测定,因此,本研究中首先比较了甲醇和乙腈两种常规溶剂在中性pH条件下的提取效果。结果表明这两种溶剂的提取效率较差。又分别在甲醇和乙腈提取溶剂中加入0.1%的甲酸,提取效果仍然不好,尼古丁由于在酸性条件下具亲水性而难以溶于有机相中。而在提取溶剂中加入0.1%的氨水可增大提取环境中的pH值,能够有效抑制尼古丁在水中的溶解性,使其充分溶解于有机相中。综合比较,碱性乙腈的提取效果比碱性甲醇的提取效果好。另一方面,比较了1%氨水、3%氨水、6%氨水、10%氨水和15%氨水-乙腈对尼古丁的提取效果。结果如图3所示,当氨水体积比达到6%和10%时,提取效率达到最大(93%);其后随着氨水比例的增大,提取效率降低。氨水体积的不断增大,使得提取溶剂中水相比例增大而乙腈比例减小,影响了后续的NaCl饱和水相效果,不利于乙腈和水相的液液萃取过程,从而降低了尼古丁的提取效率。综上,选取6%氨水-乙腈溶液作为提取溶剂。
2.2.3净化填料的选择
选取目前常用的GCB、NH2、C18、PSA和Florisil净化填料,分别比较了其对尼古丁的净化效果。结果表明,C18和Florisil净化填料对于尼古丁具有一定的吸附作用,回收效果稍差(回收率为80%左右),而NH2和PSA填料对于尼古丁的净化效果较好(回收率均为94%左右),其次为GCB(回收率为85%左右)。如图4所示,GCB能够有效除去提取液中的色素且不影响回收效果,其次为PSA。鉴于野生食用菌的种类繁多,基质复杂,提取溶液大多含有色素及糖类物质,如果GCB的用量过多会对尼古丁有所吸附,而PSA对于尼古丁的吸附力较弱,且鉴于PSA能够有效除去野生食用菌中的糖类物质,因此,确定将GCB和PSA作为混合填料共同对尼古丁提取溶液进行净化。

图 4 不同净化填料对于尼古丁提取溶液的净化效果Fig. 4 Purification effects of different purificationfillers on nicotine extraction solution NH2: amino propyl; PSA:N-propylethylenediamine; GCB: graphitized carbon black.
比较了GCB和PSA不同配比对于尼古丁的净化效果影响。比较了GCB和PSA分别为10 mg∶190 mg、30 mg∶170 mg、50 mg∶150 mg、70 mg∶130 mg和90 mg∶110 mg的不同净化效果。结果表明,当GCB加入量为10 mg和30 mg时,对于提取液中的色素不能完全吸附,加入50 mg时能够完全将提取溶液中的色素吸附,但是当GCB的加入量继续增多时,则会对尼古丁有一定的吸附作用,综上,选取GCB和PSA的添加量分别为50 mg和150 mg为优。
2.3 方法学考察
2.3.1线性范围和检出限
利用乙腈将尼古丁标准溶液稀释成不同的浓度,测定其峰面积,并以峰面积和相应的浓度进行线性回归;利用野生食用菌基质进行加标并不断降低加标浓度,当达到3倍和10倍信噪比(S/N)时所对应的加标浓度即为最低检出限和定量限。实验结果表明,尼古丁在0.05~50.0 μg/L的范围内相关系数较好(r2=0.999 9),定量限为0.2 μg/kg,检出限为0.05 μg/kg。
2.3.2回收率和精密度
分别以牛肝菌、羊肚菌和姬松茸为对象进行回收试验,加标水平分别为1倍、5倍和10倍定量限,每个水平平行试验6次。结果如表2所示,尼古丁的平均回收率为86.3%~96.4%,相对标准偏差为4.4%~6.3%。
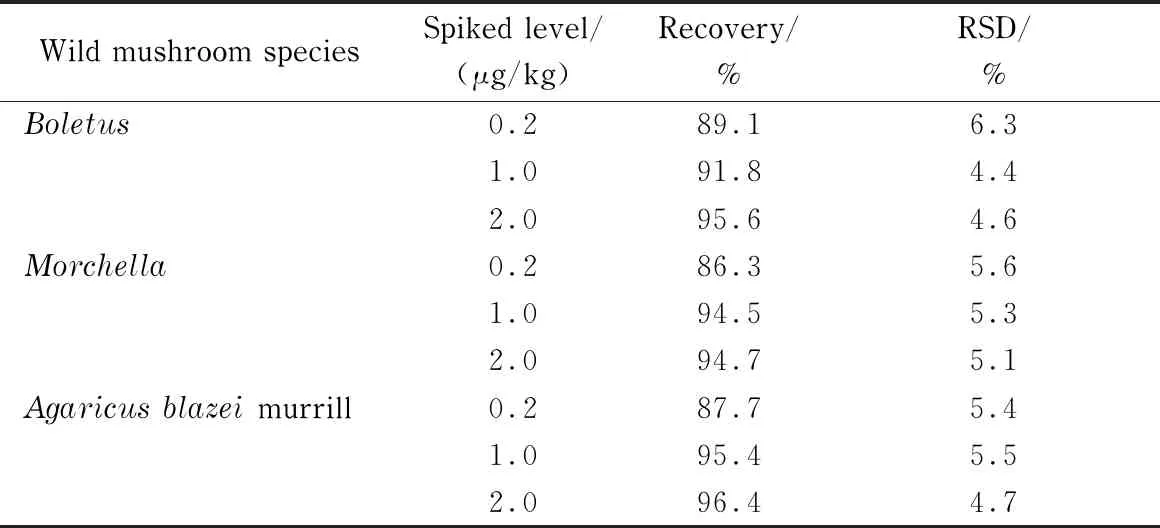
表 2 尼古丁的回收率和相对标准偏差(n=6)
2.4 实际样品测定
采用本方法对云南省牛肝菌、羊肚菌、姬松茸和松茸等野生食用菌样品中的尼古丁进行测定,牛肝菌中尼古丁含量为0.038~1.011 mg/kg,羊肚菌中尼古丁含量为0.009~0.561 mg/kg,姬松茸中尼古丁含量为0.011~0.725 mg/kg,松茸中尼古丁含量为0.002~0.216 mg/kg。
3 结论
本文利用改进的QuEChERS方法,系统探究了野生食用菌样品复水量与提取率的关系,提取溶剂的选择及净化材料的选择等,利用超高效液相色谱-三重四极杆串联质谱,建立了野生食用菌中尼古丁的快速高灵敏度测定方法,适用于目前食用菌产业中对尼古丁的快速检测工作。

